新生儿B族链球菌早发型败血症与巨噬细胞极化相关细胞因子表达水平的关系①
2020-04-13林彦青邱晓媚李盛勇叶健斌杨传忠
林彦青 邱晓媚 李盛勇 叶健斌 杨传忠
(深圳市妇幼保健院新生儿重症监护室,深圳 518028)
B族链球菌(group B Streptococcus,GBS)主要寄生于人类下消化道及泌尿生殖道,属于条件致病菌,是围产期母婴感染的主要致病菌之一[1,2]。孕妇下生殖道致病微生物的逆行扩散和顺产过程中胎儿通过产道接触致病微生物是GBS引起宫内感染的主要途径,而胎儿吸入或吞咽感染的羊水可导致呼吸道及全身感染。我国孕妇GBS带菌率约为10.1%~32.4%,新生儿GBS所致早发型败血症的发病率约为1.6%~2.1%,高定植率和低发病率是围产期GBS的流行病学特点之一。培养法是诊断新生儿早发型败血症的金标准,但其检测周期较长,不利于临床医师对病情的早期评估。既往已有研究证实,GBS中的夹膜多糖(CPS)、磷脂多糖(LPS)等可作用于母体及胎儿的炎性细胞并诱导其产生不同细胞因子,其中以巨噬细胞为主的固有免疫应答在该过程中发挥重要作用[3,4]。因此本文通过Bio-plex悬浮芯片技术检测多种血清因子,评估脐血中巨噬细胞极化相关细胞因子和趋化因子水平在诊断新生儿早发型GBS感染中的临床价值。
1 资料与方法
1.1资料 本研究采取回顾性病例对照分析,选取2015年6月至2017年6月于深圳市妇幼保健院分娩新生儿80例。其中确诊为母源性早发型GBS败血症的新生儿25例,母亲阴道肛周分泌物培养法确诊为GBS定植的新生儿 30例,正常对照组25例。试验经伦理委员会审核批准(批准文号:2016011)。GBS定植组入组标准:母亲孕期确诊GBS定植,新生儿生后随访7 d无感染症状者。GBS感染组入组标准:根据2019年《新生儿败血症诊断及治疗专家共识》建议[5],母亲孕期确诊GBS定植,新生儿于生后3 d内发病,实验室检查无菌体腔标本(血、脑脊液)GBS培养阳性者。部分孕母确诊GBS定植,但血培养阴性的新生儿出现发绀、呻吟、气促等呼吸窘迫症状或体温不稳、花纹、低血压等循环障碍,如胃液、皮肤拭子培养GBS阳性,且血液非特异性检查(白细胞计数、CRP、PCT等)异常者,排除其他病原菌感染也纳入标准内。
1.2方法
1.2.1标本采集和鉴定 孕期GBS确诊方法[6]:用一次性无菌聚酯纤维拭子采集孕妇(孕周>34周)阴道和肛周分泌物进行鉴定培养(培养方法:B族链球菌选择性培养平板),并排除其他阴道常见病原菌(衣原体、支原体)混合感染。
新生儿GBS早发型败血症确诊方法:临床标本(血液、脑脊液、刚娩出新生儿的胃液及皮肤拭子)经培养法确诊GBS阳性且母亲孕期已确诊GBS定植的新生儿。
1.2.2巨噬细胞极化相关细胞因子和趋化因子 根据文献报道,当巨噬细胞受到不同炎症刺激时,以下细胞因子和趋化因子可发生变化(见表1,其中巨噬细胞游走抑制分子MIF为抑制性趋化因子)。需要特别强调的是虽然巨噬细胞是这些细胞因子的主要来源,但他们也可以由活化的淋巴细胞、内皮细胞和成纤维细胞产生[7-9]。
表1 巨噬细胞极化相关细胞因子和趋化因子
Tab.1 Polarization-related cytokines and chemokines in macrophages
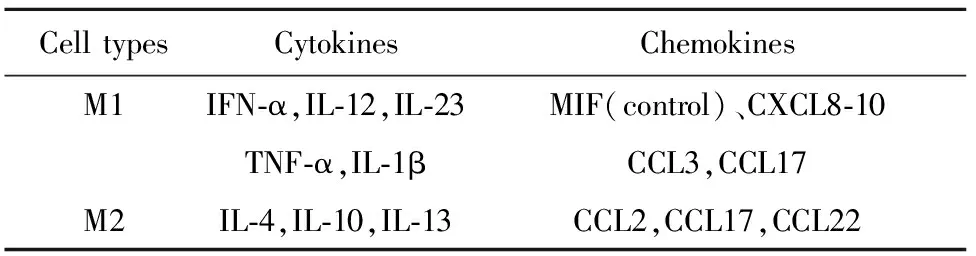
Cell typesCytokinesChemokinesM1IFN-α,IL-12,IL-23MIF(control)、CXCL8-10TNF-α,IL-1βCCL3,CCL17M2IL-4,IL-10,IL-13CCL2,CCL17,CCL22
1.2.3细胞因子和趋化因子的检测方法 待检测脐动脉血2 ml,离心留取上清液放置-80℃备用。采用Bio-plex悬液芯片多重检测技术,检测目标细胞因子和趋化因子水平。通过绘制标准曲线求出标本中待检因子的质量浓度。

2 结果
2.1临床资料 根据2010美国CDC《围产期GBS预防指南》建议,我院对34~37周孕妇常规筛查生殖道和直肠分泌物。对筛查阳性的病例随访其分娩的新生儿,根据临床检测方法将不同诊断结局分为GBS定植组(30例)和GBS感染组(25例),并收集同时期孕母明确无GBS定植的临床病例25例作为正常对照组。2例(8%)产前发热(体温>37.5℃),5例(20%)胎膜早破,1例(4%)胎盘病理为绒毛膜羊膜炎。入选的新生儿临床基本特征见表2。
2.2Bio-plex细胞因子和趋化因子检测范围 通过Bio-plex绘制待检细胞因子和趋化因子的标准曲线。检测上限与检测下限见表3。
2.3GBS介导脐血M1、M2巨噬细胞极化相关细胞因子和趋化因子的变化
2.3.1GBS介导脐血中M1巨噬细胞极化相关细胞因子和趋化因子的变化 GBS感染组和GBS定植组的脐血血清中IFN-γ、CXCL9和CXCL10的表达水平显著高于正常对照组(P<0.05),且GBS感染组的IFN-γ和CXCL9高于GBS定植组(P<0.05),同时GBS定植组的MIF表达水平显著低于正常对照组。该结果提示GBS定植但无感染状态下新生儿体内的巨噬细胞具有向促炎症的M1巨噬细胞分化并有分泌相关细胞因子的趋势。见图1。
表2 80例入选病例基本临床特征
Tab.2 Basic clinical features of 80 cases

GroupsnGenderMaleFemaleGestationalage(week)Complications(n)1)The control group25121338.03±3.422GBS engraftment group30131738.32±3.142GBS infection group25121337.84±2.993
Note:1)The mother during pregnancy complications including:gestational diabetes,gestational hypertension,intrahepatic cholestasis during pregnancy.
表3 待检测细胞/趋化因子的检测下限和检测上限
Tab.3 Lower and upper detection limits of target cytokines and chemokines

Cytokines/chemokineUpper limit(pg/ml)Lower limits(pg/ml)IFN-γ6.159 721.27CXCL91.652 2748.40CXCL101.6519 561.15MIF16.76418 963.35CCL30.261 118.17IL-41.024 177.51IL-100.184 898.93CCL20.345 465.54CCL170.193 454.44

图1 三组研究对象M1巨噬细胞极化相关细胞因子和趋化因子水平比较Fig.1 Comparision of polarization-related cytokines and chemokines levels of M1 macrophages in three groupsNote:*.P
2.3.2GBS介导脐血中M2巨噬细胞极化相关细胞因子和趋化因子的变化 GBS感染组中IL-4、IL-10和CCL17的水平均高于另外两组(P<0.05),但三组的CCL2水平并没有明显变化。该结果提示GBS定植且感染状态下新生儿体内的巨噬细胞具有向抗炎症的M2巨噬细胞分化并分泌相关细胞因子的趋势。见图2。

图2 三组研究对象M2巨噬细胞极化相关细胞因子和趋化因子水平比较Fig.2 Comparision of polarization-related cytokines and chemokines levels of M2 macrophages in three groupsNote:*.P
3 讨论
GBS沿生殖道逆行至宫内时,上皮细胞是抵御病原菌感染的第一道防线。其中巨噬细胞是黏膜皮肤屏障的主要固有免疫应答细胞,能够诱导、吞噬、消灭外来入侵病原体,刺激细胞因子的释放,在功能上极具可塑性,随微环境中不同细胞因子和趋化因子的作用,M0巨噬细胞可极化为M1巨噬细胞或M2巨噬细胞[10,11],目前多数学者的观点认为这两种极化作用相互拮抗[12]。当病原体入侵机体时,M0接触干扰素gamma(IFN-γ)后可极化为M1,产生炎性因子。IFN-γ可激活JAK-STAT信号通路中STAT1,活化巨噬细胞对微生物的杀伤能力和抗原提呈能力,并促使促炎细胞因子的分泌和杀死入侵的病原体,其独特的Toll样受体(TLR)和环磷酸鸟苷-腺苷酸合成酶(cGAS)可通过招募趋化因子(CCL3、CXCL8-10等)和释放细胞因子(IL-6)来激活其他免疫细胞[13-15]。此外,M1巨噬细胞分泌高水平活性氧(ROS)和活性氮(RNS),产生iNOS,促进精氨酸分解为一氧化氮和瓜氨酸,介导病原体的死亡[16]。本次研究结果表明,GBS感染组和GBS定植组的脐血血清中M1极化相关细胞因子IFN-γ水平高于正常对照组,GBS定植组中M1相关的趋化因子CXCL9和CXCL10水平高于正常对照组,提示新生儿在GBS定植状态,M0主要向M1极化。
M2是具有抗炎活性的巨噬细胞亚群,可大量分泌IL-10,拮抗M1的促炎作用,在炎症反应的主要功能是限制组织损伤,抑制炎症反应。有研究证明在感染性疾病中,病原体可诱导巨噬细胞向M2型分化从而逃避机体的免疫反应。GBS表面的三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)可通过诱导巨噬细胞吞噬,刺激IL-10分泌,在早期发挥抗炎作用。但随着体内IL-10增高,可反馈性抑制中性白细胞的抗炎作用,超过了在单核吞噬细胞系统中IL-10的直接抗炎作用,促进GBS的增殖。在IL-10出现持续高表达的新生儿或新生鼠的GBS感染模型中,败血症的发生率增高[17,18]。虽然趋化因子CCL17由M1巨噬细胞产生,但有研究发现M2的极化与CCL17的显著上调有关。这与本文中三组CLL17变化趋势一致。此外,GBS感染组中M2相关细胞因子(IL-4和IL-10)水平也高于另外两组。因此推断,宫内GBS定植状态下,休眠状态的巨噬细胞M0即可极化为M1型巨噬细胞发挥抗炎作用。当发生宫内感染时,M0极化为M2,抑制过度炎症反应。但与此同时,不利于机体对病原菌的清除作用。除了在初始炎症反应中发挥重要作用外,感染诱导极化后的巨噬细胞可高表达共刺激分子CD80/CD86,进一步作为高效的抗原提呈细胞诱导抗炎特异性T细胞的极化方向[19]。值得一提的是以往观点认为新生儿期细胞免疫应答不健全,因此易合并细菌感染。但近期研究发现,怀孕中期胎儿的T细胞功能已发育较成熟且数目正常,因未经外界抗原诱导分化,90%为表达CD45+的初始 CD4+T细胞[20]。机体接触病原菌后,初始CD4+T细胞通过识别抗原呈递细胞(antigen presenting cells,APCs)MHC-Ⅱ呈递的抗原,从而分化成不同类型的效应CD4+T细胞亚群。与成人相比,新生儿体内抑制Th1极化/促炎反应的模式识别受体(PRR)激动剂较成人明显增高,足月新生儿体内PRR激动剂较早产儿高,而较成人明显增高。可避免在病原体刺激下,Th1极化产生不利于维持机体的内稳态的促炎反应。因此,巨噬细胞的极化方向后续可能催化机体感染GBS后触发不同类型的T细胞免疫应答反应。
综上所述,巨噬细胞参与新生儿GBS早发型败血症的免疫应答过程,巨噬细胞的极化过程与新生儿GBS早发型败血症的发生发展相关。
