解毒祛瘀滋阴方对系统性红斑狼疮小鼠的作用及Wnt/β-catenin信号通路的影响
2020-04-13关彦红张秀霞
关彦红 张秀霞
(冀中能源井陉矿业集团总医院,石家庄 050100)
系统性红斑狼疮是一种临床表现复杂多样且好发于女性的自身免疫性疾病[1,2],可以导致全身多个器官发生严重的并发症,比如皮肤红斑、口腔黏膜炎症、关节炎、心包炎、肾病或肾炎综合征、脾淋巴结肿大、呼吸系统受累等,其中肾脏损伤是系统性红斑狼疮患者死亡的主要原因之一。关于系统性红斑狼疮的病因及发病机制尚不明确,目前的研究认为其与免疫功能异常有关,治疗主要以糖皮质激素等免疫抑制剂为主,临床疗效显著,但是长期与大剂量应用的不良反应较大,造成机体不可逆的损伤。因此,减少糖皮质激素等免疫抑制剂的毒副作用同时提高其疗效是现代临床需要解决的问题。
研究显示,具有滋补作用中药方剂扶正固本可以弥补免疫抑制剂对机体内环境的损害,可安全、高效地用于辅助治疗系统性红斑狼疮[3,4]。解毒祛瘀滋阴方具有健脾益肾滋阴作用,方中熟地、鳖甲和黄芪等中药起滋阴养血益气作用,薏苡仁和茯苓起健脾作用,可弥补系统性红斑狼疮导致的耗气伤津。但是目前有关解毒祛瘀滋阴方治疗系统性红斑狼疮的机制研究较少。Wnt/β-catenin信号通路在免疫调节与自身免疫反应中发挥了重要作用。Tveita 等[5]发现在系统性红斑狼疮肾炎动物肾组织中Wnt信号通路被激活,β-catenin出现高表达,并且其下游信号LEF1因子的mRNA表达水平明显升高,提示Wnt信号通路活化可能参与了系统性红斑狼疮肾炎肾脏形态学的改变。另有研究通过系统性红斑狼疮动物模型发现,随着狼疮肾炎的发展,动物血清与肾组织中β-catenin表达逐渐升高,同时β-catenin靶基因表达也相应增加[6]。临床研究发现系统性红斑狼疮肾炎患者肾脏组织β-catenin及其mRNA水平高表达,而且与系统性红斑狼疮肾炎活动度具有相关性[7]。通过以上研究可以推断wnt/β-catenin 的激活参与了系统性红斑狼疮肾炎的发生及发展。本实验主要观察解毒祛瘀滋阴方对系统性红斑狼疮小鼠的作用及Wnt/β-catenin信号通路的影响。
1 材料与方法
1.1材料
1.1.1实验动物 雌性系统性红斑狼疮MRL/lpr小鼠40只,8周龄,体重(25±2.3)g,购自深圳市拓普生物科技有限公司。雌性C57BL/6小鼠20只,8周龄,体重(26±2.8)g,购自北京维通利华实验动物技术有限公司。实验中对动物的处置符合3R规则。
1.1.2主要试剂 解毒祛瘀滋阴方购自浙江省中医药大学中药饮片厂,主要成分为:熟地18 g、鳖甲12 g、黄芪12 g、薏苡仁15 g、茯苓9 g、赤芍12 g、柴胡9 g、青蒿9 g和甘草6 g等,水煎,浓缩成生药含量1.0 g/ml。CD4-FITC(ANT-132)购自上海江莱生物科技有限公司。CD25-PE抗体(130-101-426)购自上海恒斐生物科技有限公司。小鼠血清肌酐ELISA检测试剂盒(SJH-033740)购自青岛捷世康生物科技有限公司。小鼠血清尿素氮ELISA检测试剂盒(EK-R21223)购自上海酶研生物科技有限公司。小鼠抗双链DNA抗体ELISA检测试剂盒(BJ42946)购自广州边金生物科技有限公司。小鼠抗核抗体ELISA检测试剂盒购自南京森贝伽生物科技有限公司。CD4-FITC、IFNγ-PE及IL-4-APC抗体购自eBioscience公司。Wnt3a抗体(ab81614)、β-catenin抗体(ab22656)购自艾博抗(上海)贸易有限公司。
1.2方法
1.2.1实验分组 将40只系统性红斑狼疮MRL/lpr小鼠随机分为模型组与药物组,药物组灌胃给予25 g/(kg·d)的解毒祛瘀滋阴方,模型组灌胃给予等量的生理盐水,连续给药21 d;将20只C57BL/6小鼠作为正常组,常规饲养。
1.2.2尿素氮、肌酐和抗双链DNA抗体检测 给药21 d后每组各取小鼠10只,5%水合氯醛麻醉(0.1 ml/10 g)后摘眼球取血200 μl,离心、取血清,取一部分血清,利用酶联免疫吸附实验法检测血尿素氮、肌酐、抗双链DNA抗体水平,将剩余血清样品置于-80℃保存备用。实验步骤严格按照试剂盒说明操作进行。
1.2.3外周血炎性因子检测 取剩余血清,进行IL-2、IL-4、IL-10、IFN-γ水平的检测,严格依照ELISA检测试剂盒说明操作进行。
1.2.4肾脏病理观察 采血后取各组小鼠肾脏,经肾门切取1/2,固定于甲醛中24 h,梯度乙醇脱水后浸蜡、石蜡包埋,切片厚度为3 μm,脱蜡后常规苏木精-伊红染色,透明、中性树脂封固,显微镜下观察。
1.2.5调节性T细胞比例检测 给药21 d后每组各取小鼠10只,5%水合氯醛麻醉(0.1 ml/10 g)后尾部取血约50 μl,分别加入抗体CD4-FITC、CD25-PE及同型对照,空白管不加任何抗体,室温孵育30 min;加染色缓冲液2 ml,1 500 r/min离心5 min洗涤2次,弃上清液;加冷固定/穿膜剂4℃避光孵育30 min;加穿膜缓冲液1 200 r/min离心5 min洗涤2次,弃上清液;加入300~400 μl染色缓冲液悬浮混匀;加入Foxp3同型对照抗体或抗体4℃避光孵育30 min;以穿膜剂缓冲液1 200 r/min离心5 min 离心洗涤2次,弃上清液;悬浮于300~400 μl染色缓冲液,上流式细胞仪检测。
1.2.6脾脏辅助性T细胞亚群检测 尾部取血后取各组小鼠脾脏组织,剪碎后以胶原酶消化过滤,利用淋巴细胞分离液制备单个核细胞悬液,分别加入CD4-FITC细胞膜染色、IFN-γ-PE及IL-4-APC细胞质染色避光孵育30 min,利用流式细胞仪检测CD4+细胞中CD4+IFN-γ+细胞(Th1)、CD4+IL-4+细胞(Th2)阳性率,并计算Th1/Th2值。
1.2.7Western blot检测 取各组小鼠肾皮质,加入预冷的蛋白裂解液,采用BCA法进行蛋白质定量检测。首先将蛋白煮沸3~5 min使其变性,然后以每孔40 μg上样,以12%SDS-聚丙烯酰胺凝胶电泳,120 V电泳25 min后再以150 V电泳至Marker在分离胶中完全分开。根据对应的Marker在相应的位置切下目的蛋白凝胶,然后利用转膜仪将目的蛋白转移至PVDF膜上,再以TBST配制的脱脂牛奶封闭2 h,将封闭好的膜在自封袋中分别与稀释的一抗(Wnt3a、β-catenin)混合,4℃孵育过夜。以TBST洗膜3次,每次10 min,再与稀释的二抗混合,37℃孵育2 h,以TBST洗膜3次,每次10 min。ECL显色、曝光。

2 结果
2.1尿素氮、肌酐和抗双链DNA抗体检测 各组小鼠血清尿素氮、肌酐和抗双链DNA抗体检测结果见表1,与正常组比较,模型组尿素氮、肌酐和抗双链DNA抗体水平显著升高,差异存在统计学意义(P<0.05);与模型组比较,药物组尿素氮、肌酐和抗双链DNA抗体水平显著降低,差异存在统计学意义(P<0.05)。
2.2炎性因子检测 与正常组比较,模型组IL-2、IFN-γ、IL-10浓度降低(P<0.05),IL-4浓度升高(P<0.05);与模型组比较,药物组IL-2、IFN-γ、IL-10浓度升高(P<0.05),IL-4浓度降低(P<0.05),见表2。
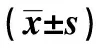


GroupsUreanitrogen(mmol/L)Creatinine(μmol/L)Anti-double-strandedDNA antibodies(U/ml)Normal group5.02±0.4917.39±3.150Model group13.75±1.211)38.23±4.121)148.31±24.181)Drug group8.39±0.482)26.37±3.282)70.19±18.792)
Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05.
2.3肾脏病理观察 苏木精-伊红染色可见,正常组小鼠肾小球结构正常,未见肿胀与萎缩,系膜细胞正常,系膜基质未见增生;模型组小鼠肾小球肿胀明显,可见明显增厚的肾小球毛细血管基底膜及大量增生的系膜细胞,系膜基质增生明显,肾小管水肿明显,炎性细胞浸润于肾间质;相较于模型组,小鼠药物组肾小球毛细血管基底膜增厚程度减少,系膜细胞减少,系膜基质增生程度减少,肾间质炎性细胞浸润减少,见图1。
2.4调节性T细胞比例检测 与正常组比较,模型组CD4+CD25+Foxp3+T细胞阳性率降低,差异存在统计学意义(P<0.05);与模型组比较,药物组CD4+CD25+Foxp3+T细胞阳性率升高,差异存在统计学意义(P<0.05),见图2。
2.5脾脏辅助性T细胞亚群检测 模型组脾脏Th1细胞比例低于正常组(P<0.05),药物组脾脏Th1细胞比例高于模型组(P<0.05);模型组脾脏Th2细胞比例高于正常组(P<0.05),药物组脾脏Th2细胞与模型组比较无差异(P>0.05),见图3;正常组、模型组、药物组Th1/Th2比值分别为0.98±0.22、0.59±0.13、1.02±0.21,模型组Th1/Th2比值低于正常组(P<0.05),药物组Th1/Th2高于模型组(P<0.05)。
2.6Western blot检测 与正常组比较,模型组Wnt-3a、β-catenin蛋白表达显著升高,差异存在统计学意义(P<0.05);与模型组比较,药物组Wnt3a、β-catenin蛋白表达显著降低,差异存在统计学意义(P<0.05),见图4。
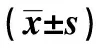

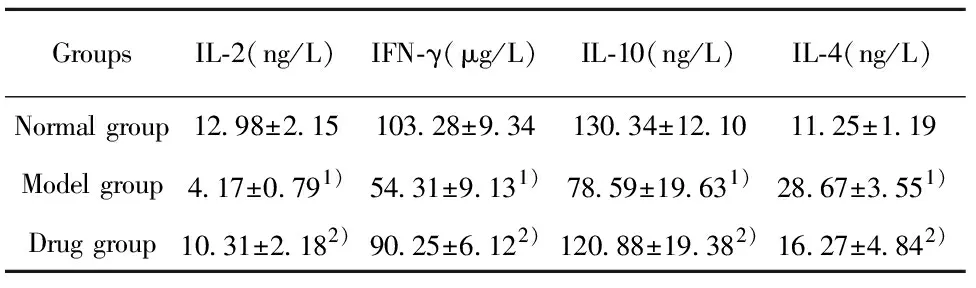
GroupsIL-2(ng/L)IFN-γ(μg/L)IL-10(ng/L)IL-4(ng/L)Normal group12.98±2.15103.28±9.34130.34±12.1011.25±1.19Model group4.17±0.791)54.31±9.131)78.59±19.631)28.67±3.551)Drug group10.31±2.182)90.25±6.122)120.88±19.382)16.27±4.842)
Note:Compared with the normal group,1)P<0.05;compared with the model group,2)P<0.05.

图1 各组小鼠肾脏病理学观察(苏木精-伊红染色) Fig.1 Pathological observation of kidneys of mice in each group(HE staining)Note:A.Normal group;B.Model group;C.Drug group.
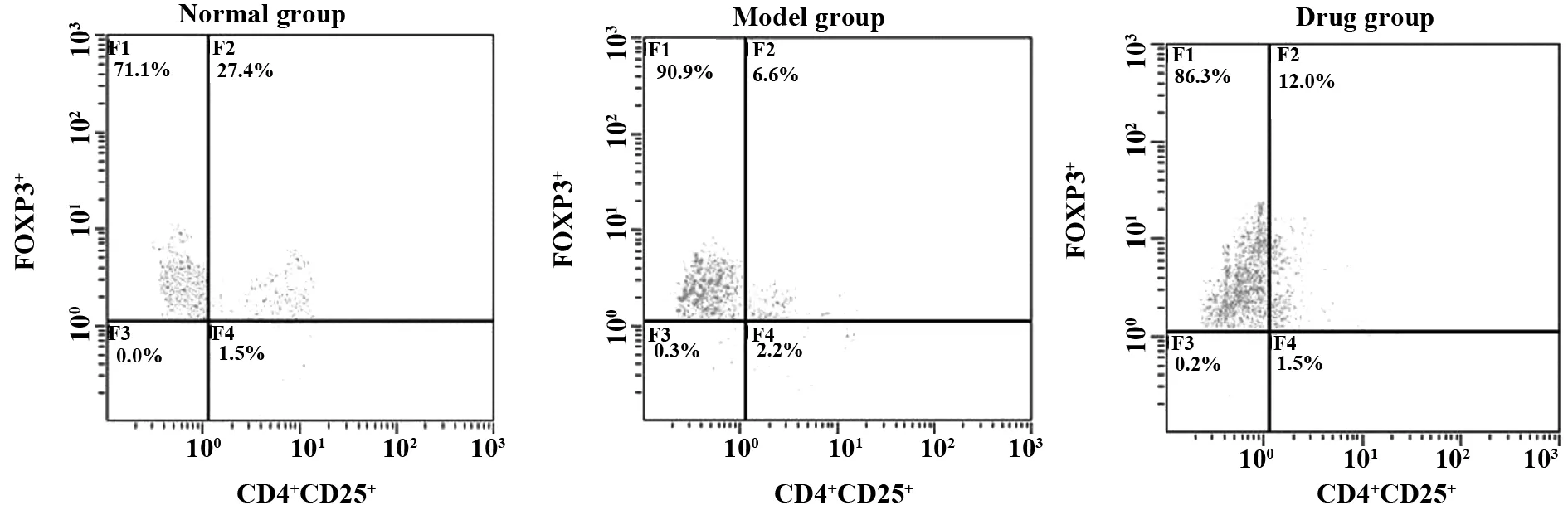
图2 各组小鼠外周血CD4+CD25+Foxp3+T细胞阳性率Fig.2 Positive rate of CD4+CD25+Foxp3+T cells in peripheral blood of mice in each group

图3 各组小鼠脾脏辅助性T细胞亚群检测Fig.3 Detection of helper T lymphocyte subsets in spleen of mice in each groupNote: A.The proportion of Th1 cells in the spleen of mice in each group;B.The proportion of Th2 cells in the spleen of mice in each group.

图4 各组小鼠肾脏组织Wnt3a、β-catenin蛋白表达Fig.4 Expression of Wnt3a and β-catenin in kidney tissue of mice in each groupNote: Compared with the normal group,*.P P
3 讨论
与其他针对某个靶器官损害的自身免疫性疾病不同的是,系统性红斑狼疮是一种可引起全身多发性器官损害的自身免疫性疾病,目前的观点认为其发病与遗传特质及环境因素密切相关。抗双链DNA抗体水平升高是系统性红斑狼疮患者标志性的血清学改变,也是反映患者病情活动性的良好指标[8,9]。几乎所有的系统性红斑狼疮患者均存在血清抗双链DNA抗体水平的升高。过高的自身抗体在循环中可以形成免疫复合物,进而沉积在靶器官中,损伤组织器官,例如免疫复合物沉积在肾脏中会导致肾小球肾炎的发生。同时在系统性红斑狼疮患者肾脏中可见大量炎性细胞浸润,肾小球结构遭到破坏,进而影响肾功能状态,尿素氮、血肌酐及尿蛋白等指标发生异常改变[10]。并且在系统性红斑狼疮发病免疫应答过程中,B淋巴细胞、T淋巴细胞及相关免疫细胞因子发挥了重要作用[11-13],其中T淋巴细胞可分为Th1和Th2效应细胞,Th1细胞负责介导细胞免疫,通过释放IFN-γ等细胞因子来发挥吞噬效应;Th2细胞负责介导体液免疫,通过释放IL-4、IL-6等细胞因子来促进T淋巴细胞免疫增殖,引发机体免疫功能紊乱,发生自身免疫损伤。
解毒祛瘀滋阴方具有清热解毒、活血祛瘀与滋阴益肾等主要功效,在系统性红斑狼疮减少激素用量与减少激素不良反应方面发挥了较好的效果[14,15],但是有关解毒祛瘀滋阴方治疗系统性红斑狼疮的作用机制研究不多见。作为经典自发系统性红斑狼疮动物模型的MRL/lpr小鼠,其疾病发展与人系统性红斑狼疮的临床与病理表现相似,所以本实验以MRL/lpr小鼠为系统性红斑狼疮模型,主要观察解毒祛瘀滋阴方的治疗作用及对Wnt/β-catenin信号通路的影响。
本实验结果显示,系统性红斑狼疮小鼠尿素氮、肌酐和抗双链DNA抗体水平及IL-4浓度升高,IL-2、IFN-γ、IL-10浓度降低,CD4+CD25+Foxp3+T细胞阳性率降低,Th1细胞比例及Th1/Th2降低,同时出现了严重的肾脏病理损伤,而经过解毒祛瘀滋阴方治疗后,系统性红斑狼疮小鼠尿素氮、肌酐和抗双链DNA抗体水平及IL-4浓度显著降低,IL-2、IFN-γ、IL-10浓度升高,CD4+CD25+Foxp3+T细胞阳性率升高,Th1细胞比例及Th1/Th2升高,同时肾脏病理损伤明显减轻,提示解毒祛瘀滋阴方可改善系统性红斑狼疮小鼠的免疫功能与肾损害,与以往研究结果一致[16]。
研究已证实Wnt/β-catenin信号通路参与了急性肾损伤的修复[17],同时亦有研究证实Wnt/β-catenin信号通路在系统性红斑狼疮肾炎中存在异常表达[18]。本实验检测发现,系统性红斑狼疮小鼠肾组织Wnt3a、β-catenin蛋白表达显著升高,由此推测Wnt/β-catenin信号通路可能参与了系统性红斑狼疮肾炎的发生与发展。而经过解毒祛瘀滋阴方治疗后,系统性红斑狼疮小鼠肾组织Wnt3a、β-catenin蛋白表达出现了明显的降低,提示解毒祛瘀滋阴方可能通过调节Wnt3a、β-catenin蛋白表达来减轻系统性红斑狼疮的肾损伤。但是本实验仅检测了Wnt3a、β-catenin蛋白表达情况,未进行相关的基因检测,因此实验结果还有待进一步的证实。本实验提示解毒祛瘀滋阴方可改善系统性红斑狼疮小鼠的免疫功能与肾损害,其机制可能与调节Wnt/β-catenin信号通路有关。
