CD14、MD-2在LPS致乳腺上皮细胞炎症中的作用①
2020-04-13王万林谢雪艳李天珍
王万林 高 月 谢雪艳 李天珍 易 琼 王 鲁
(贵州大学药学院,贵阳 550025)
乳腺上皮细胞(mammary epithelial cells,MECs)主要作用是生乳,与免疫细胞不同。当LPS侵入时,其却能做出免疫反应,分泌细胞炎性因子[1]。Toll样受体(Toll like receptor,TLR)信号通路已在先天免疫细胞如巨噬细胞和树突细胞中得到充分体现[2],白细胞分化抗原14(cluster of differentiation 14,CD14)、髓样分化蛋白2(myeloid differential protein-2,MD-2)在免疫细胞的胞外LPS-TLR4炎症信号传导过程中发挥着巨大作用,LPS激活TLR4胞外信号通路,需要与LPS结合蛋白结合后传递给细胞膜上的CD14,再与MD-2相互作用将跨膜信号转入细胞,激活免疫效应细胞进而诱发炎症反应[3],但是该过程在乳腺上皮细胞中未见报道。我们前期研究证明 MECs中有TLR4表达[4],LPS促进MECs胞内的TLR4、MyD88、IRAK-1、TRAF6、TAK-1、NIK mRNA的表达[5],抑制IκB mRNA的表达[6],最终促进细胞分泌TNF-α和IL-8,说明MECs的TLR4胞内信号通路与免疫细胞是一致的。但是MECs胞外是否也存在CD14和MD-2蛋白,且是否发挥着免疫细胞相似的作用未见报道,因此本实验体外培养小鼠MECs,分析该基因在小鼠MECs胞外LPS至TLR4信号途径中的作用。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级昆明小白鼠购自解放军第三军医大学实验动物中心[动物许可证号:SCXK(渝)-2012-0011]。在贵州大学贵州省生化工程中心SPF级动物实验室[动物许可证号:SYXK(黔) 2013-0001]饲养至妊娠中后期。
1.1.2主要药物及试剂 胎牛血清(FCS)、DMEM/F12培养基、Ⅰ型胶原酶和Ⅱ型胶原酶购自Thermo scientific公司;rhEGF、霍乱毒素、胰岛素、脂多糖(LPS)、异硫氰酸荧光标记FITC-LPS购自Sigma公司;L-谷氨酰胺购自SAB公司;MTT购自Solarbio公司;TIAN Script RT kit、RNA pure Tissue kit、2×Taq PCR Master Mix购自北京康为世纪生物科技有限公司;Power SYBR Green PCR Master Mix购自AB公司;mouse TNF-α ELISA kit、mouse IL-1β ELISA kit、mouse IL-6 ELISA kit购自武汉基因美生物公司;Anti-CD14、anti-MD-2、抗anti-Rat IgG-Alexa 594、抗anti-Rabbit IgG-Alexa 488购自Abcam公司。
1.1.3主要实验仪器 Thermo Nano Drop ND-2000微量紫外分光光度计、Multiskan Go型全波段酶标仪、Thermo Fisher 3111储水型CO2细胞培养箱,Thermo公司;倒置相差显微镜购自日本Olympus公司;Biosciences FACSCalibur流式细胞仪购自美国贝克曼;实时荧光定量RT-PCR仪购自德国jena公司;GelDoc XR+凝胶成像系统、梯度PCR仪购自Bio-Rad公司。
1.2方法
1.2.1MTT法检测LPS对MECs增殖的影响 参照文献[1]的方法,制备小鼠MECs,细胞浓度1×106个/ml 接种96孔板,随机分成空白对照组和LPS 终浓度1 μg/ml、5 μg/ml、10 μg/ml、20 μg/ml、30 μg/ml、40 μg/ml、50 μg/ml刺激组(n=3),对照组加入等体积培养基。在加入LPS刺激后的1 h、3 h、6 h、12 h、24 h、48 h时,按照MTT法操作,计算490 nm下各孔的OD值。
1.2.2流式细胞术筛选LPS与MECs的最佳结合条件 应用流式细胞仪检测异硫氰酸荧光素(FITC)标记的LPS (FITC-LPS)与细胞结合能力。按照1.2.1方法制备细胞,胰酶消化后,调整细胞浓度到1×106个/ml密度铺板,分成空白对照组、LPS组。空白对照组只加500 μl细胞培养液,LPS组加入含带有异硫氰酸荧光素标记LPS的培养基500 μl,荧光素标记LPS终浓度分别为:1 μg/ml、5 μg/ml、10 μg/ml、15 μg/ml、20 μg/ml(n=3),在荧光素标记LPS刺激后3 h、6 h、12 h、24 h,分别加入胰蛋白酶消化,终止消化收集各组细胞4℃离心1 000 r/min,加入少量D-Hanks液吹打混匀,参照文献[7]方法上机检测,异硫氰酸酯(FITC)是常用的荧光标记物,作为一种阳离子荧光染料,其标记原理主要是与生物大分子上的NH2基团结合,LPS的磷酸基团可携带大量的负电荷,使LPS可与阳离子发生强烈的相互作用,在波长为530 nm下,FITC-LPS所发出的绿色荧光表示细胞内的LPS,检测细胞平均荧光量,就代表细胞结合FITC-LPS的多少。计算细胞结合率,筛选出最佳结合条件。细胞结合率=结合荧光LPS的细胞数/总的检测细胞数×100%。
1.2.3PCR检测CD14、MD-2 mRNA的表达 根据NCBI数据库中小鼠CD14(NM_009841)、MD-2(NM_016923)mRNA序列,分别设计CD14和MD-2引物,见表1。按1.2.1方法制备小鼠MECs,提取各组细胞RNA,用TIAN Script cDNA第一链合成试剂盒将提取的RNA逆转录,并于-20℃保存备用,梯度PCR测mRNA的表达并筛选最佳退火温度。PCR反应程序:95℃ 3 min;95℃ 30 s,55~65℃ 30 s,72℃ 30 s,共35个循环;72℃ 2 min。
1.2.4流式细胞术检测MECs上CD14、MD-2蛋白的表达 参照1.2.1制备小鼠MECs,分成空白对照组、CD14和MD-2组。CD14组、MD-2组每孔分别先加入60 μl Anti-CD14(1∶100倍稀释)或60 μl Anti-MD-2(1∶100)4℃孵育30 min,抽净一抗后用PBS洗涤。常温下10%羊血清封闭液孵育10 min,抽净羊血清后用PBS洗涤,分别加入100 μl anti-Rat IgG-Alexa 594(1∶200)、anti-Rabbit IgG-Alexa 488于室温下避光孵育1 h,PBS 洗涤。对照组不加抗体,其余操作相同。操作完成后,胰蛋白酶消化离心,加入培养基混匀,流式细胞仪检测蛋白表达。
表1 引物的核苷酸序列
Tab.1 Sequences of primers for qPCR

GenePrimer sequence(5′→3′) Length(bp)CD14Forward:AGCACACTCGCTCAACTTTTC88Reverse:GCCCAATTCAGGATTGTCAGACMD-2Forward:GAATCTGAGAAGCAACAGTGGT144 Reverse:CTCAACATGCACAAATCCATTGGGAPDHForward:GCAACTCCCACTCTTCCA158 Reverse:GTCCAGGGTTTCTTACTCC
1.2.5qPCR检测筛选siRNA最佳转染条件 根据NCBI数据库中小鼠CD14(NM_009841)、MD-2(NM_016923)mRNA序列,分别设计CD14和MD-2的qPCR引物(表1)和siRNA引物片段(表2)。制备小鼠MECs,分成空白组、20 nmol/L、30 nmol/L、50 nmol/L 终浓度组(n=3)。于转染前24 h,换为无双抗细胞培养液培养,按照赛默飞公司Lipo-2000转染试剂说明进行转染实验。提取各组RNA进行qPCR反应。PCR反应程序:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,自变性开始三步为一个循环,共设40个循环;72℃ 2 min。使用2-ΔΔCt法计算各组mRNA相对表达量,根据转染抑制率筛选基因最佳转染浓度。其中:转染抑制率=1-2-ΔΔCt。ΔΔCt=(Ct目的基因-Ct内参)转染后-(Ct目的基因-Ct内参)转染前。
1.2.6流式细胞术检测CD14、MD-2基因沉默后对LPS与细胞结合的影响 制备小鼠MECs,分为对照组、LPS刺激组、CD14转染组、MD-2转染组和CD14+MD-2同时转染组,参照1.2.5中方法最佳条件转染24 h后,抽去孔中培养基,除对照组外各组分别加入带荧光LPS终浓度为5 μg/ml的生长培养液继续培养12 h。流式细胞仪检测各组中结合荧光LPS的细胞数,计算细胞结合率。
1.2.7ELISA法检测MECs上CD14、MD-2基因沉默后对LPS致细胞分泌炎性因子TNF-α、IL-6及IL-1β的影响 参照1.2.5中最佳沉默条件对小鼠MECs采用相同沉默处理,收集细胞培养板各组孔中细胞培养液,按照ELISA试剂盒说明书的检测方法,分别测定各组中细胞分泌的TNF-α、IL-6及IL-1β的含量。

2 结果
2.1LPS对MECs增殖的影响 在同一作用时间下(24 h),随着LPS浓度增加(>10 μg/ml),细胞OD490 nm值低于空白组,当浓度达到50 μg/ml时其与空白组之间呈现极显著的差异(P<0.01)。如图1A所示:LPS作用于小鼠MECs(24 h)IC50为76.83 μg/ml。如图1B所示:10 μg/ml LPS作用于细胞,6 h之后,各个时间点空白组以及LPS组的OD490 nm值与1 h相比差异极显著性上升(P<0.01),在24 h之后细胞增殖缓慢。
2.2LPS与细胞最佳结合的条件 结果如图2所示,MECs与LPS的结合率与浓度呈明显的对数关系,在LPS浓度≤5 μg/ml之前,细胞与LPS的结合以稳定的几何级数极快增长,之后细胞与LPS的结合增长缓慢,呈现饱和状态。图2C、D所示,小鼠MECs与LPS的结合率同LPS的刺激时间呈明显的对数关系,当LPS刺激细胞≤6 h时,细胞与LPS的结合以稳定的几何级数极快增长,当>12 h之后,细胞与LPS的结合缓慢呈现稳定的平台期。
2.3乳腺上皮细胞中CD14、MD-2 mRNA表达的结果 图3分别是CD14、MD-2两对引物PCR产物的琼脂糖凝胶电泳图,根据设计引物片段的大小分别在88 bp、144 bp处有明亮的条带,说明细胞中有这2个基因的表达,它们的最佳退火温度均为59.7℃。
2.4小鼠MECs上CD14、MD-2蛋白表达的结果 图4结果所示,空白组没有目的蛋白表达,CD14孵育组有微量CD14的蛋白表达,MD-2孵育组有一定量的MD-2蛋白表达。
2.5CD4、MD-2基因转染最佳的条件 CD14-mus-905片段在50 nmol/L浓度下的转染率最高(图5A),MD-2-mus-234片段在30 nmol/L浓度下转染率最高(图5B)。与空白组相比,三个转染浓度下CD14、MD-2的mRNA表达均被极显著抑制(P<0.01)。
表2 CD14及MD-2的siRNA序列
Tab.2 siRNA nucleotide sequences data of CD14 and MD-2

siRNAsiRNA sequences(5′→3′)CD14-mus-905Forward:CCUUAGACCUGUCUGACAATTReverse:UUGUCAGACAGGUCUAAGGTTMD-2-mus-234Forward:CAUGUUGAGUUCAUUCCAATTReverse:UUGGAAUGAACUCAACAUGTT
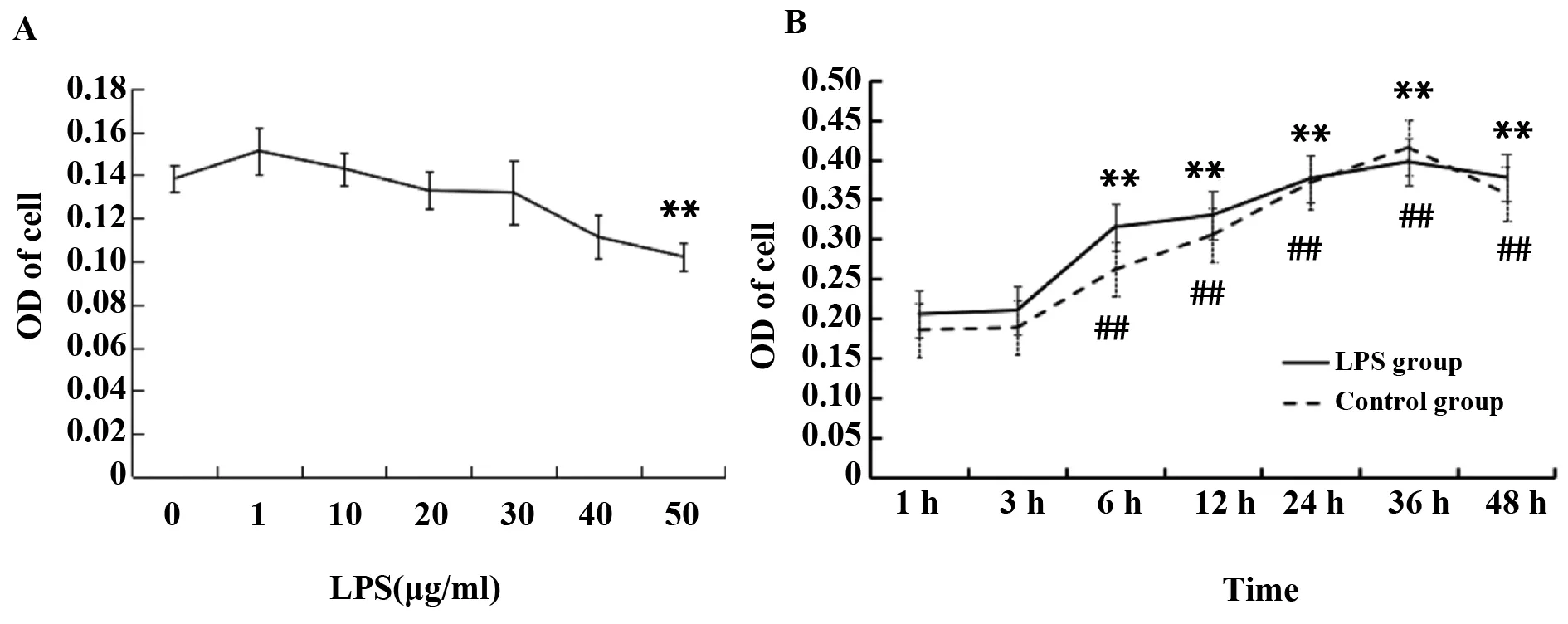
图1 不同浓度及不同时间LPS对小鼠MECs增殖影响Fig.1 Effects of proliferation of mouse MECs at different concentrations and times of LPSNote: A.Compared with control,**.P PP
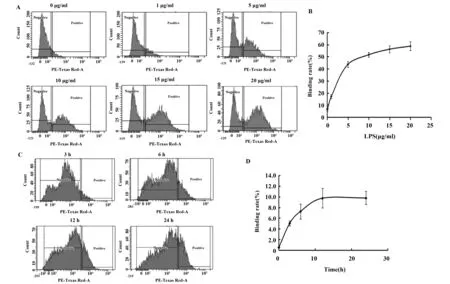
图2 不同浓度及不同作用时间的荧光LPS流式相关强度Fig.2 Relation fluorescence intensity of fluorescence LPS at different concentrations and time
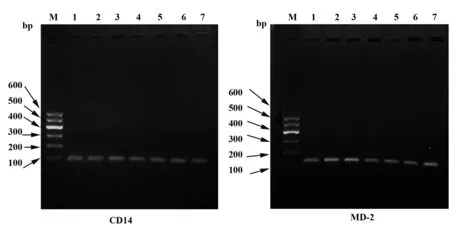
图3 PCR反应产物琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis images of PCR reaction productNote: The TM of Lane 1-Lane 7 correspons to 62℃,60.8℃,59.7℃,58.3℃,57.2℃,56.1℃ and 55℃ respectively.
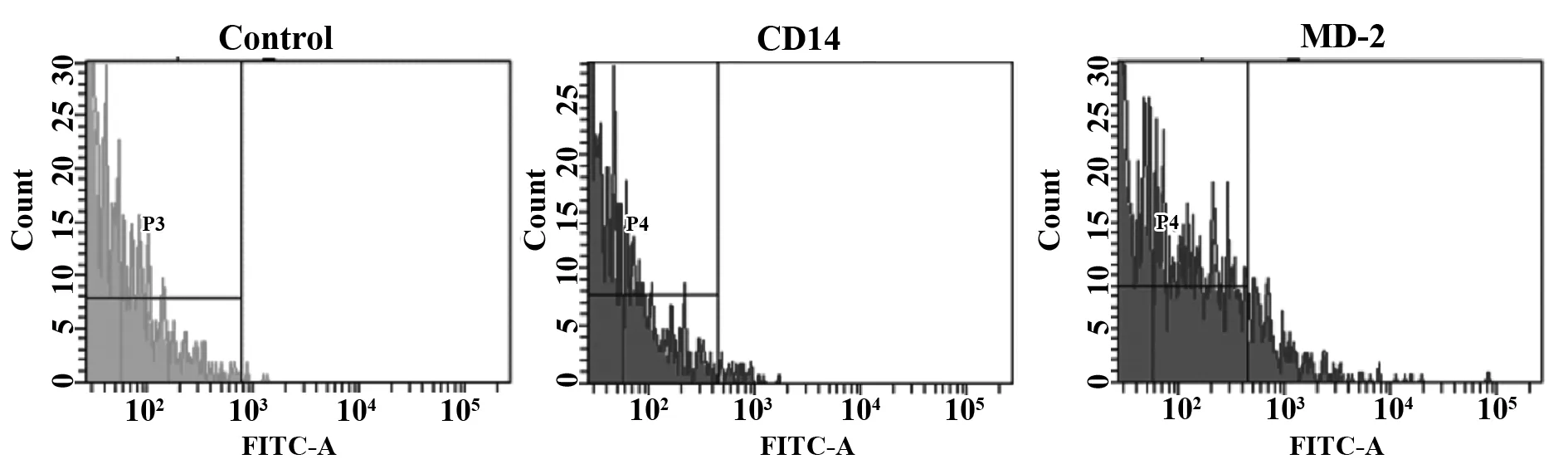
图4 CD14、MD-2蛋白表达流式相关强度Fig.4 Relation fluorescence intensity of protein expression of CD14 and MD-2

图5 siRNA片段各转染组对小鼠MECs中目的基因mRNA表达的抑制率Fig.5 Inhibitory effect of siRNA fragments on expression of target gene mRNA in mouse MECsNote:Compared with control,**.P
2.6CD14、MD-2基因沉默后LPS与细胞结合的结果 空白组、LPS组、MD-2转染组、CD14转染组、CD14+MD-2转染组荧光LPS与小鼠MECs的流式相关强度图(图6A)。同空白组相比,LPS组、各转染组细胞的结合率都极显著升高(P<0.01);同LPS组相比,MD-2转染组、CD14转染组、CD14+MD-2转染组的细胞结合率都极显著下降(P<0.01),且分别下降了3.00%、7.88%、13.41%(图6B)。
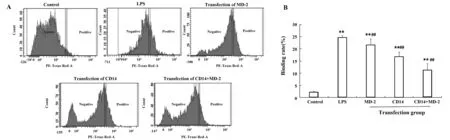
图6 基因沉默后荧光 LPS 与细胞流式相关强度、细胞结合率Fig.6 Relation fluorescence intensity and rate of binding with LPS after gene silencingNote: Compared with control,**.P P

图7 基因沉默后LPS致细胞分泌炎性因子TNF-α、IL-6及IL-1β量Fig.7 Content of TNF-α,IL-6,IL-1β in each group with LPS after gene silencingNote: Compared with control,*.P PP P
2.7基因沉默后对LPS致细胞分泌炎性因子TNF-α、IL-6及IL-1β的结果 ELISA检测显示,同空白组相比,LPS组细胞分泌TNF-α(图7A)、IL-6(图7B)、IL-1β(图7C)的量呈极显著升高(P<0.01);同LPS组相比,MD-2转染组、CD14转染组、CD14+MD-2转染组分泌炎性因子量呈极显著下降(P<0.01)。
3 讨论
病原微生物侵入MECs时,MECs释放趋化因子使中性粒细胞(PMN)局部募集,同时先天免疫系统通过病原体相关分子模式(PAMP)与膜上的识别受体TLR4相互作用[8],进而分泌各种细胞炎性因子,发挥天然免疫保护作用。其中,Toll样受体(Toll-like receptors,TLRs)已经得到了广泛的研究,CD14和MD-2在LPS-TLR4炎性信号通路中的作用已经明确,但是在MECs中未见验证。CD14为脂多糖的受体,分为膜结合mCD14和分泌型sCD14,前者主要通过糖基磷脂酰肌醇尾部连接到骨髓细胞表面,分布于成熟单核细胞、巨噬细胞表面,后者主要分布于非髓样细胞、内皮细胞、上皮细胞表面,帮助LPS信号在缺乏膜结合mCD14的细胞中传递。MD-2是一种具有脂多糖结合口袋的分泌型糖蛋白,可以提高 TLR4对LPS的敏感性,增加TLR4受体的稳定性[9]。MD-2在结构上存在两个相对独立的功能结构域,其在LPS激活TLR4中作为细胞外衔接蛋白[10],结合LPS和TLR4配体,从而激活NF-κB通路。而最新研究表明可溶性TLR4(sTLR4) 可与MD-2形成复合体,竞争性抑制细胞膜上TLR4与其配体结合[11],作为TLR4的一种负调节机制。LBP和CD14之间的相互作用是LPS介导的TLR4/MD-2信号传递所必需的,LBP-N缺乏LPS转移结构域或mCD14表达减少,会导致LPS结合减弱[12]。
LPS刺激细胞后,LPS结合蛋白LBP通过N端碱性贴片与LPS胶束结合,在C末端[13]与分泌型sCD14及膜结合型mCD14形成CD14/LBP/LPS三元复合物,之后CD14与LBP发生解离,从而使LPS能够转移到由TLR-4组成的LPS受体复合物LPS/TLR4/MD-2中,最终启动一系列激酶调节的磷酸化反应。
小鼠的敲除研究表明,MD-2是TLR4信号传导中必不可少的辅助分子,缺乏MD-2基因的小鼠对LPS没有反应[14]。Yang等[15]发现在TLR4阳性细胞中表达的MD-2可以使LPS/CD14诱导的NF-κB的活化提升,共表达TLR4/MD-2能活化MAPK通路、增强Elk-1的刺激信号,说明TLR4-MD-2复合体可以增强LPS介导的NF-κB通路和MAPK通路。Viriyakosol等[16]发现MD-2与LPS结合,无需LBP和CD14的辅助,同时MD-2能增强转染了TLR4的仓鼠卵巢细胞LPS的生物活性,说明MD-2是真正的LPS结合蛋白。本研究发现CD14、MD-2基因的沉默,影响了LPS与细胞的结合,同时LPS致细胞分泌TNF-α、IL-6或IL-1β的量都显著或极显著下降。说明CD14、MD-2在胞外LPS至TLR4段的信号途径中起重要作用,这也与文献报道是一致。
前期研究发现MECs在LPS刺激下[5],其胞内信号的传递途径与文献[7]报道的免疫细胞的信号途径是一致,这增加了我们对“MECs胞外LPS-TLR4信号途径与免疫细胞是否一致”这个问题的探讨。我们首先重新摸索了LPS刺激小鼠MECs最佳条件,结果显示LPS刺激细胞的浓度在5~50 μg/ml 之间时对细胞的生长不会产生毒害作用。其浓度在5~10 μg/ml之间,刺激时间在6~12 h之间时,细胞与LPS的结合可以达到饱和;其次我们确认MECs上有CD14、MD-2基因和蛋白的存在;最后我们发现MECs上的CD14、MD-2基因沉默能造成LPS-TLR4信号传递受阻,说明CD14、MD-2在MECs胞外LPS至TLR4段的信号途径中起重要作用,这一结果将为胞外LPS-TLR4信号途径的研究增加了MECs的研究数据。至于MECs上的CD14、MD-2与LPS/TLR4的关系如何,是否与免疫细胞完全一致,MECs中的CD14是m型还是s型等等问题,都有待进一步深入研究。
