C1q/C3比值与冠心病关系的研究
2020-04-11
(青岛大学附属医院心内科,山东 青岛 266003)
冠心病(CHD)是一种严重威胁人类健康的疾病,世界范围内发病率与死亡率较高[1]。大多数情况下,CHD是由动脉粥样硬化引起的,尽管动脉粥样硬化的发病机制还未明确,但基本被认为是一种胆固醇所致的慢性炎症反应[2]。目前越来越多的证据表明动脉粥样硬化有明显的免疫性疾病特征,补体系统作为免疫系统的重要组成部分,多种补体成分通过介导免疫和炎症反应可能参与了动脉粥样硬化的过程[3-6]。早期研究发现补体系统是加重炎症、促进斑块进展的危险因素,但另有研究发现其在动脉粥样硬化进展中也起到保护作用[7]。既往关于补体循环水平的研究多孤立地考量单个指标,而补体系统作为一个复杂的网络,补体组分间的相对水平较单一指标可能对CHD有更高的预测价值,目前C1q/C3比值与CHD关系的研究暂无报道,因此本研究旨在探讨C1q/C3比值与CHD患者发病的关系。现将结果报告如下。
1 对象与方法
1.1 对象与分组
本研究纳入2018年12月1日—2019年3月31日在我院心内科住院并拟行冠状动脉造影术的患者总共101例,其中男71例,女30例,平均年龄(62.84±10.04)岁。排除标准:①既往行经皮冠状动脉球囊扩张术、冠状动脉支架植入术或冠状动脉旁路移植术者;②患有先天性心脏病或心肌病者;③患有其他慢性疾病者,如慢性阻塞性肺疾病、肿瘤、肝肾功能不全等;④凝血功能严重异常者;⑤患有自身免疫性疾病者,如风湿性心脏病、系统性红斑狼疮(SLE)、类风湿关节炎等;⑥近期有感染或外伤史者;⑦近期糖皮质激素、免疫抑制剂应用者等。其中因胸痛、胸闷及憋气等症状住院但经冠状动脉造影及其他检查排除CHD的34例患者为对照组(A组),经冠脉造影诊断为CHD的67例患者为CHD组;CHD组又依据Gensini评分分为2个亚组,Gensini评分≤45分的36例为冠状动脉轻度狭窄组(B组),男25例,女11例;Gensini评分>45分的31例为冠状动脉重度狭窄组(C组),男25例,女6例。A组中男21例,女13例,年龄(60.38±8.34)岁,吸烟比例26.5%,体质量指数(BMI)(25.79±3.68)kg/m2;CHD组中男50例,女17例,年龄(64.09±10.65)岁,吸烟比例35.8%,BMI(25.70±2.83)kg/m2。两组性别、年龄、吸烟比例、BMI比较均无显著差异性(P>0.05)。
1.2 研究方法
对纳入研究的患者入院当天详细采集病史,记录患者年龄、性别、BMI、糖尿病史、高血压史、吸烟史等,所有患者清晨空腹状态下采集静脉血,采用日立7600型全自动生化分析仪(日立,日本)检测血清中C1q、C3、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、总胆固醇(TC)、尿酸、肌酐、血糖水平,并计算C1q/C3比值。
1.3 统计学处理

2 结 果
2.1 CHD组与A组患者临床相关指标比较
CHD组与A组血清中TC、TG、LDL-C、C3、尿酸水平比较,差异均无显著意义(P>0.05)。与A组比较,CHD组患者高血压、糖尿病的比例较高,血清中肌酐、空腹血糖水平升高而HDL-C、C1q水平以及C1q/C3比值降低,差异均具有显著意义(χ2=4.224、5.002,Z=-2.693、-3.611,t=2.365~3.971,P<0.05)。见表1。
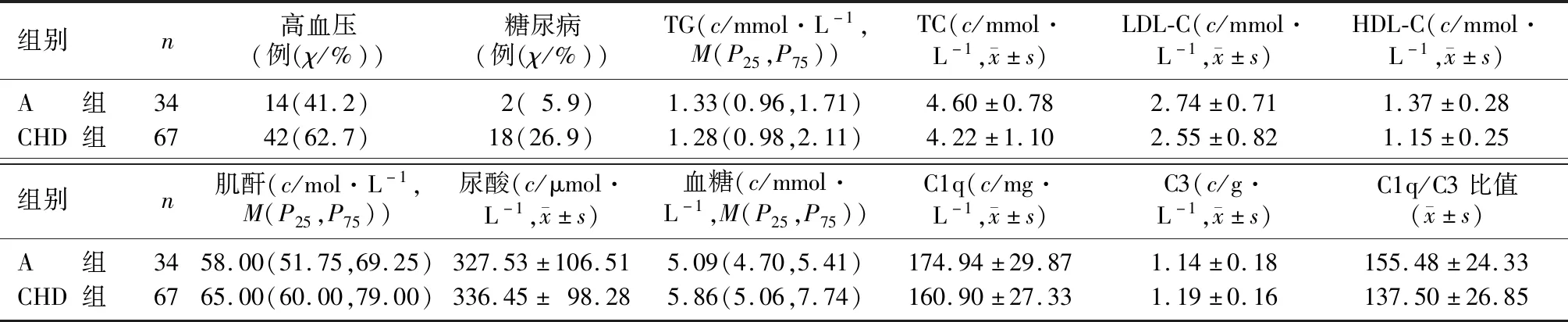
表1 A组与CHD组一般资料的比较
2.2 CHD亚组与A组患者血清中C1q、C3水平及C1q/C3比值比较
C组C1q水平、C1q/C3比值明显低于A组,差异具有显著性(F=3.931、8.053,P<0.01),同时C组C1q/C3比值与B组相比较,差异亦具有显著意义(P<0.05)。见表2。
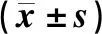
表2 各组间C1q、C3水平及C1q/C3比值比较
2.3 C1q水平、C1q/C3比值等与CHD发病关系的多因素Logistic回归分析
为排除年龄、吸烟等其他因素影响,将所研究对象以是否为CHD作为因变量(CHD患者赋值为1,非CHD患者赋值为0),对C1q、C1q/C3比值依次进行多因素Logistic回归分析。将表1中两组间有差异的因素(P<0.1)以及既往证实的CHD危险因素年龄、性别、高血压、糖尿病、吸烟、血清中胆固醇、肌酐、血糖、HDL纳入二分类Logistic回归分析,以P<0.05为有显著性,根据二项Logistic回归分析结果显示C1q/C3比值和HDL-C是CHD的保护因素(95%CI=0.947~0.994、0.009~0.892,P<0.05),而空腹血糖的水平则是CHD的危险因素(95%CI=1.046~3.946,P<0.05)。见表3。
3 讨 论
补体系统不仅广泛参与机体对病原微生物的防御反应以及免疫调节,而且在动脉粥样硬化的进程中有重要的作用。C1q作为补体经典途径中的模式识别受体,通过识别斑块中酶修饰的低密度脂蛋白(E-LDL)等补体激活物,激活补体经典途径[8-10],活化的C3转化酶裂解血清中补体C3,通过级联放大反应产生大量的裂解产物(例如C3a、C5a以及C5b-9等)及炎症因子,最终促进了斑块炎症进展、斑块破裂及血栓形成[11-12]。

表3 C1q水平、C1q/C3比值等与CHD发病关系的多因素Logistic回归分析
BHATIA等[13]研究发现缺失C1q基因的小鼠相比正常小鼠粥样斑块更大、更不稳定,提示C1q还可能存在抑制动脉粥样硬化的保护机制。近年的研究发现,这种抑制动脉粥样硬化进展的保护机制主要是通过抑制细胞凋亡与促进有效吞噬而实现,而且独立于经典途径的补体激活[7]。C1q可以直接地抑制JAK-STAT信号通路的激活,下调CASP8、BCL2L11、TNFSF10等凋亡基因的表达[14-16],C1q还可作为桥梁分子促进吞噬细胞对凋亡细胞的有效吞噬[17]。同时C1q可趋化巨噬细胞向抗炎型转变,释放IL-10、IL-13等抑炎因子,并抑制IL-1β等炎性因子的表达[18-20]。
研究发现CHD、心肌梗死患者血清中C3水平明显升高,血清中C3a、C5a水平能够预测冠状动脉支架植入术后动脉内膜再狭窄风险,血清中C1q水平也与糖尿病患者未来10年心血管事件死亡风险密切相关[21-27]。HONG等[28]报道了CHD患者血清中C1q水平明显下降,与本研究结果一致,但目前CHD患者血清中C1q水平下降的原因暂不明确。值得思考的是CHD与SLE在补体激活的机制中有相似之处,许多SLE患者因为补体激活导致了血清中C1q降低,而C1q缺乏也最终导致SLE的进展[29-30],因此C1q与补体激活物(ELDL、凋亡小体、C反应蛋白等)结合消耗可能是CHD患者血清中C1q水平降低的重要原因[8,10]。同时C1q作为结合蛋白、桥梁分子等而被消耗[14,17],为冠心病患者血清中C1q水平降低提供了更多的理论依据。
补体激活与细胞凋亡对于机体内环境的动态平衡发挥着极为重要的作用。但动脉粥样硬化所导致的补体激活打破了这种平衡,导致血清中C1q水平下降,C3水平上升,以致堆积的凋亡细胞进一步加剧了补体激活[10],如此往复,最终导致动脉粥样硬化不可逆的进展,以上研究提示补体组分相对水平的变化(如C1q/C3比值)趋向可能决定了动脉粥样硬化的方向。
本研究中CHD组与A组间血清中C1q、C3变化虽有差异,但多因素回归分析显示C1q/C3比值在CHD组与A组间显示出更好的差异性,C1q/C3比值成为反映动脉粥样硬化严重程度的更好指标,也从侧面表明了C1q/C3比值降低的水平反映了补体激活的严重程度。目前关于血清中补体与CHD严重程度的研究比较少,本研究是国内外首次报道C1q/C3比值与CHD的关系。然而,本研究也存在一定的局限性与不足,如本研究通过冠状动脉造影结果计算Gensini评分以评估冠状动脉狭窄程度可能不如联合血管内超声、冠状动脉CT造影更准确;同时所收集病例仅来自于单中心,样本量相对较少,还需要在以后的研究中不断完善。
综上所述,补体系统在动脉粥样硬化的进程中有重要的生理作用,血清中补体C1q/C3比值有望成为协助诊断CHD以及反映动脉粥样硬化的严重程度的指标。C1q、C3之间的动态平衡可能在动脉粥样硬化的过程中起关键作用,但具体机制还有待进一步的研究。
