腹膜后去分化脂肪肉瘤44例临床病理学分析
2020-04-11
(青岛大学附属医院病理科,山东 青岛 266003)
在WHO(2013)骨和软组织肿瘤分类中,脂肪肉瘤被分为非典型脂肪瘤样肿瘤/高分化脂肪肉瘤(ALT/WDLPS)、去分化脂肪肉瘤(DDLPS)、黏液样脂肪肉瘤(MLPS)和多形性脂肪肉瘤(PLPS)等四种主要类型。其中ALT/WDLPS又被分为脂肪瘤样型、硬化性、炎症型和梭形细胞型等4个亚型。DDLPS约占脂肪肉瘤的18%,多发生于腹膜后,组织学上表现为WDLPS向非脂肪源性肉瘤成分转化,偶尔转化为同源性的PLPS样。去分化成分具有更为多样性和异质性的形态学特点,容易引起误诊和漏诊。本文通过分析总结44例腹膜后DDLPS的临床病理学特征、免疫表型和细胞遗传学检测结果,旨在加深对腹膜后DDLPS的认识,以提高病理学诊断的准确性,为该病患者的临床诊断及预后评估提供依据。
1 材料与方法
查阅我院2009年1月—2019年11月确诊为腹膜后DDLPS的44例患者的临床病理资料(包括年龄、性别、肿瘤大小、是否侵及周围组织器官、是否复发及死亡以及病理学描述)并对其总结,同时对肿瘤重新进行组织形态学观察,并进行免疫组织化学染色及FISH检测。①免疫组织化学检测:使用罗氏VENTANA全自动免疫组织化学染色机进行检测,按照说明书进行操作。所使用抗体包括S100、CD117、DOG-1、CD34、CD99、SMA、P16、MDM2、CDK4、STAT6、MUC4、MyoD1、Myogenin、β-catenin及ALK等。不同病例因组织学鉴别诊断需要,选用不同的抗体组合。所用抗体MDM2为福州迈新生物技术有限公司产品,CDK4为厦门通灵生物医药科技有限公司产品,S100为丹麦DAKO公司产品,其余抗体则购自瑞士ROCHE公司。②FISH检测:采用MDM2特异性双色探针检测MDM2基因扩增情况。MDM2/CEP12 FISH探针试剂盒购自美国雅培公司(Vysis),具体操作步骤按照试剂盒说明书进行。免疫组织化学指标结果判读:MDM2、CDK4、STAT6、MyoD1、Myogenin和β-catenin等的阳性表达呈黄/棕色,阳性颗粒定位于细胞核内;S100、CD117、DOG-1、CD34、CD99、MUC4、SMA、P16以及ALK等定位于细胞质(膜)或者质(核)。阳性细胞数百分比<10%为-,10%~25%为+,26%~50%为,>50%为。将阳性细胞数百分比≥10%判定为阳性表达。FISH检测结果判读:计数MDM2与CEP12的信号平均数,当MDM2/CEP12的比值>2.0时判定为MDM2基因有扩增,当比值<2.0时则判读为无扩增;当比值<2.0时且两个探针的荧光信号都多于2个时,则判读为多倍体。患者随访信息通过住院预留电话咨询获取,随访起始日期为患者手术当日,终止日期为患者死亡或最后一次联系的日期。采用GraphPad Peism5软件对数据进行统计分析,Kaplan-Meier法绘制生存曲线,DDLPS中去分化成分的组织学级别高低与患者总生存时间(OS)及无进展生存时间(PFS)的关系采用Log-rank检验进行分析;以P<0.05为差异有显著性。
2 结 果
2.1 临床特征
44例患者中男24例,女20例;发病年龄38~69岁,平均57.5岁,中位年龄59岁。18例无明显诱因腹痛、腹胀或腰痛,26例常规体检发现腹膜后占位,5例有腹膜后WDLPS手术病史。影像学检查:大部分病例腹膜后可见体积较大的密度不均的占位性病变,其中磨玻璃密度灶可能提示存在黏液性成分,部分可见钙化或骨化。20例呈单结节分叶状,8例为多个结节,32例侵犯邻近组织器官。所有病例均行手术切除病灶,其中32例行肿瘤联合邻近受累脏器切除。
2.2 肿瘤形态学特点
①大体形态:44例肿瘤最大径5~50 cm,平均23.4 cm,呈单结节分叶状或多结节状,表面光滑有包膜,部分病例附带邻近受累脏器。肿瘤切面呈灰黄色或灰白色,伴出血坏死呈灰褐色,肿瘤质地不均,可呈油腻质软、质韧硬或脆和黏液样等改变。②镜下形态:肿瘤由WDLPS成分(图1A)和非脂肪源性肉瘤样形态的去分化成分组成,两者突然过渡,分界清楚(图1B),也可表现为移行过渡或混合呈镶嵌状分布。WDLPS成分多位于油腻质软区域,呈脂肪瘤样,其中合并硬化性3例,炎症型2例。镜下表现为大小不一的成熟脂肪由纤维组织分隔成大小不等的小叶,纤维分隔内可见散在分布的核深染的异型细胞,呈梭形、畸形或多核样,亦可见典型脂肪母细胞。去分化成分呈现明显的组织学形态的多样性和异质性,26例(59.1%)肿瘤组织呈高级别非脂肪源性肉瘤特征,其中多形性未分化肉瘤/恶性纤维组织细胞瘤样16例(图1C),高级别黏液性纤维肉瘤样7例,高级别纤维肉瘤样3例。12例(27.3%)肿瘤组织呈低级别去分化组织学特征,包括纤维瘤病样5例,低度恶性纤维黏液样肉瘤样3例,孤立性纤维性肿瘤样3例(图1D),炎性肌纤维母细胞瘤样1例。6例(13.6%)肿瘤组织可见异源性分化,其中骨肉瘤样2例,平滑肌肉瘤样3例,横纹肌肉瘤样1例。3例可见脑膜瘤样漩涡状结节(图1E),结节中央可伴有硬化小血管或骨化。44例DDLPS除上述组织学形态,均可见散在分布的核大、深染的异型细胞及多核细胞,部分间质黏液性变,可见分支状或弓背状小血管。
2.3 免疫组织化学检测结果
44例DDLPS中p16(图1F)、MDM2(图1G)、CDK4(图1H)阳性表达率分别为97.7%、93.2%、88.6%,其中三者同时表达阳性率为77.3%,二者表达阳性率为95.5%;S100、CD117和DOG-1表达均阴性;21例CD34表达阳性;6例CD99表达阳性,其中2例高级别纤维肉瘤样病例呈细胞核旁点状阳性;8例SMA表达阳性,包括3例平滑肌肉瘤样病例;1例孤立性纤维性肿瘤样DDLPS表达STAT6;1例横纹肌肉瘤样DDLPS表达MyoD1、Myogenin;5例纤维瘤病样,2例孤立性纤维性肿瘤样,3例低度恶性纤维黏液样肉瘤样以及1例炎性肌纤维母细胞瘤样DDLPS不表达特异性标志物β-catenin、STAT6、MUC4和ALK。
2.4 FISH检测结果
44例DDLPS均进行了MDM2基因扩增检测,42例有明显扩增(图1I),阳性率为95.5%,2例未见扩增。
2.5 随访及预后
32例病例获得术后随访,随访时间3~70个月,其中11例出现了术后复发(34.38%),6例死亡(18.75%)。去分化成分呈高级别(包括异源性分化)的23例中,术后复发8例,死亡5例;去分化成分呈低级别的9例中,术后复发3例,死亡1例。绘制Kaplan-Meier曲线(图2A、2B),并Log-rank检验显示,DDLPS中去分化成分的组织学级别高低与患者总生存期(OS)无关(P>0.05),与无进展生存期(PFS)也无关(P>0.05)。
3 讨 论
DDLPS大约占脂肪肉瘤的18%,以原发性为主(约占80%~90%),继发性DDLPS约占10%,大多与ALT/WDLPS多次的复发有关[1]。临床上DDLPS好发于中老年人,大多数位于腹膜后和盆腔软组织间隙,肿瘤体积一般巨大(最大径可达30 cm),易出现压迫症状。HENRICKS等[2]报道155例DDLPS,发病年龄21~92岁,中位年龄61.5岁。本文44例腹膜后DDLPS临床资料也显示患者多为中老年人,肿瘤体积较大,以腹痛、腹胀或腰痛为主要症状。
腹膜后DDLPS大体上呈单结节分叶状或多结节状,可有包膜。因肿瘤组织含有数量不等的脂肪成分,切面呈灰黄、灰白色,可伴有黏液样区域。44例患者根据肿瘤大小分别取材5~20块,每个病例取材区域包括肿瘤边缘、肿瘤与受累脏器交界处、不同质地与色泽区域以及交界或过渡区域,镜下每例均可见WDLPS成分,这对DDLPS组织学诊断非常重要。如果标本取材不充分,WDLPS成分可能完全缺如,极易误诊为其他类型的肉瘤。
DDLPS组织学表现为从WDLPS向非脂肪源性肿瘤成分转化,5%~10%可出现异源性分化,如骨/软骨肉瘤样、平滑肌/横纹肌肉瘤样以及血管肉瘤样等,极少数向同源性脂母细胞分化,形态类似于PLPS。WDLPS组织学类型以脂肪瘤型和硬化性为主[2-4],非脂肪源性去分化肿瘤成分大多数呈高级别去分化特征,少数表现为低级别组织学形态。本组病例发现,去分化成分的组织学形态多样,如果取材不充分或认识不充分,很容易造成误诊。形态学的多样性和异质性,包括肿瘤细胞的特殊排列方式和间质黏液变、血管特点是诊断腹膜后DDLPS的重要组织学特征。
免疫组织化学标记对DDLPS病理诊断非常有帮助,尤其是标本取材没取到或者镜下忽视了少量WDLPS成分时。目前认为诊断DDLPS的主要免疫组织化学指标是P16、MDM2及CDK4。在本组44例DDLPS病例中,P16、MDM2以及CDK4阳性表达率分别为97.7%、93.2%及88.6%,其中同时三者表达阳性率为77.3%,二者表达阳性率为95.5%。与文献报道的结果一致[5-8]。但有研究报道MDM2及CDK4在恶性外周神经鞘瘤及横纹肌肉瘤中也有阳性表达[9],故建议最好同时联合检测MDM2、CDK4及P16标记物更有利于DDLPS的诊断及鉴别诊断。本研究结果还显示,21例患者的肿瘤组织中CD34呈灶状或弥漫阳性;6例患者肿瘤组织中CD99阳性,其中2例高级别纤维肉瘤样病例呈细胞核旁点状阳性;8例患者肿瘤组织中SMA阳性,包括3例平滑肌肉瘤样病例;1例横纹肌肉瘤样DDLPS阳性表达MyoD1、Myogenin。本组患者肿瘤组织中S100、CD117、DOG-1、β-catenin、STAT6、MUC4以及ALK均未见阳性表达。因此认为根据DDLPS中去分化成分的组织学特征选择一组用于鉴别诊断的免疫组织化学标记物是非常必要的。
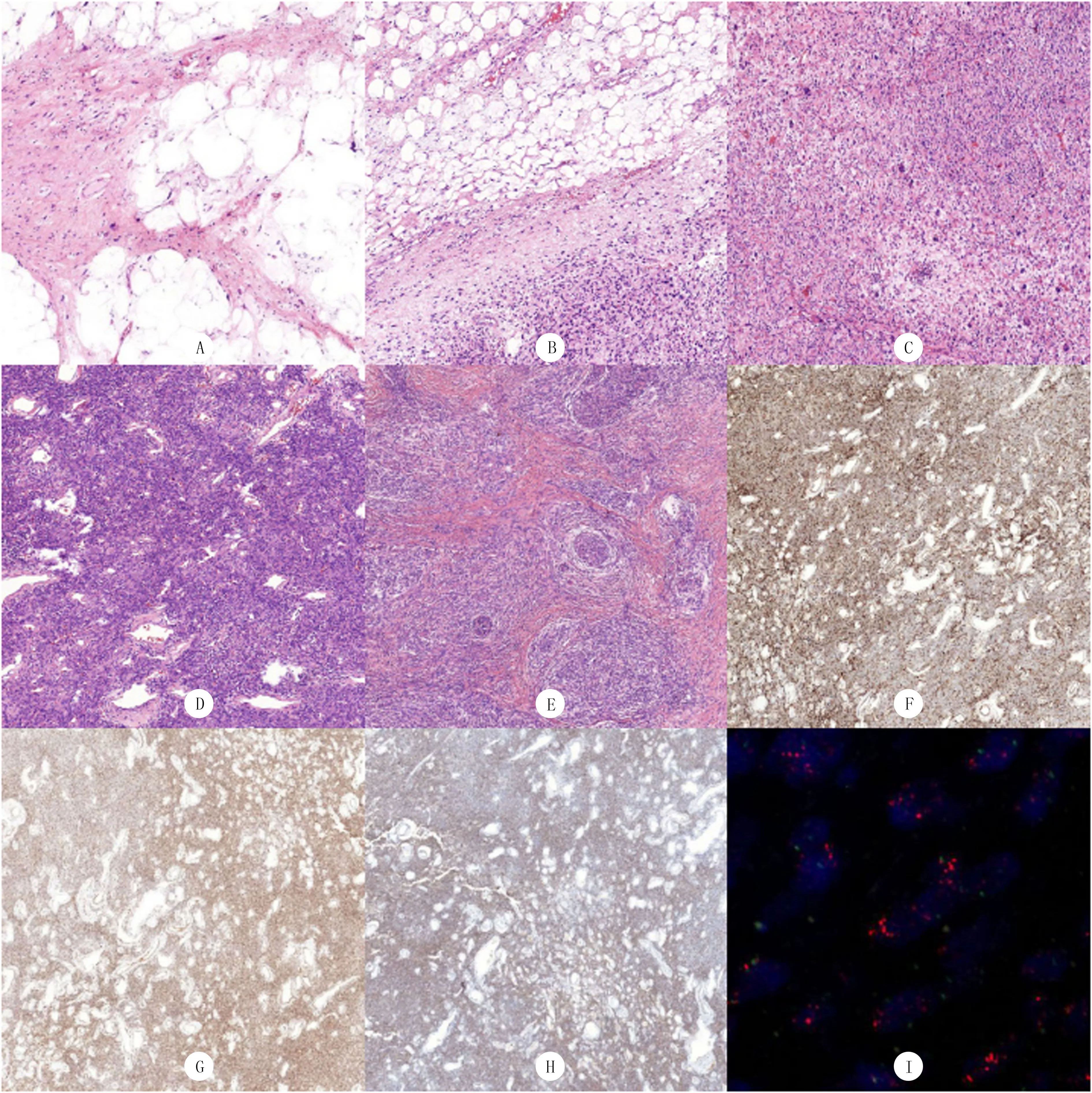
A:DDLPS中高分化脂肪肉瘤成分,HE染色,200倍;B:高分化成分与去分化成分突然过渡,HE染色,100倍;C:去分化成分呈多形性未分化肉瘤样,HE染色,100倍;D:去分化成分呈孤立性纤维性肿瘤样,HE染色,100倍;E:去分化成分排列成脑膜瘤样漩涡状结节,HE染色,100倍;F:肿瘤细胞P16阳性表达,EnVision法,100倍;G:肿瘤细胞MDM2阳性表达,EnVision法,100倍;H:肿瘤细胞CDK4阳性表达,EnVision法,100倍;I:DDLPS存在MDM2基因扩增,FISH,1 000倍
图1 DDLPS的组织学形态及免疫组织化学特征
DDLPS与ALT/WDLPS在遗传学上均拥有源自第12染色体长臂(12q)的超额环状染色体或巨染色体,同时存在着12q14-15区域的高度扩增,包括MDM2、CPM、HMGA2、CDK4以及SAS/TSPAN31基因等[10-13]。其中MDM2基因是ALT/WDLPS和DDLPS发生的主要驱动基因,其扩增以及过表达是脂肪肉瘤形成过程中的最早期事件之一[10,12]。几乎100%的ALT/WDLPS以及DDLPS患者存在MDM2基因扩增,超过90%的患者存在CDK4基因扩增[14]。本研究FISH技术检测结果显示,44例DDLPS肿瘤组织MDM2基因扩增阳性率为95.5%,2例阴性病例的组织学特征和免疫组织化学标记物检测结果支持DDLPS诊断,也可能存在标本选择及处理等方面的原因。FISH技术检测DDLPS肿瘤组织中MDM2基因是否扩增是诊断ALT/WDLPS和DDLPS金标准。
在鉴别诊断方面,应在广泛取材的基础上,结合临床、组织形态、免疫组织化学及遗传学检测结果综合判断。当去分化区域过少时,需与WDLPS相鉴别,寻找灰白、质地韧硬或质脆的区域取材,镜下发现非脂肪源性肿瘤成分即可明确诊断。当去分化成分所占比例较高时,应当与具有相似组织形态的非脂肪源性软组织肿瘤鉴别。COINDRE等[15]认为,腹膜后的多形性未分化肉瘤/恶性纤维组织细胞瘤实际上就是DDLPS。DDLPS的去分化成分具有高级别梭形细胞肉瘤样形态,应与单相梭形细胞型滑膜肉瘤、高级别纤维肉瘤、胃肠道间质肿瘤及恶性外周神经鞘瘤等鉴别。对伴有肌源性、骨/软骨分化的DDLPS需要与真正的平滑肌肉瘤、横纹肌肉瘤及骨/软骨肉瘤等进行鉴别。去分化成分呈低级别软组织肿瘤形态的DDLPS应与硬化性WDLPS、梭形细胞WDLPS、侵袭性纤维瘤病、炎性肌纤维母细胞瘤、低级别黏液性纤维肉瘤、低度恶性纤维黏液样肉瘤、黏液性脂肪肉瘤、孤立性纤维性肿瘤等鉴别。综上所述,需要与腹膜后DDLPS鉴别的软组织肿瘤繁多,首先标本要取材充分,发现WDLPS成分;其次根据不同肿瘤的好发部位,典型的细胞形态、排列方式和常见间质改变等特征进行综合观察分析;最后要结合特异性的免疫组织化学标记物和遗传学检测结果做出正确病理诊断。如滑膜肉瘤存在特征性的SS18基因重排;胃肠道间质瘤比较特异性表达CD117、DOG-1,有C-KIT和PDGFRA基因突变;恶性外周神经鞘瘤局灶表达S100和SOX10;平滑肌肉瘤、横纹肌肉瘤表达SMA、MyoD1、Myogenin;侵袭性纤维瘤病细胞核表达β-catenin;ALK蛋白过表达以及基因重排有助于炎性肌纤维母细胞瘤的诊断[16];孤立性纤维性肿瘤弥漫强表达STAT6、CD34和CD99,遗传学检测NAB2-STAT6基因融合;低级别黏液性纤维肉瘤存在FUS-CREB3L2基因融合,特异性地表达MUC4;黏液性脂肪肉瘤遗传学研究显示为DDIT3/CHOP基因重排,梭形细胞WDLPS表现为RB基因缺失,RB1蛋白表达缺失[17]。本研究认为腹膜后软组织肿瘤出现如下临床病理特征,要首先考虑DDLPS:①发生于中老年人的巨大肿瘤,多次复发;②组织学上表现为多形性、异质性形态;③肿瘤组织出现散在核大、深染的异型细胞及多核细胞,可见间质黏液性变、分支状或弓背状小血管;④可见脑膜瘤样漩涡状结节;⑤免疫组织化学检测P16、MDM2和CDK4,出现3个指标或2个指标同时阳性表达;⑥FISH检测肿瘤组织MDM2基因扩增。总之,腹膜后DDLPS的病理诊断一定要结合临床特征、组织学形态、免疫组织化学标记以及MDM2基因扩增结果等因素综合判断。

A、B分别为DDLPS中去分化成分的组织学级别高低与患者OS和PFS的关系
图2 DDLPS中去分化成分的组织学级别高低与患者预后的关系
发生于腹膜后的DDLPS比其他部位的预后差,患者总生存率低,但比腹膜后其他类型的多形性肉瘤预后相对较好[2-3,10-12]。近年来研究显示,去分化成分的组织学分级与病人的生存率相关,低级别DDLPS比高级别预后好[18-19]。本研究通过对32例患者进行3~70个月的随访,发现11例患者术后复发(34.38%),6例死亡(18.75%),而且单因素生存分析结果显示,DDLPS中去分化成分的组织学级别高低与术后复发、生存无关,但是,由于本研究病例样本不多,因此未作多因素分析。这也可能与本组病例数较少有关。根治性手术切除是改善患者预后最重要的手段,有时需要联合多器官切除[20]。本文44例DDLPS患者中32例行肿瘤联合邻近受累脏器切除。随着对DDLPS中MDM2以及CDK4基因的深入研究,MDM2及CDK4靶向治疗可能应用于临床并可改善患者预后。
