阳离子交换树脂法降低壳聚糖酶解产物灰分的研究
2020-04-11杜双有
杜双有
(杭州澳医保灵药业有限公司,浙江 杭州310018)
壳低聚糖为低分子(chitooligosaccharide)壳聚糖,也称壳寡糖,化学名为2-氨基-β-1,4-葡萄糖胺,分子式为(C6H11O4N)n,聚合度在25~30。壳低聚糖具有独特优越的生理活性和功能性质,用途广泛。在医药方面,壳低聚糖有多方面生理功能及抗肿瘤效果,特别是甲壳六糖有很强的生理活性,可作为早期肿瘤的治疗药物,有抑制肿瘤毛细血管内皮的生成,致使肿瘤毛细血管不能加长而局限在局部的作用。但在医药生化领域应用壳低聚糖,往往对灰分有较严格的要求,如胶囊剂和片剂一般要求灰分少于1%。由于原料壳寡糖在加工过程中脱钙不完全及原料中重金属含量过高,市场上可售壳聚糖的灰分常大于0.5%,再加上传统的壳低聚糖的制备方法是对壳聚糖进行化学降解或酶解,一种较经典的工艺流程为,将壳聚糖加水混合均匀后加酸溶解,再加入纤维素酶制剂,经过滤后得壳低聚糖溶液,最后经喷雾干燥得壳低聚糖[1-2]。纤维素酶的引入[3],若纤维素酶的灰分大于7.5%时,其得到的产品壳低聚糖的灰分就有可能超过1%的标准,带来产品不合格的风险。市场上纤维素酶的灰分一般大于7.5%,为降低壳低聚糖的灰分,首先要降低纤维素酶的灰分,要了解纤维素酶中的灰分组成。湖南利尔康生物股份有限公司制备的食品添加剂纤维素酶,采用的是常用里氏木霉经液体深层发酵和先进的后提取工艺生产、精制而成[4]。包括以下步骤:种子培养→得种子液→发酵培养→粗提取→分离→纯化→浓缩→干燥。在粗提取过程中,由于纤维素酶能溶解于水,且在一定浓度的盐溶液中,其溶解度增加,故一般采取在稀盐溶液中进行纤维素酶的提取,常用的盐溶液一般为加入约占纤维素酶量的8%氯化钠盐溶液,在将发酵生产的纤维素酶浸提出来,在后续生产过程中不去除氯化钠盐,这些氯化钠盐就形成了纤维素酶最主要的灰分。
强酸性苯乙烯系阳离子树脂(湿计)是在交联为7%的苯乙烯·二乙烯共聚体上带有磺酸基(—SO3H)的阳离子交换树脂,交换原理为:这类树脂含有大量的强酸性基团,如磺酸基—SO3H,易在溶液中离解出H+,故呈强酸性。树脂离解后,本体所含的负电基团,如SO3-,能吸附结合溶液中的其他阳离子。这2个反应使树脂中的H+与溶液中的阳离子互相交换[5-6]。树脂在使用后要进行再生处理,即用化学药品使离子交换反应以相反方向进行,使树脂的官能基团恢复原来状态,以供再次使用。强酸性阳离子树脂是用强酸进行再生处理,此时树脂放出被吸附的阳离子,再与H+结合而恢复原来的组成。鉴于此,参考各类降低灰分研究的文献资料[7-10],本研究中采用把酶溶于水后,与型号为“Na+”的强酸性苯乙烯系阳离子树脂(湿计)进行离子交换处理,以去除纤维素酶中的灰分,进而降低壳聚糖酶解产物(壳低聚糖)灰分。现报道如下。
1 仪器与试药
1.1 仪器
AL204型电子天平(梅特勒-托利多仪器<上海>有限公司,检测精度为0.1 mg);SXL-1008型程控箱式电炉(上海精宏实验设备有限公司);GL-100型双层圆盘电炉(嘉兴市凤桥电热器厂)。
1.2 试药
纯化水(杭州澳医保灵药业有限公司制水车间自制);强酸性苯乙烯系阳离子树脂(湿计,浙江杭州双林化工试剂厂);食品添加剂盐酸(杭州电化集团有限公司,批号为20170623);纤维素酶(湖南利尔康生物股份有限公司,批号为20171114-105,规格为每袋1 kg);壳聚糖(青岛云宙科技生物有限公司,批号为1709023)。
2 方法与结果
2.1 灰分测定
取大小适宜的坩埚置程控箱式电炉中,在(550±25)℃下灼烧0.5 h,冷至200℃以下后,取出,放入干燥器中冷却至室温,精密称定,并重复灼烧至恒重(前后2次称量相差不超过0.5 mg)。在恒重好的空坩埚中,加入2 g(精确至0.000 1 g)样品,先在电热板上以小火加热,使样品充分炭化至无烟,然后置程控箱式电炉中,在(550±25)℃灼烧4 h至灰化完全,冷至200℃以下后,取出,放入干燥器中冷却至室温,精密称定(重复灼烧前后2次称量相差不超过0.5 mg)。计算公式:灰分(%)=(W2-W空)/W1×100%,其中W空为空坩埚重(g),W1为样重(g),W2为灼烧后称重(g)。
2.2 方法选择
由于在制备生产纤维素酶的过程中,引入淀粉作为载体,淀粉不易溶解,易形成糊状,在使用动态柱离子交换时会使交换柱堵塞,而用静态浸泡交换法时[11-12],只要控制好树脂和纤维素酶液的比例,不断搅拌,可使离子在树脂与溶液中达到平衡,离子交换过程可顺利进行,故采用静态浸泡离子交换法来处理。
2.3 阳离子交换树脂法降低纤维素酶灰分的工艺方法
2.3.1 预处理
阳离子交换树脂预处理:取乌合桶1个,加强酸性苯乙烯系阳离子树脂15 kg,加纯化水10 kg,再加浓HCl 4 500 mL,搅匀,pH=1,放置6 h。以一层纱布过滤,加50kg纯化水搅匀,过5min过滤,如此重复8~9次,至pH=6~7,将乌合桶(内树脂浸于水中)放置,待用。
酶溶液预处理:在酶解前1d进行,称取纤维素酶5kg置乌合桶中,加水30 kg,搅拌,溶解,放置过夜。
纤维素酶液离子交换处理:将预处理好的酶液倒入已滤去水的树脂中,放置0.5 h,中间搅拌数次。以一层纱布袋过滤,滤除树脂,得经离子交换树脂处理好的酶液。
2.3.2 酶解
在夹层锅中加入纯净水900 kg(50℃),加入经阳离子交换树脂处理好(或未经阳离子交换树脂处理过)的酶液,再加壳聚糖100 kg,搅拌均匀,再向夹层锅内缓缓加入食品级盐酸36 kg,适当搅拌,55℃保温,酶解8 h,过滤,喷雾,得壳低聚糖。根据食品安全国家标准食品灰分的测定方法(GB 5009.4-2016)测定壳低聚糖灰分。
2.4 纤维素酶与强酸性苯乙烯系阳离子树脂用量设计
若纤维素酶未进行阳离子交换树脂处理,其产物壳低聚糖的灰分预计:批号为1709023壳聚糖的灰分为0.6%,100 kg壳聚糖的灰分为100 kg×0.6%=0.6 kg(Ⅰ);批号为20171114-105纤维素酶的灰分为7.5%,5 kg纤维素酶的灰分为5 kg×7.5%=0.3375 kg(Ⅱ);总灰分=Ⅰ+Ⅱ=0.375+0.6=0.975 kg。
100 kg壳聚糖酶解后得壳低聚糖约110 kg,灰分估计为0.975 kg÷110 kg=0.89%。
为去除纤维素酶中的灰分,需强酸性苯乙烯系阳离子树脂(湿计)用量的计算[13],强酸性阳离子树脂基本参数见表1。
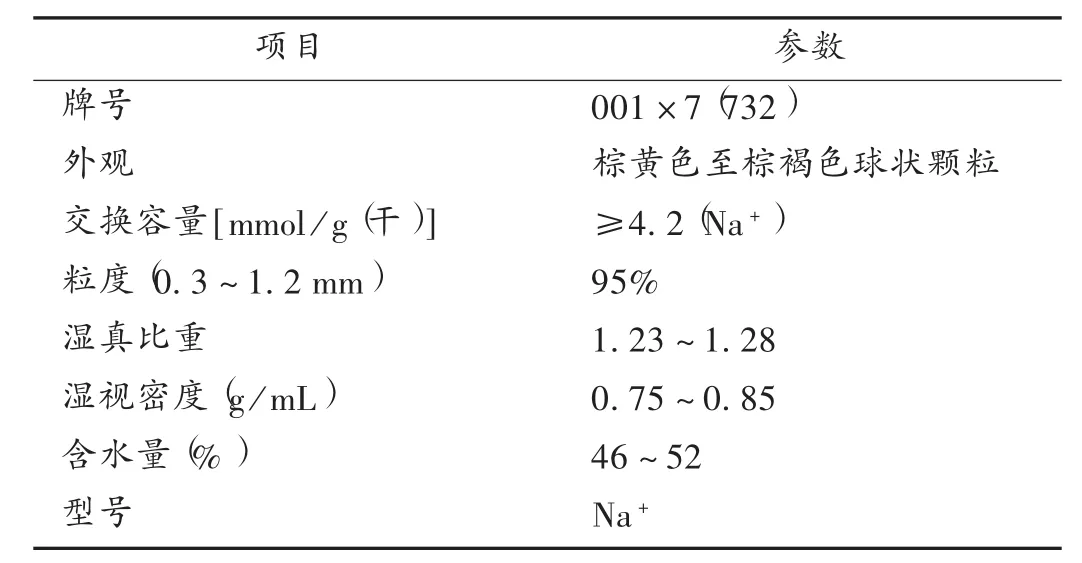
表1 强酸性阳离子树脂基本参数
批号为20171114-105纤维素酶的灰分为7.5%,5 kg纤维素酶的灰分为5 kg×7.5%=375 g(Ⅰ)。
根据树脂全交换容量(≥4.2 mmol/g)、钠的摩尔质量(M,23 g/mol)、含水量(46%~52%),计算纤维素酶中375 g的灰分的物质的量为(以钠计):n=m/M=375 g÷23 g/mol=16.3 mol(Ⅱ)。其中,n为物质的量,m为物质的质量,M为物质的量。
需阳离子树脂的量为16.3 mol÷4.2 mmol/g=3.88 kg。
折算掉含水量为3.88÷(1-0.52)(含水量)=8.08 kg。
因为强酸性苯乙烯系阳离子树脂的工作交换容量是在给定工作条件下实际可利用的离子交换能力,一般只有理论上的交换容量约60%。按实际工作交换容量折算:8.08÷0.6=13.5 kg。
考虑到工作交换容量与实际运行条件的关系非常大,起始用量采用15 kg。第1次阳离子交换树脂15 kg处理后,壳低聚糖的灰分为0.72%。可见,15 kg阳离子交换树脂的真正工作交换能力不到375g,只有约110 kg×(0.92%-0.72%)=220 g,要去除375 g的灰分,估计需阳离子交换树脂为375 g÷220 g×15 kg=25.6 kg。因此分别采用以每次递加5 kg的量,即20 kg和25 kg的强酸性苯乙烯系阳离子树脂用量继续考察对纤维素酶去除灰分的作用,强酸性苯乙烯系阳离子树脂分别为0,15,20,25 kg。
2.5 强酸性苯乙烯系阳离子树脂的再生[14]
经静态交换的强酸性苯乙烯系阳离子树脂,经甩干,水洗,再甩干的步骤,再加浓盐酸(HCl),搅匀,调pH=1,放置,再生,待用。结果见表2。

表2 纤维素酶与强酸性苯乙烯系阳离子树脂用量比例变化
3 讨论
强酸性阳离子交换树脂可交换所有的阳离子,因纤维素酶中的灰分主要是氯化钠盐,故采用型号为“Na+”强酸性苯乙烯系阳离子树脂进行阳离子交换:R-H(阳离子交换树脂)+M-Cl(酶)→R-M+HCl,其交换产生的HCl又可作为壳聚糖酶解时用的盐酸,故不需要对Cl-进行阴离子交换去除。本研究中的创新点正是只需进行1次阳离子交换,无须进行阴离子交换去除阴离子,操作步骤简便,就可达到降低纤维素酶的灰分,进而降低壳低聚糖灰分的目的。
灰分是产品质量的关键控制点。由表2可见,壳低聚糖的灰分降低效果明显。纤维素酶用量5 kg不变的情况下,随着阳离子交换树脂用量的增加,能交换去除纤维素酶中阳离子的量也相应增加,即能去除的灰分就增加,灰分降低。当纤维素酶用量-阳离子交换树脂用量(kg)的比例为5∶25(即1∶5)时,纤维素酶中的灰分已基本去除,壳低聚糖中的灰分达到产品的质量要求,不仅提升了产品质量,也大大降低了产品因灰分不合格而报废的风险,提高了效益。该方法具有交换容量大、产业化放大容易、树脂可长期反复使用的特点,操作工序简便易行、生产成本低,可广泛应用于生产实践,为壳低聚糖的生产和广泛应用在质量上提供了有力保障,也能产生良好的社会效益和经济效益。
鉴于壳聚糖原料中也存在一定的灰分,是否结合去除壳聚糖中的灰分,进一步提升壳低聚糖的质量,还值得今后进一步探讨[15-16]。
