浅谈美国医疗器械监管机构重组及启示
2020-04-10商惠张世庆
商惠,张世庆
国家药品监督管理局医疗器械技术审评中心,北京市,100089
0 引言
现今人们对健康的重视日益增加,对医疗器械的需求也越来越多,促使医疗器械相关科学技术迅速发展,而医疗器械涉及医学、免疫学、组织工程、生物医学工程、材料学、电子信息等诸多学科,前沿科学技术的转化和创新医疗器械产品的涌现使得医疗器械监管部门面临巨大挑战。为积极应对医疗器械行业的多重挑战,各国监管机构都在寻求科学、高效的对策保护和促进公众健康。
此次器械和放射保护健康中心(Center for Devices and Radiological Health,CDRH),机构重组并不改变其职能,意在依据产品线整合CDRH上市前和上市后的监管资源,利用专业人员的知识优化决策,对医疗器械实现全生命周期(Total Product Lifecycle,TPL)的监管。重组新机构采取分阶段实施的方法,从2019年3月18日开始运行部分部门,期望在2019年9月底全运行。本研究将从CDRH机构的建立、机构重组的目的和现状,探析对我国医疗器械科学监管的一些启示。
1 CDRH机构的建立
1906年,当时美国总统Theodore Roosevelt签署“Pure Food and Drugs Act”,后成立了美国食品和药品管理局(FDA的前身),国会上明确了FDA在保护和促进人用药、兽药、生物制品、医疗器械和辐射产品以及化妆品的发展方面的职责。由于当时对医疗器械的监管重视程度不够,在1938年、1944年、1968年、1970年、1976年法案多次修订中并未提及。直至1982年,FDA将医疗器械和辐射产品的管理单位合并为CDRH,自此美国越来越重视对医疗器械的监管。
现今,美国食品药品管理局(FDA)是美国政府在健康与人类服务部(DHHS)和公共卫生部(PHS)中设立的执行机构之一,其主要职责是促进和保护公众卫生健康。FDA由食品安全和营养应用中心(CFSAN)、药品评估和研究中心(CDER)、器械和放射保护健康中心(CDRH)、生物制品评估和研究中心(CBER)、兽用药品中心(CVM)、烟草制品中心(CTB)、卓越肿瘤中心(OCE)和日常事务办公室(ORA)8个部门组成[1]。其中CDRH需确保患者和医疗人员及时且持续获得安全有效和高质量的医疗器械和放射性产品,同时为消费者、患者及医疗人员提供所监管产品的信息,因而该中心是FDA在医疗器械领域的主要监管机构。
2 CDRH机构重组前准备
医疗器械监管职责包括产品的全生命周期,从医疗器械产品的早期研发、生产、销售直至售后。产品生命周期的各阶段,均需相关部门制定适宜的监管措施,收集有价值的产品信息用于助力产品上市前监管的决策[2-8]。2013年9月,FDA内部形成了项目联合小组(Program Alignment Group,PAG),FDA项目在医疗器械全生命周期的监管排列见图1,PAG计划的制定旨在解决和应对创新、全球化、受监管产品日益复杂、“新法规”相关的挑战,这些变化给FDA带来很大的压力和改革需求。因此,FDA希望通过PAG计划制定出可能的最佳计划,在不增加制造商和研究者额外负担的原则下解决这个行业监管范围内的问题。该举措为后期推进CDRH机构重组打下了坚实基础。
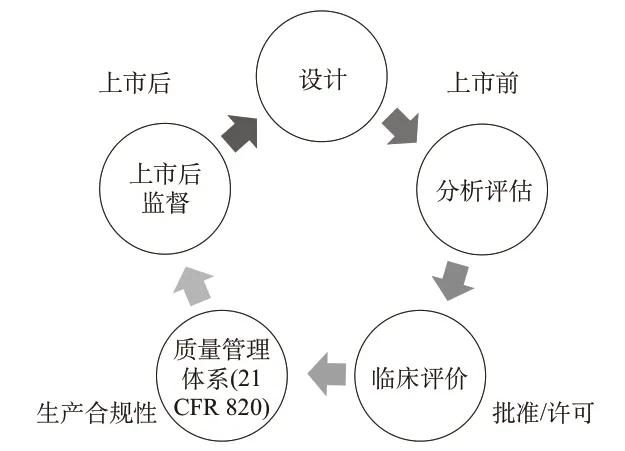
图1 美国食品药品监督管理局(FDA)项目在医疗器械全生命周期监管排列图Fig.1 U.S.Food and Drug Administration(FDA)program's regulatory arrangement for the entire life cycle of medical devices
3 CDRH部门概况
2018年2月,CDRH合规办公室监管事务副主任Sean Boyd公开发表讲话,表示CDRH正在采取调整计划以做好器械全生命周期的监管。自此,CDRH机构重组开始进行。目前由FDA网站信息可知,此次CDRH机构重组将原来的10个办公室改为7个,现CDRH包括中心主任办公室、沟通和教育办公室(OCE)、管理办公室(OM)、产品评价和质量办公室(OPEQ)、科学和工程实验室办公室(OSEL)、政策办公室(OP)、战略合作和技术创新办公室(OSPT)。重组过程中将原合规办公室(OC)、器械评价办公室(ODE)、体外诊断和放射卫生办公室(OIR)以及监测与生物统计办公室(OSB)合并为现在的超级办公室(super office)——产品评价和质量办公室(OPEQ)。CDRH机构重组前后对比见图2。

图2 器械和放射保护健康中心(CDRH)机构重组前后对比图Fig.2 Comparison of before and after reorganization of CDRH institutions
4 CDRH机构重组重点变化
4.1 组建产品评估和质量办公室(OPEQ)
OPEQ(超级办公室)已于2019年5月1日正式运行。该超级办公室将专注于医疗器械产品全生命周期监管,以确保患者能够获得全生命周期保持高质量、安全和有效的医疗器械。CDRH依据产品类型和技术将产品审评、质量、监管等相关专家整合到特定团队,重组后的机构将开始一种新的业务方式,使得监管人员能够更好地关注器械、制造商和医疗器械行业。OPEQ下设各部门将集合特定技术团队的评估、合规、监督和放射卫生办公室的综合专业人员,以简化监管审查的绩效并改善沟通。
4.2 细化OPEQ下设部门
OPEQ下设直属办公室、法规项目办公室(Office of Regulatory Programs)、临床证据和分析办公室(Office of Clinical Evidence and Analysis)以及7个卫生技术办公室(OHT)。OPEQ架构见图3。OHT与之前ODE中组织上市前部门一致,每个办公室将负责某类特定器械产品线全生命周期监管。如OHT2心血管器械办公室,将心血管器械相关的上市前评估、合规和执行、监管人员合并到OHT中,依据心血管产品线形成多个小组,但整个团队会定期分享他们在上市前监管、召回或检查报告审查、不良事件报告等信息并互相交流,更好地了解技术或产品制造过程中的信息。
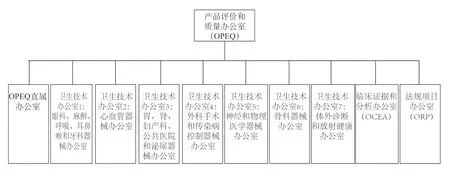
图3 产品评价和质量办公室(OPEQ)架构Fig.3 Organization of Office of Product Evaluation and Quality(OPEQ)
4.3 优化其他部门设置
CDRH在机构重组过程中也合并了部分办公室。一是政策办公室(OP),该办公室包含两个新成立小组——指南、立法和特别项目小组,以及监管文件和特别项目小组。二是合并科学与战略伙伴关系部门、数字健康、健康信息和创新团队,组建战略合作伙伴关系和技术创新办公室(OSPT),各团队继续履行其原有职能。CDRH通过重新调整管理服务架构,使整个医疗器械监管体系能够通过最优化的机构设置、最佳的协调机制提供卓越的服务。三是将内部和外部沟通交流职能合并入沟通和教育办公室(OCE)下设的交流部门,达到简化CDRH中心的沟通交流职能的目的。
5 讨论与启示
CDRH此次机构重组是根据医疗器械产品线整合CDRH上市前审批和上市后监管职能,以期相关专家能够更好地利用现有技术知识优化基于产品线的决策,通过重组创建一个更加高效、完善的组织架构,畅通内部信息共享渠道,从而更好地专注医疗器械全生命周期监管。众所周知,医疗器械涉及多学科,机理差别巨大,其复杂性是确保患者获得安全或创新产品的障碍,而如何科学地简化评估和监督过程值得相关监管部门探究。CDRH此次机构重组是一次积极探索,因而带来几点关于我国医疗器械监管的思考。
5.1 医疗器械全生命周期信息整合
在原CDRH机构中,大型的办公室有200~600人,自然会在CDRH内部形成中心信息共享的障碍,从而阻碍专业人员在规定时间内了解相关信息进而做出科学决策。因此,使得CDRH期望通过这种信息整合、协同工作的模式更高效、科学地做出决策。
我国第二类、第三类医疗器械实行注册管理,境内第二类医疗器械由省级医疗器械监管部门负责审评审批,进口第二类、第三类及境内第三类医疗器械由国家药品监督管理部门负责审评审批。同时,医疗器械产品检验、生产核查、临床核查、不良反应监测、上市后监管等职能均由不同部门完成。各监管部门仅了解产品生产、研发、上市前研究、不良反应等碎片式信息,形成众多“信息孤岛”。整合医疗器械产品全生命周期监管信息,切实做到上市前和上市后监管融合、信息共享不失为突破障碍,向科学监管迈出的一步积极探索。
5.2 临床为导向的科学决策
此次机构重组后,OPEQ下设的临床证据和分析办公室分为两个处室,生物统计学处包含了原监测与生物统计办公室的生物统计学处职能;新科室——临床证据科学和政策处对临床试验设计和开展,流行病学和真实世界证据分析,与医院和其它机构开展外延合作,提供政策和项目支持。
2019年国家药品监督管理局医疗器械技术审评中心(简称“器审中心”)也进行了机构改革,抽调原有技术审评部门的临床与统计学专家形成了两个临床与生物统计部门,分别针对医疗器械和体外诊断试剂申报中涉及的临床与统计资料进行审评。表明器审中心对医疗器械临床研究、避免临床资源浪费、建立科学临床评价途径的重视。
5.3 上市后信息纳入上市前审评决策
FDA持续推进“最小负担”(the Least Burdensome)原则的应用,即在适当的时间,以最有效的方式,使用所需的最少信息量解决监管问题。CDRH为切实完成相关工作,同时提高应对多方面挑战的能力,提升维护公共健康水平的效率,CDRH基于科学现状,考虑将一些数据的收集由上市前转变为上市后,利用真实世界数据支持上市前决策。
器审中心积极参与国际监管者论坛(IMDRF)相关项目,持续参与和推进真实世界数据在我国的落地,完善医疗器械产品注册、上市使用、不良反应等数据的收集和使用探索,建立相关机制以期将最新的科学信息纳入决策制定中,从而更好地应对全球化相关的挑战。
6 展望
2018年6月以来,CDRH基于医疗器械产品全生命周期的监管模式开始尝试运行,以期新的组织架构全面实施后,能促进整个CDRH的信息共享,加强集体决策,充分发挥员工的专业能力。虽然CDRH此次机构重组抱有诸多期许,但一些医疗器械专业人士仍对机构重组能否带来实质变化持怀疑态度,机构重组能否完成实质的转变,OPEQ如何与OC、ODE、OSB等办公室协调合作,OPEQ作为超级办公室如何充分调动人员积极性,提高运行效率和质量,仍需持续关注其后续进展和新办公室运行细节。
