医用加速器差异化设计思想的探讨(上)
2020-04-10田新智
田新智
新里程医用加速器(无锡)有限公司,无锡市,214121
0 引言
众所周知,放射治疗是肿瘤治疗的三种手段之一,其既可以作为其它治疗方式的补充,又可以独立完成治疗过程,在肿瘤治疗的贡献上渐渐达到了手术的程度。也就是说,随着制造工艺、微波技术、控制技术、影像技术和IT技术的发展,放射治疗的治愈率(或者说5年生存率)得到了非常大的提高。图1是对三种肿瘤治疗手段的治愈率做出的一个统计。

图1 各种手段的肿瘤治愈率统计Fig.1 Statistics of tumor cure rates by various means
从图1中可以看到,从2000年到2013年,在国际范围,肿瘤的综合治愈率从45%提升到67%,其中放射治疗的贡献最大,从18%提高到30%,尤其对比化疗的有限的提升率更为明显。而这段时间恰好是X线放疗技术从常规放疗→精确放疗→影像引导放疗的发展时期,同时也是粒子放疗技术逐渐成熟得到大力推广、普及和应用的时期。很显然,设备学的飞速进步对放疗手段丰富和治愈率的提升起到了关键性的作用。
随着临床技术和设备的发展,现在肿瘤治疗的手段和技术层出不穷,放疗市场逐步扩大,这对于有意从事肿瘤治疗行业的投资商以及工程人员来说,既是机会也是挑战。机会在于随着整个社会经济水平的提升以及对自身健康和生命的关注,肿瘤治疗行业特别是放疗设备的市场空间越来越大,肿瘤放疗装备行业有逐步从亏损经营到多年盈亏持平,再到短期内就有望赢得巨大盈利和发展空间的方向转变,研制、生产与市场营销,目前正逐步由以前的冷门行业向热门行业迈进。挑战在于,社会的发展同样意味着对设备本身的要求(技术、质量)越来越高,从事肿瘤治疗设备行业的技术门槛越来越高(相对其他医疗器械设备,特别是其他行业装备,放疗产品的投资大、开发周期长),竞争越来越激烈(竞争者和潜在竞争者越来越多),产品发展的方向越来越多元化,产品规划的难度越来越大。
如何在产品规划和产品设计过程中来把握和创造真正的竞争优势呢?怎样评价一个产品规划和设计的成功与失败是我们接下来需要思考的一个课题。
1 放疗设备与技术跟随临床需求的发展
1.1 放疗设备与临床技术的发展简介
1957年在美国安装了世界上第一台直线加速器,标志着放射治疗开始形成为一个完全独立的学科。20世纪80年代到90年代,随着计算机的应用和CT、MRI影像在放疗中的应用,我们逐渐开发出来三维治疗计划系统和多叶光栅,逐步实现了三维适形放疗,放射治疗学进入了从二维到三维治疗的崭新时代。
近二十年来,我们更是广泛地发展了立体定向放射外科、三维适形放疗、调强适形放疗、容积旋转调强、图像引导放疗、非均整(Flattening Filter Free,FFF)、立体定向放射治疗(Stereotactic Body Radiation Therapy,SBRT)、靶区追踪等放疗新技术,从而涌现了一批批高科技含量的放疗设备。但不管怎样发展,总的发展趋势是从常规放疗到精确放疗、从固定束治疗到旋转束治疗、从盲目放射到精准放射(从二维位置验证到三维配准定位)、从医学影像引导到功能影像引导再到分子影像引导、从离线ART治疗到实时在线ART治疗等等,可谓是精彩纷呈目不暇接。
实际上,除了医用电子直线加速器在不断地发展,其他的放疗设备也在发展。目前世界上针对肿瘤进行放射治疗的装备大致还有如下几种:
(1)外照射远距离治疗机:同位素远距离治疗机、医用电子直线加速器、医用质子加速器、医用重离子加速器、医用中子发生器、硼中子(1 eV到10 keV的慢中子)俘获治疗装备、医用π-介子发生器;
(2)内照射近距离治疗机:γ射线后装机、中子后装机;
(3)立体定向放射外科治疗装置:γ-刀、X-刀、质子刀、中子刀。
正如上面所提到的一样,绝大多数的分析判断,基本上都是从工程技术的角度来分析和判断放疗设备的发展方向,但是单纯从技术发展的角度来看待设备发展方向,容易出现以下问题:①为了追求技术的极致,容易忽视产品的市场承受能力;②与市场需求脱节;③产品开发路线容易同一化和同质化;④产品设计特点大而全,不利于产品的小型化、专业化设计和成本的控制。
基本事实是临床的需求每家医院都不尽相同,设备形态、功能和技术的应用也是多样的。这也合乎世界的多样性以及细分市场需求多样性的特点。市场和设备之间的竞争之所以存在,正是因为这种需求多样性导致。
为此,我们希望在这眼花缭乱的设备形态和技术的背后,寻找出放疗设备的发展方向,同时希望在满足用户需求的众多技术展现的背后,找到发展的逻辑与方法,而避免被这些技术展现本身所误导。
既然设备的技术本身是服务于客户需求,那么放疗设备的发展也必须从用户需求的方向上来梳理。总体来说,设备的发展既然不是随意的,那它必须是在某种规范下被驱动而逐步前进的,这种规范和驱动力,既不是现有市场上已有的具体的参考对象,也不是高、精、尖的技术本身,回到需求方向来整理的话,我们发现,实践过程中不断丰富内容和提升境界的临床需求决定了放疗设备和技术应用的发展方向。
1.2 放疗的临床需求和设备的技术要求
1.2.1 临床上对射线类型的选择
市场上主流的放疗设备自然还是利用伽马射线或X线来对肿瘤靶区机型照射,但是这里需要特意提及一下粒子放疗技术。站在差异化的角度上来看,笔者倾向于将光子、电子、质子、重离子等射线在临床上的应用理解为临床工具或手段,而将基于某种射线发展出来的临床方式方法理解为临床技术。从目前的情况来看,质子重离子的临床技术远没有光子临床技术完善和成熟。所以从临床应用角度来说,单纯利用布拉格峰的存在来强调质子重离子治疗比光子治疗优越是没有意义的,立体定向放疗技术的产生有效地提高了光子的临床效应,而质子重离子由于结构的局限目前还不能应用立体定向治疗技术。所以想强调粒子治疗技术手段比光子治疗优越的地方,应该是从粒子物理特性及临床效应上来突出。
需要关注的点是:不同类型的放射线照射机体后所产生的生物学效应存在一定差异。从理论上讲:X线对癌细胞的杀伤相对较轻,肿瘤细胞存在一定程度上修复的可能性,相比之下质子对肿瘤则体现出较强的杀伤力,但它们也多只具备击断DNA单链效果;而重离子束(碳素)又有着更强大的破坏力,更多的是直接击断DNA双链,杀死细胞。按照这个趋势来推测,是否意味着未来放疗领域内更强大的放射线及其对应的治疗技术有望被应用于临床?理想的放射治疗的必要条件是杀死肿瘤中的全部癌细胞,不伤害患者的正常细胞,且没有复发的后效应等。从医学和经济综合观点来看,尽管质子和重离子是一种先进的治疗粒子,但是也还不是理想的粒子。质子和重离子的治疗也有其特定的医疗范围。如果按照“只要使肿瘤处照射足够大的使癌细胞致死的剂量,而尽量使肿瘤周围正常细胞少受照射,使副作用最小”的原则来看,只要放疗严格按照质量规范来执行,都是满足此条件的,但是也有30%的局部肿瘤,用常规治疗根本找不出能控制的剂量值。这就需要用质子和重离子来治疗了。
(1)质子和重离子适合于治疗那些接近敏感器官,属于不可手术或用X线和电子治疗难以达到局部控制的肿瘤;
(2)原来用常规放疗也能治好但是副作用难以全部消除且复发率高的肿瘤,如前列腺;
(3)大量儿童患者,由于正常组织处于发育期,一旦放疗受损就会产生畸变致残停滞发育等严重后果的;
(4)许多不规则形状的肿瘤,即使用X线调强治疗也费时费力的肿瘤;
(5)对X线和电子线甚至于质子也难以治疗的具有抗阻性、乏氧型肿瘤,就只能用重离子治疗了。
应用其他的粒子进行临床治疗的研究情况在这里就不多说了。
1.2.2 常规放疗的临床需求和设备的要求
常规放疗技术从放疗伊始一直到现在还在临床中得到广泛的应用,其主要特点是临床的操作要求相对简单,放疗计划的制定也比较简单,多使用规则的射野,辅以楔形档块和外挂铅档块等方式对射束进行一定的修正。20世纪90年代以前国内各医院配置的基本上都是这种设备,近些年有把只具备3D适形治疗设备功能的医用加速器归入到常规放疗设备范畴的趋势。常规放疗设备是现代放疗技术的基础,尽管现在逐步被更先进的放疗技术所取代,但一些根本性的临床要求仍然是放疗设备发展的基础和要求,对放疗设备的开发与发展具备奠基性的意义,见表1。
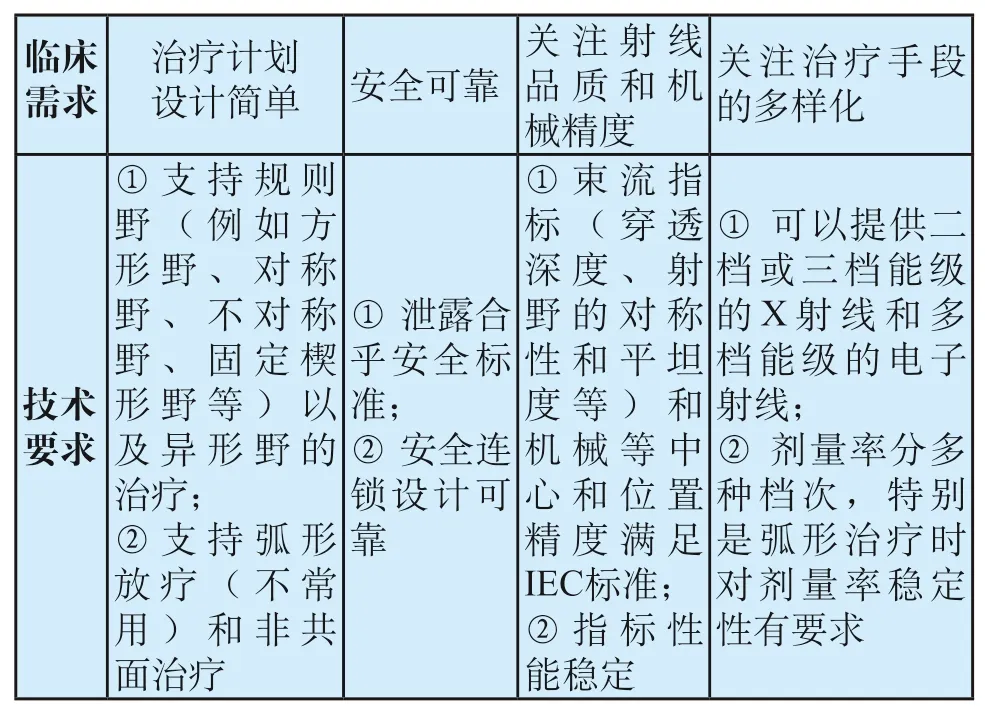
表1 常规光子放疗的需求Tab.1 Application requirements of conventional photon radiotherapy
一般来说,常规放疗技术比较简单,主要使用规则射野对靶区进行射线放射,通常会从不同的角度使用几个射野,有时也会使用楔形档块或者外挂铅档块来修整射束形状(即等剂量曲线),或使用弧形治疗、非共面治疗等。总之,常规放疗基本还是基于规则射野的放疗技术,对靶区的适形不是非常理想;另外,一些正常组织和危及器官紧邻靶区的部分也无可避免地会受到过量的照射。而如果考虑到对正常组织和危及器官耐受剂量的限制,往往会导致对靶区加量不足。所以,常规放疗最大的问题在于无法解决如何在靶区加量同时又能保护正常组织和危及器官这一矛盾。
常规放疗主要要求放疗设备的核心微波系统即以加速管为核心的微波系统具备稳定和可靠工作的能力,很显然束流品质的变化将直接影响治疗的效果,因此输出射线的能量和剂量率的稳定至关重要。在设计微波系统的时候:①要尽量考虑一定的功率冗余能力;②采用“DE-q”或其他技术手段稳定输出脉冲高压;③设计并采用束流伺服和剂量率伺服系统。
1.2.3 精确(调强)放疗技术的需求和设备的要求
我们知道,由于X线的天然特性,其射线的剂量衰减曲线是随着进入物体的深度而衰减的。换句话说,就是射线到达物体深部靶区时,其在整个放射路径上的剂量分布却是外层的部分受量大而靶区受量小。这是电磁类射线的共性,无法克服,因此如果要在内部靶区实现剂量聚焦,则需要在多个方向完成投照,方向越多,则在某一确定方向上接受的剂量会被平均得越小。事实上,和X 线性质类似的伽马射线装置就很好地应用了这个原理,对靶区使用几十甚至上百个60Co源来达到病灶边缘剂量陡降的效果。加速器精确放疗技术其实就是在多方向投射的基础上再结合电动多叶光栅的2D 平面的不规则形状的快速适形能力来达到整个3D 空间的剂量适形,从而解决在对靶区加量的情况下保护危及器官。为此我们整理了精确放疗的要求,如表2所示。
针对上述需求,现已开发的精确放疗技术主要如下:
(1)调强技术,分为静态调强(Step &Shoot IMRT)和动态调强(Dynamic IMRT)或称“滑动窗”技术(Sliding Window);
(2)容积调制旋转调强治疗技术(Volumetric Modulated Arc Therapy,VMAT)。
调强技术的出现是放疗技术发展的第一个里程碑,这种方式主要通过电动多叶光栅(MLC)来实现,MLC的配置与否,也是区分加速器有无能力从事精确放疗的分界线。自此,MLC也成为和加速器系统并重的分系统。调强主要是通过在多个方向投射预先由治疗计划系统(Treatment Planning System,TPS)计算的多个不规则子野(Segment)来完成的,以达到精确放疗的目的。调强技术出现的最大意义在于给予了一种实用的技术既能够保证在靶区注入更高剂量的同时仍能够把周围的危及器官的剂量压低,这改变了常规放疗权衡这两者时经常陷入两难境地的局面。当然,调强技术的出现对加速器提出了更高的要求(见表2),呈现出与常规放疗加速器完全不一样的功能要求。
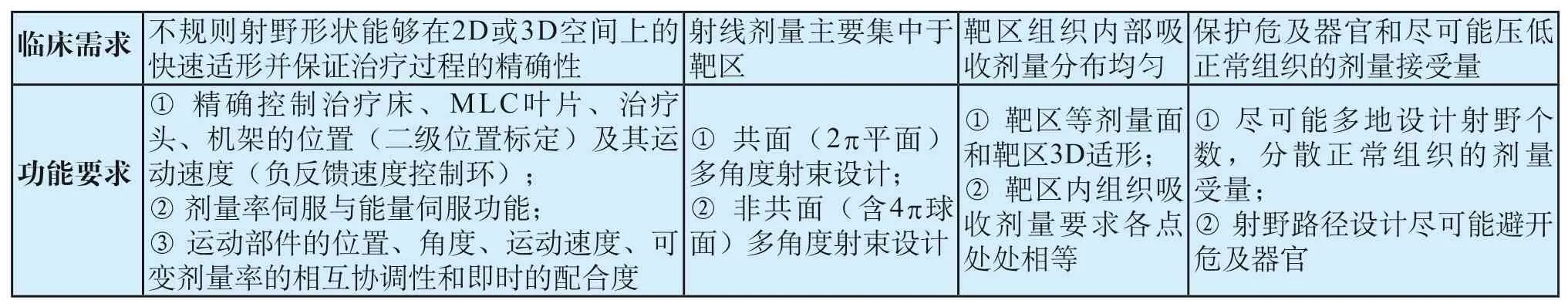
表2 精确放疗的应用需求Tab.2 Application requirements for precision radiotherapy
静态调强是指在照射过程中照射野的形状不变,但在相邻照射野中间改变,其同义词是 Step and Shoot或Stop and Shoot,照射过程中机架角度不变。每次准直器形成一个子野形状,或叫一个分野。各个子野的不同权重的强度分布的相加就得到了所期望的强度分布。静态剂量场强度分布,如图2所示。

图2 静态调强“像束”强度分布Fig.2 "Image beam" intensity distribution for static IMRT
但另一方面,由于静态调强剂量场分布的适形度不足,且治疗时间较长,所以后来就发展出来动态调强技术。在动态调强照射过程中,光栅的适形的形状是不断变化的,其同义词是滑窗(Sliding Window),即在照射过程中机架不动,MLC中每对叶片(一对叶片形成一个缝隙)都朝着一个方向以不同的速度运动,其速度大小是时间的函数。整个过程中叶片位置、叶片速度、输出的MU值和剂量率是相互影响的。所以需要设备具备剂量率伺服功能和光栅叶片位置精确控制能力(速度反馈、位置反馈、加速度反馈)。其剂量场分布,如图3所示。

图3 动态调强的“像束”强度分布Fig.3 "Image beam" intensity distribution for dynamic intensity modulation
从图2和图3可以看出,动态调强和静态调强在剂量场分布上,动态调强的剂量场适形度更细腻。
VMAT 技术是基于调强技术基础上并结合弧形治疗的优势开发出来的、目前兼具良好靶区剂量分布和高速治疗效率的新一代调强方式。它将成百上千的子野分布在1到几个弧上,目前有取代传统静态和动态调强技术的趋势。但是它也是对加速器要求最高的一种调强技术,其要求如下:
(1)机架运动中加入对运动速度和实时角度的精确要求;
(2)动态IMRT与弧形(Arc)治疗相结合,用旋转射束来实现优化的剂量分布;
(3)剂量率、机架速度、MLC叶片位置速度及角度等非均匀可调;
(4)机架围绕病人旋转,MLC叶片位置每隔10o变化一次以便跟随靶区形状。使用多个共面或非共面弧形照射野;
(5)所有弧形照射野的累计通量分布与计划期望的分布一致,达到调强目的。
利用VMAT模式进行放射治疗,理论上比利用动态IMRT进行治疗的速度要快。但是这种治疗速度实际上也受制于加速器剂量率以及部件运动速度的限制。
目前医科达的VMAT功能设备在执行计划时可以改变机架转速,而瓦里安设备更多采用恒定机架速度的方式。相对而言,笔者认为改变机架运动速度是万不得已的方式,毕竟机架的转动惯量太大了,难以保证其可控性和即时性。可以预期,未来更先进的放疗设备也一定是以VMAT技术作为基石继续向前发展的。
1.2.4 影像引导放疗技术的需求和设备的要求
上面提及的所有的临床治疗技术,都是基于肿瘤组织是刚性和固定位置的前提下,但是由于实际上肿瘤组织存在很大的柔性且具备一定的(自我或被动)运动性,且随着治疗的进行,肿瘤的体积和形状也在发生改变,因此,我们必须对肿瘤靶区的定义进行修正,例如引进靶区勾画PTV概念、追求实时靶区跟随放疗、4D时相/呼吸门控放疗以及自适应治疗等临床需求,都是在IGRT条件下对肿瘤基于刚性假定的计划和治疗过程进行修正、补充和优化。
也就是说,IGRT技术的运用是放疗发展史上第二个里程碑,基于人们对精确放疗技术满足了打得狠,但无法确定是不是打得准这一担忧,IGRT开始被开发出来并逐渐进入临床阶段。本质上IGRT追求的是对放疗靶区(实时)可视化监测及其放疗计划的实施和修正。由此,笔者整理出来影像引导放疗的主要应用需求如表3所示。
广义的IGRT其实也包含了多模态影像融合条件下的TPS计划,只是它属于制定准确的放疗计划的临床需求。IGRT技术将影像技术和治疗技术进行了结合,从而定义了医用加速器发展过程中的追求精准放疗的一个维度。加速器本体、精确放疗以及影像引导在临床上发展的权重变迁,可以如图4所示来进行形象展示。
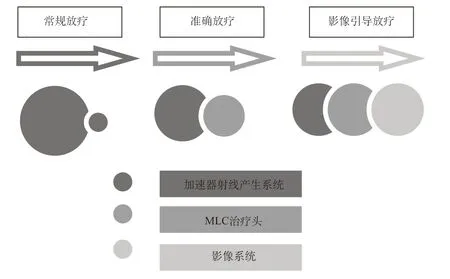
图4 医用直线加速器各部分技术重要性的变迁Fig.4 Changes in the technical importance of various parts of the medical linear accelerator
1.3 对比
在常规放疗时代,以微波器件组成的射线产生装置占据主要地位;精确放疗技术的临床应用大大提升了MLC的地位,尤其动态调强的应用,开始利用MLC 将通过有限的适形野来调节剂量分布变成了通过理论上无限的适形野的共同聚合来调节剂量分布;而影像引导系统的引入则彻底改变了以往临床放疗的盲目性,精确地将靶区的位置、形状、体积的变化呈现在我们的面前,两者结合,将放疗时代导入了一个广阔的高速发展时代。
1.3.1 EPID引导
EPID实际上是一种能够承受MV级高能射线照射的二维X线平板探测器,其图像引导的特点是:
(1)MV射线锥形束成像,软组织图像模糊,只能利用骨骼影像和模拟机系统传过来的图像做配准,主要用于摆位验证;
(2)2D影像(拍片模式);
(3)理论上可任意选择拍片角度,操作简单,成本低、容易实现,既可以离线校正验证射野的大小、形状、位置和患者摆位,也可以直接测量射野内剂量,是一种简单实用的二维影像验证设备。
该模拟过程中常无法直接或完整看到肿瘤侵犯范围,通常需要借助骨、气腔和体轮廓线等标志来间接确立放疗临床靶区。应用该种技术进行放疗模拟定位时存在诸多的问题。主要缺点表现如下:
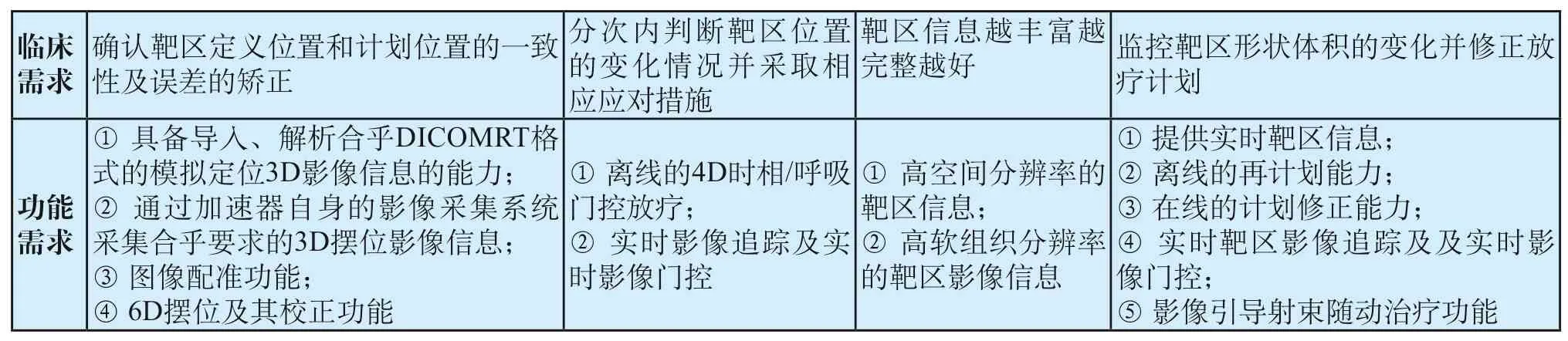
表3 影像引导放疗的应用需求Tab.3 Application requirements for image guided radiotherapy
(1)所获得影像是二维的,前后位影像重叠失去了诸多前后位解剖学信息;
(2)无法勾画出肿瘤和正常组织和器官几何体积;
(3)基本无法进行三维治疗计划设计和剂量分布的显示;
(4)无法与其它来源影像进行融合来共同确定肿瘤的临床靶区。
因此,该种影像用于恶性肿瘤放疗特别是根治性放疗的计划设计中存在很大限制。由于获得该影像经济实惠,影像的整体感强,连续采集能获得动态信息,因此目前该种影像多用于姑息性治疗靶区确定和用于治疗计划设计、实施等方面的验证。
但是,随着技术的发展,基于非晶硅平板探测器的EPID,可以直接测量射野内剂量,是一种快速的二维剂量测量系统,用EPID系统进行剂量学验证的研究开始不断增多,逐渐兴起并推向临床。相信EPID会迎来DGRT的春天。
1.3.2 CBCT图像引导
为了满足在3D方向上得到清晰图像的需求,人们又开发了基于kV射线的CBCT的成像技术。CBCT系统实际上是一个X线系统,动态平板。CBCT获取数据的投照原理和传统扇形扫描CT不同,X线球管以较低的射线量围绕患者做环形DR(数字式投照),获得的图像数据在计算机重建后进而获得三维图像。从成像结构看,CBCT用锥形束X线扫描代替常规诊断CT的扇形束扫描;与此相对应,CBCT采用一种动态平板探测器来代替常规诊断CT的线状探测器。因为数据获取的方式不一样,常规诊断CT的投影数据是一维的,重建后的图像数据是二维的,后处理工作站上的三维图像是连续多个二维切片堆积而成的;CBCT的投影数据是二维的,重建后直接得到三维图像。显然,CBCT采用锥形束X线扫描可以显著提高X线的利用率,只需旋转360o即可获取重建所需的全部原始数据,由于CBCT提供的三维方向上的靶区的图像定位比二维影像准确得多,因此可以说CBCT的出现引领放疗进入了真正的图像引导时代。其特点是:
(1)kV射线锥形束成像,通过软件图像重建,呈现3D影像和DRR图像,即锥形束CT;
(2)可360o旋转,部分设备突破360o;
(3)由于利用的是锥形束和kV平板,射线散射较大,图像清晰度有限;
(4)可以做组织弹性配准,由于器官边缘分辨度不高,精确度有限。但是对于部分组织例如头部等器官,骨骼刚性配准就比较精确;
(5)适合三位配准和二维配准。
缺点是:成像软组织分辨率和空间分辨率均比较差,成像剂量要比常规诊断CT高一个数量级别。
1.3.3 CT引导
从某种程度上来说,CT引导是真正意义上的IGRT。CT影像是组织影像,不仅包含组织器官的位置信息,也包含组织器官的密度信息,因此它不但能够做图像位置定位,还能够利用CT影像对治疗计划进行离线调整。其特点是:
(1)能提供3D和2D图像组织配准;
(2)成像速度快,图像质量好;
(3)具备离线自适应能力:CT不仅能提供靶区位置、体积、结构信息,最主要的是还能够提供组织密度信息,提供放疗计划修正的便利,部分承担CT模拟机的功能。该能力在分次放疗中,可根据肿瘤退缩或周围器官变化做适应性计划优化、修正甚至分次治疗过程中的再计划。
这是CT-linac的最大的优点。
缺点是:CT扫描层面和加速器治疗层面不同面,因此导致通过CT的摆位和定位位置校正确认后,患者还需要挪动位置,挪动后的位置精度无法确认和验证。
1.3.4 双X线系统正交影像引导
这种成像技术把两套kV级X线系统以正交的角度安装,同时对病人进行照射。先在病人体内植入金球或者以病人骨性标记为配准标记。使用治疗室内两个交角安装kV级X线成像系统,等中心投照到患者治疗部位,追踪金属标志的位置变化,或者根据拍摄的低剂量骨骼图像,与先前储存在计算机内的图像进行比对,以便决定肿瘤的正确位置,并将数据输送至控制加速器的计算机中用以控制加速器的工作,从而达到靶区定位的功能。由于X线照射对人体附加了过量剂量,因此在计划中需要对这部分附加剂量予以考虑。
与EPID MV级射线摄野片相比,骨和空气对比度都较高,软组织显像也比较清晰。
自从在放疗进入影像引导时代后,人们就始终无法回避而且需要解决的一个问题,就是怎么样才能“看”着靶区投照射线,并且根据靶区的变化指挥射线进行相应的调整。这不仅要有设备硬件上的提升,还要求软件上一样取得巨大的进步。比如:TPS的在线优化功能(最好是实时优化),而且是多目标的优化,解决靶区由于器官运动产生形变的弹性配准等功能等。
目前来看,以上比较成熟的影像引导技术并不能提供实时成像,而放疗界对精确定位的要求则日益提升,最终希望能够做到“看”着靶来治疗,所以分次内的影像引导技术被提上日程。
但是目前而言:
(1)双X线交叉成像的技术立体成像能力很有限,只能提供几个标记点的位置,无法呈现整个器官的运动图像。
(2)CBCT 对于呈现比较清晰的器官立体图像具有很大的优势,但需要转动一段弧度才可以完成成像过程,无法提供实时影像。
(3)超声成像可以做到实时监测器官运动,但适应症非常有限,目前比较成熟的临床方案是针对前列腺的。而且它作为一个独立的第三方装置,需要和加速器控制进行通讯沟通。
(4)RF 探测技术首先需要在人体的靶区里面植入一些射频信号源,通过体外的探测器收集它们发出的信号来监控靶区的移动情况。
(5)尽管从临床应用的角度来看,CT影像是最接近临床应用需求的,但是它同样不能提供实时影像,因而也无法提供靶区追踪信息。
所以综合来看,目前只有MRI 图像引导技术,向实现真正的、软硬件高度集成配合自适应跟随靶区的放疗技术前进了一大步。
1.3.5 MRI引导
在放疗过程中,靶区组织的位置和结构形状会根据治疗过程、人体应激反应、呼吸、情绪等因素随时间而变动,这就导致了靶区的3D信息是不够的,还需要加入时间因子。4D成像技术就是在3D成像技术的基础上,通过获取运动器官不同时相的图像来判断其最大权重位置,这样可以有效缩小靶区外放的边界,有利于正常组织和危及器官的保护。
然而,无论是EPID还是CBCT或者普通CT引导,目前都做不到实时图像引导放疗。或者是因为成像时间较长,或者是因为成像和治疗过程不同步,或者是因为影像角度与治疗角度存在固有偏差。
这样要实现呼吸门控治疗,一般都是通过以下两种实施:
(1)红外(或超声)监控呼吸幅度;
(2)通过4DCT采集呼吸时相规律然后纳入到治疗计划中。
前者属于间接监控肿瘤靶区随呼吸的运动,误差较大;后者则是将靶区随呼吸运动的变化抽象化和简单化,没有考虑靶区随呼吸运动的频率及幅度在不同时间和条件下会有不同呈现的复杂性。
就目前而言,只有MRI有机会提供这一种实时成像的可能。
同时,由于MRI是一容积性影像采集装置,能获得高空间分辨率和高对比度在任意层面和方向的解剖影像,尤其是对于确定头颈、中枢神经、脊髓和软组织等部位肿瘤临床靶区有极大帮助。
由于MRI成像取决于物质的质子密度、T1加权、T2加权和血管流空效应。因而MRI较CT影像含有丰富的信息,而且磁共振检测序列的选择和优化可有效地提高肿瘤与周边正常组织的区分能力。因而MRI是显示组织密度对比差异小的区域如头颈、中枢神经、脊髓、软组织、宫颈、前列腺以及骨转移处肿瘤临床靶区的一种重要手段。
和CT等不同,MRI可以通过梯度场的变化提供任意方向的2D图像,且图像的成像速度快,1帧不超过10 ms,这就相当于实时影像了,目前这种2D图像主要用于门控系统,实际上放疗呼吸门控或跟踪要求时间尺度是300 ms(约0.1个呼吸周期),这包括图像采集、重建靶区、勾画(判断)、开关射线,这样图像重复率至少需要4 ftps,图像延迟不超过100 ms,MRI完全满足这种需要。
MRI引导的优点:
(1)无附加剂量,软组织对比度高,可以进行治疗中引导;
(2)实时 MRI引导软组织摆位和在线剂量预测:病人每日治疗的摆位可直接利用 MRI 影像针对靶区位置做定位,让对位更精准,并且病人在治疗床上,能利用门卡预测当前放疗将要投递的剂量;
(3)术中适应性放射治疗(on-table Adaptive RT):在分次放疗中,根据肿瘤退缩或周围器官变化做在线适应性计划优化。
直接使用MRI图像进行物理剂量计算存在困难:MRI上的像素量与物质内质子有关而与核外的电子密度不相关,因而无法直接利用磁场信号进行物理剂量的计算。解决此问题办法有两个:一是将MRI影像融合叠加到CT影像上,用MRI和CT影像进行靶区的勾画,用CT影像中CT值进行物理剂量计算;另一方法是通过数学模型将磁共振信号转变成电子密度用于剂量的计算。
(4)治疗中实时追踪肿瘤(Real-Time Tracking)与门控:治疗全程连续造影,系统透过软组织追踪和自动化的射线控制,当肿瘤组织移动超过医师定义的追踪界限,射线会自动暂停照射,当靶区移回界线内的范围,治疗会自动恢复。
当然仅仅能够看到靶区运动是不够的,临床需要在看到后能够有下一步的动作,目前能够做到的就是在靶区移出计划范围后中止射线,即影像门控。但更吸引人的方案是射束能够做出实时跟踪调整,即射线实时跟踪靶区(tracking)。目前给出的方法一个是通过移动床来弥补位置上的偏差,但这个方案只是处于大学实验室研究阶段,而且涉及移动患者使之有不舒适感。另一个可能更快用于临床治疗的方案是MLC叶片修正,即用MLC叶片的位置来补偿器官移动或形变引起的偏差。这两个方案无论是哪个,都涉及到以下事项:
(1)计划的实时调整;
(2)谁来对调整后的计划进行确认。
实时射线跟踪技术需要图像引导和加速器的无缝配合才可达成,需要控制系统的高度集成,目前的主流加速器的控制架构都需要做出较大的改进和提升。迄今为止两个主要供应商都还没能在这个方向上做出重大突破。
1.4 影像引导放疗技术要求对设备一体化设计
总之,以上这些影像引导技术的主要目的其实还在于对靶区(位置、体积、形状)的再确认,用于纠正放疗过程中的变化、误差或人为错误。笔者不认为自适应(包含靶区追踪)等技术是一个独立的技术发展维度,总体上它是在影像引导下,对原有立足于刚性靶区前提下发展起来的临床技术IMRT等在应用上的一个补充和修正。IGRT的技术开发在精确放疗之后,这主要源于人们非常担心精确放疗万一打偏了而会产生的巨大负面后果,因此从需求的角度考虑理应包含影像引导条件下的放疗过程的修正(靶区追踪、射线控制和跟随)。当然要完全达到这样的水平还需要设备的更大进步,但毫无疑问,目前精确调强技术和IGRT已经组成了现代放疗的主要内容,我们所做的一切都在围绕着它们进行技术基础的夯实以及进一步的完善和提升。
以下内容请关注:医用加速器差异化设计思想的探讨(下)
