不同剂量阿帕替尼联合经动脉化疗栓塞治疗中晚期原发性肝癌的临床效果及安全性
2020-04-09吴培生罗永香陈斯欢
吴培生 罗永香 陈斯欢
(广西钦州市第一人民医院普外科,钦州市 535000,电子邮箱:wupeisheng1688@163.com)
肝癌是一种恶性程度极高的肿瘤,发病率高、预后差,严重威胁人类身体健康[1]。肝癌起病隐匿,许多患者通常在首诊时已进入中晚期或者已出现转移,丧失了手术治疗的机会[2],而更多是选用经动脉化疗栓塞(transarterial chemoembolization,TACE)、放疗或者分子靶向药物(如贝伐单抗和阿帕替尼等)等治疗方式[3]。其中,TACE是中晚期肝癌患者最常用的介入疗法,其可以通过栓塞血管阻断肿瘤的动脉供血,同时能够输送并释放化疗药物。这种局部灌注化疗药物的方法,不仅能够提高肿瘤区的药物浓度,还降低了外周血浆内的化疗药物浓度及不良反应[4-5]。研究表明,TACE能够延长肝癌患者的生存期,但是对于延缓肿瘤进展和改善预后的效果欠佳;而栓塞不彻底、肿瘤侧支循环的建立通常会导致肿瘤残存或发生转移,影响TACE的中远期疗效[6]。研究发现,TACE通过栓塞肿瘤供血血管,不仅可导致肿瘤区缺血缺氧,还可能诱发低氧诱导因子1α、血管内皮生长因子(vascular endothelial growth factor,VEGF)等高表达,进而诱发下游相关信号通路转导,引起肿瘤复发,而这些信号通路即为分子靶向药物的治疗靶点[7]。因此,为了提高TACE治疗效率,目前许多研究都集中在分子靶向药联合TACE治疗。多激酶抑制剂联合TACE治疗可以提高中晚期肝癌患者的总生存时间,一项Meta分析显示,阿帕替尼联合TACE治疗明显延长了中晚期肝癌患者的中位无进展生存期[8]。但是联合治疗的最终效果与剂量的关系,以及临床用药安全性,还需要更多的临床试验来验证。本研究通过比较不同剂量阿帕替尼联合TACE与单独TACE治疗中晚期肝癌的临床疗效,为肝癌的临床治疗提供参考依据。
1 资料与方法
1.1 临床资料 回顾性分析2014年1月至2015年12月在我院诊治的90例中晚期肝癌患者的临床资料。纳入标准:(1)肿瘤标志物甲胎蛋白、影像学检查(CT/MRI)及穿刺活检病理诊断均诊断为原发性肝癌;(2)确诊为巴塞罗那分期为B期或C期;(3)肝功能Child-Pugh分级为A级或B级,Karnofsky评分>65分,同时预计生存期大于4个月;(4)确诊前未接受手术或其他形式的治疗。(5)患者全身皮肤完整,无溃疡或发炎等情况。排除标准:(1)心肺功能、肝功能不全患者;(2)伴有远处转移患者;(3)严重高血压患者;(4)对阿帕替尼过敏患者;(5)合并门静脉癌栓患者。根据治疗方法将患者分为观察Ⅰ组、观察Ⅱ组、对照组各30例,3组患者的一般资料差异均无统计学意义(均P>0.05),具有可比性,见表1。
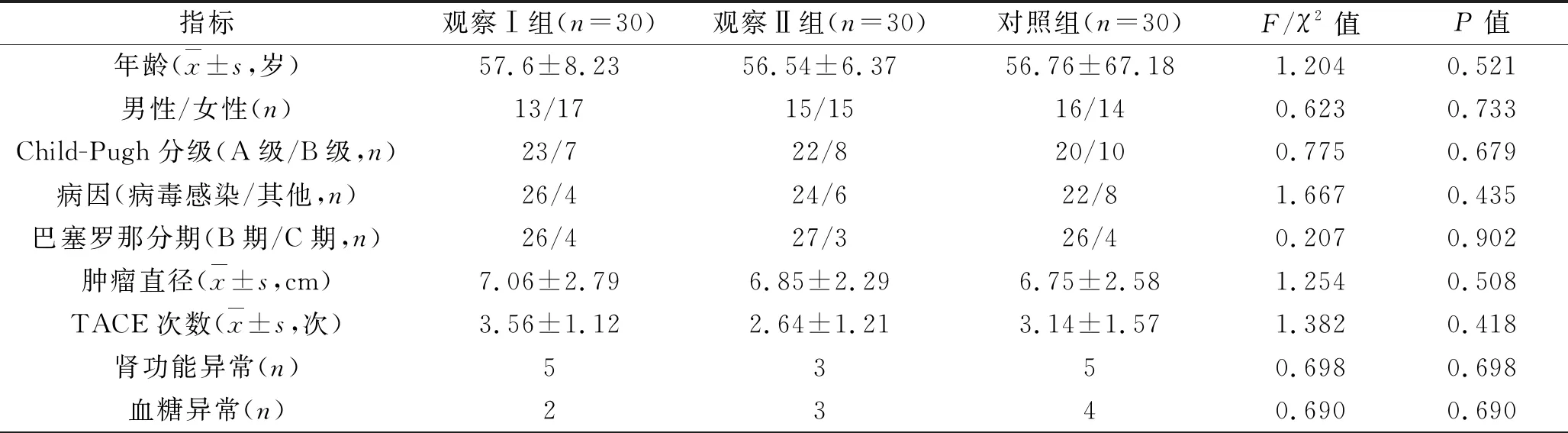
表1 3组患者一般资料比较
1.2 治疗方法 所有患者均行TACE治疗,经股动脉穿刺插管成功后,采用Selding穿刺法,经皮-股动脉穿刺成功后插入导管超选至肿瘤供血血管,灌注洛铂(海南长安国际制药有限公司,国药准字H20080359)50 mg和雷替曲塞4 mg(南京正大天晴制药有限公司,国药准字H20090325)进行栓塞。术后卧床24 h,常规给予止吐、保肝和营养支持等对症治疗。观察组在TACE治疗后5 d给予阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20170328)口服,观察Ⅰ组、观察Ⅱ组给药量分别为550 mg/次和300 mg/次,均为1次/d,连续给药至疾病进展或不可耐受。
1.3 观察指标 (1)缓解情况:所有患者在治疗开始后的第1、6、12个月进行复查,复查项目包括增强CT、MRI、肝肾功能,根据实体瘤的疗效评价标准对肿瘤缓解情况进行疗效评价:完全缓解,即靶病灶完全消失且持续1个月以上;部分缓解,即靶病灶的直径总和较基线水平减少不低于30%;稳定,即靶病灶的直径缩小既未达到部分缓解标准,增大程度亦未达到疾病进展的标准,即相较基线水平缩小<30%或增大<20%;疾病进展,即靶病灶直径较原始水平增大不低于20%,或有新生病灶。客观缓解率(objective response rate,ORR)=(完全缓解+部分缓解)例数/总病例数×100%。(2)无进展生存情况:以首次治疗作为观察起点,患者出现疾病进展或末次随访时间为观察截点,截止日期为2018年8月1日,随访率达100%。计算无进展生存期,即患者从开始治疗到确定为疾病进展或死亡的时间。(3)不良反应:记录随访期间不良反应发生情况,包括高血压、蛋白尿、手足综合征、胃肠道反应、出血、发热、皮疹等。
1.4 统计学分析 采用SPSS 21.0分析软件进行统计分析。计量资料采用(x±s)表示,组间比较采用方差分析;计数资料以例数(百分比)表示,组间比较采用χ2检验;采用Kaplan-Meier 法计算中位无进展生存期,并绘制生存曲线,组间比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者ORR比较 治疗后1个月,3组间ORR差异无统计学意义(P>0.05);治疗后6、12个月,3组的ORR差异有统计学意义(均P<0.05),其中观察Ⅰ组及观察Ⅱ组的ORR均高于对照组(均P<0.05),而观察Ⅰ组及观察Ⅱ组的ORR差异无统计学意义(P>0.05)。见表2。

表2 3组患者肿瘤缓解情况比较[n(%)]
2.2 3组患者无进展生存期比较 对照组、观察Ⅰ组和观察Ⅱ组间的中位无进展生存期分别为7.2个月、20.2个月、18.4个月,观察Ⅰ组的中位无进展生存期长于观察Ⅱ组,但差异无统计学意义(χ2=1.147,P=0.186),观察Ⅰ组及观察Ⅱ组的中位无进展生存期均长于对照组(χ2=6.508,P=0.021;χ2=5.224,P=0.031)。 见图1。
2.3 3组患者不良反应发生率比较 3组患者随访期间发热、皮疹、恶心呕吐等发生率比较,差异均无统计学意义(均P>0.05);观察Ⅰ组及观察Ⅱ组的血压升高、手足反应、蛋白尿、腹泻的发生率均高于对照组(均P<0.05),但观察Ⅰ组与观察Ⅱ组间差异无统计学意义(均P>0.05)。见表3。
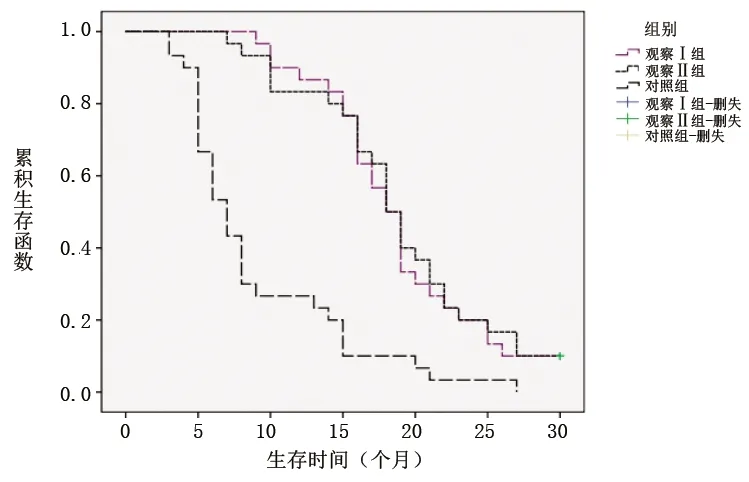
图1 3组无进展生存期生存曲线
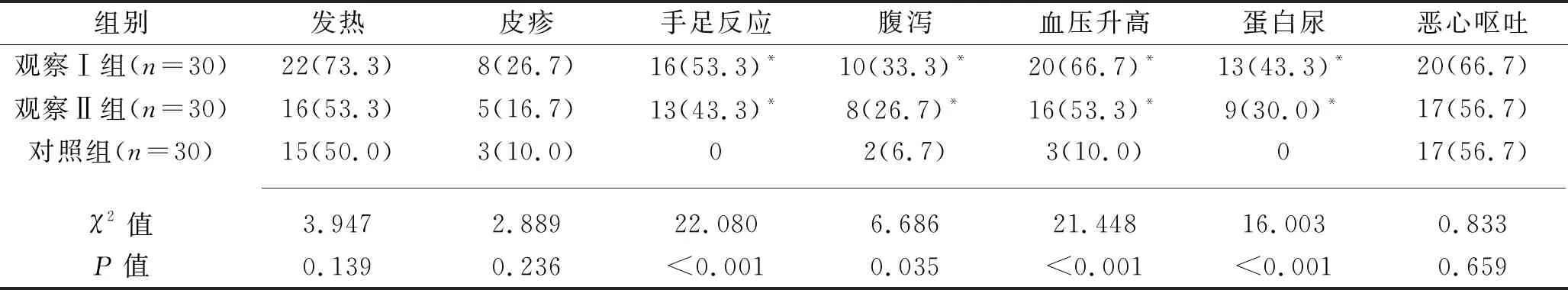
表3 3组患者不良反应发生率比较[n(%)]
3 讨 论
目前,TACE是临床上中晚期原发性肝癌患者的首选治疗方案[9-10]。TACE 具有微创、术后恢复及时等优点,并且能通过提高肿瘤区的给药浓度提高治疗效率[11]。但是,由于栓塞材料和操作的限制,无法完全达到对肿瘤的完全栓塞,中远期疗效不理想。有研究显示,TACE术后患者的中位生存期为34个月,而5年的生存率仅26%[12]。术后新生肿瘤血管的侧支循环形成是肿瘤复发的重要因素之一,VEGF及其受体介导的信号通路是调控血管生成的重要因素,其中VEGF-2是影响肝癌复发的重要因子[13]。栓塞血管后由于血管微环境缺氧使得VEGF高表达,这提示TACE联合VEGF抑制剂或可以阻止肿瘤血管新生,从而达到预防癌症复发的目的。武健等[6]研究发现,在与单纯 TACE治疗相比,阿帕替尼联合TACE治疗中晚期原发性肝癌可获得更好的中远期疗效。但是在大多数研究中[14-16],并没有针对阿帕替尼临床用药剂量的研究。因此,本研究设立两个不同剂量阿帕替尼联合TACE的观察组,探讨两者的疗效差异。
本研究结果显示,观察Ⅰ组和观察Ⅱ组患者在TACE术后分别服用550 mg/次、300 mg/次的阿帕替尼,两组治疗后6个月和12个月的ORR、中位生存期均优于对照组(P<0.05),提示中晚期原发性肝癌患者TACE术后服用阿帕替尼可获得更好的中远期疗效。但是,两个观察组之间ORR、中位生存期差异均无统计学意义(均P>0.05),这可能与酶结合位点的有限性有关。阿帕替尼体内作用机制是高度选择性竞争VEGF-2的三磷酸腺苷结合位点,一旦与位点结合,酶的活性中心不能再结合底物,致使阿帕替尼无法再与其结合。这提示阿帕替尼可能存在有效抑制浓度恒定的现象,即在低底物浓度时抑制作用明显,但浓度增大并不会改变抑制作用。本研究中,两个观察组的血压升高、手足反应、蛋白尿、腹泻的发生率高于对照组(均P<0.05)。高血压是阿帕替尼相关不良反应,其原因是一氧化氮生物利用度降低后导致内皮功能障碍,给予药物干预可恢复正常[17-19]。研究表明,手足皮肤反应等皮肤毒性是接受抗VEGF抗体药物治疗的主要副作用,治疗结束后副作用消失[20]。
综上所述,与单纯TACE相比,TACE术后联合阿帕替尼治疗中晚期原发性肝癌的中远期疗效更佳,且与阿帕替尼剂量可能关系不大。然而本研究纳入的样本数较少,是为回顾性研究,仍需更大样本的前瞻性研究来进一步证实所得结论。
