多层螺旋CT 对胃神经鞘瘤与胃间质瘤的鉴别诊断价值
2020-04-09马菊香韩军利李绪斌叶兆祥
马菊香 韩军利 李绪斌 叶兆祥
胃间质瘤(gastrointestinal stromal tumor,GIST)和胃神经鞘瘤(gastric schwannoma,GS)都是来源于胃黏膜下间叶组织的肿瘤,GIST 是最常见的胃间叶组织肿瘤,约占胃部肿瘤的2.2%,即使肿瘤很小也可能具有潜在恶性[1]。GS 临床非常罕见,约占胃部肿瘤的0.2%,多为良性肿瘤,很少出现复发和转移[2]。直径≤10 cm 的GS 和GIST 临床及影像表现极其相似,GS 常被误诊为GIST。 两者术前鉴别诊断对临床治疗及术后随访非常重要。 多层螺旋CT 平扫和增强检查能较好地反映肿瘤形态学及血供特点, 为肿瘤鉴别诊断提供重要依据。 目前有关CT 鉴别诊断两种肿瘤的文献报道较少, 且已报道的研究中样本量亦较少。本研究回顾性分析经手术病理证实的GS和GIST 病人的临床和CT 影像资料,以期提高术前鉴别两者的准确性。
1 资料与方法
1.1 临床资料 回顾性收集2012 年7 月—2019 年5 月于天津医科大学肿瘤医院经手术病理证实为GS 和GIST 的病人共157 例,包括GS 31 例,表现为腹部不适、腹痛、腹胀18 例,胃肠道出血3 例,恶心、呕吐2 例,体检发现8 例;GIST 126 例,表现为腹部不适、腹痛、腹胀59 例,胃肠道出血37 例,纳差5 例,后背部疼痛3 例,体检发现22 例。 所有病例均为单发。 纳入标准:①病理学诊断为GIST 和GS;②肿瘤直径≤10 cm;③有完整临床和CT 影像资料。排除标准:①术前行新辅助治疗的GIST;②术前CT 影像资料不是本院的;③仅行CT 平扫或CT 增强检查。
1.2 设备与方法 采用GE Light Speed 64 层螺旋CT 行平扫和增强扫描。检查前病人空腹8 h,并于扫描前饮水800~1 000 mL 充盈胃部。 病人取仰卧位,扫描范围从膈顶至肝脏下缘。 扫描参数: 管电压120 kV,自动管电流调节技术(50~300 mA),层厚、层间距及重建厚度均为1.5 mm, 螺矩0.984∶1,旋转时间0.7 s/r,视野36 cm×36 cm,矩阵512×512。 增强检查采用高压注射器经肘前静脉注射碘海醇(含碘300 mg/mL,GE 公司),注射剂量1.5 mL/kg 体质量, 注射流率为3.0 mL/s, 分别于注射后25~30 s、50~60 s、120 s 进行动脉期、静脉期及平衡期扫描。
1.3 影像分析 由1 名从事影像诊断工作5 年的住院医师和1 名工作10 年以上的副主任医师在不知病理类型的情况下分别独立阅片, 意见不同时通过讨论达成一致。 分析肿瘤CT 特征:部位(贲门、胃底、胃小弯、胃大弯或胃窦),大小(肿瘤最大径),形态(圆形或椭圆形视为规则,分叶状或其他不规则形视为不规则),边界(清楚、不清),生长方式(腔内型、腔外型或腔内外型), 强化程度(依据平衡期的CT值-平扫的CT 值确定, 该差值<20 HU 时为轻度强化,20~40 HU 为中度强化,>40 HU 为明显强化),有无囊变坏死、溃疡、钙化以及肿瘤周围脂肪间隙是否伴淋巴结(短径≥5 mm)。 分别测量肿瘤平扫、动脉期及静脉期CT 值,兴趣区(ROI)选取时应尽量避开钙化、囊变坏死、出血等部位,CT 值测量3 次,取其平均值。 计算肿瘤各期强化幅度, 动脉期强化幅度(DE1)=CT 值动脉期-CT 值平扫; 静脉期较动脉期强化幅度(DE2)=CT 值静脉期-CT 值动脉期;静脉期强化幅度(DE3)=CT 值静脉期-CT 值平扫。
1.4 统计学分析 采用SPSS 23.0 统计软件对数据进行分析。 非正态分布的计量资料以中位数和四分 位 距[M(P25,P75)]表 示,2 组 间 比 较 采 用Mann-Whitney U 检验。 计数资料以例(%)表示,2 组间比较采用χ2检验。 将差异有统计学意义的变量纳入Logistic 回归进行多因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组病人基本资料比较 GS 组和GIST 组病人性别差异有统计学意义(P<0.05),GS 病人中以女性多见,2 组病人年龄差异无统计学意义(P>0.05),见表1。
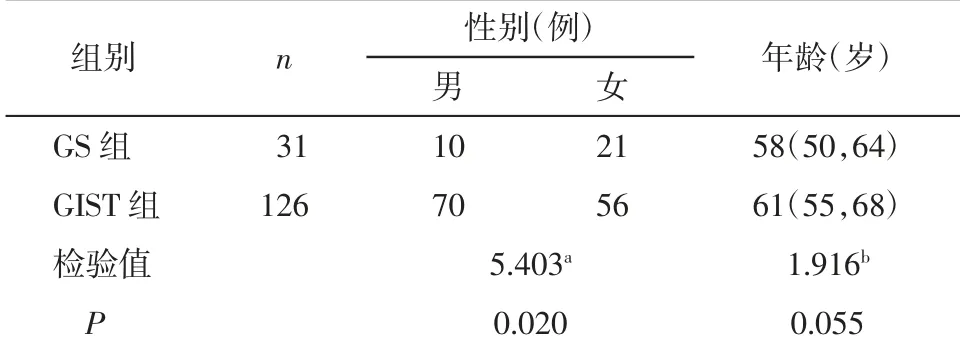
表1 GS 和GIST 病人基本情况比较
2.2 2 组肿瘤CT 特征的比较 GS 组和GIST 组肿瘤发生部位、形态、边界、生长方式、囊变坏死和周围脂肪间隙是否伴淋巴结的差异均有统计学意义(均P<0.05),肿瘤大小、强化程度及是否伴溃疡、钙化的差异均无统计学意义(均P>0.05),见表2 及图1-4。
2.3 2 组肿瘤CT 平扫及强化特点比较 GS 组和GIST 组肿瘤CT 平扫、动脉期、静脉期的CT 值以及肿瘤DE1、DE2、DE3 差异均无统计学意义 (均P>0.05),见表3。
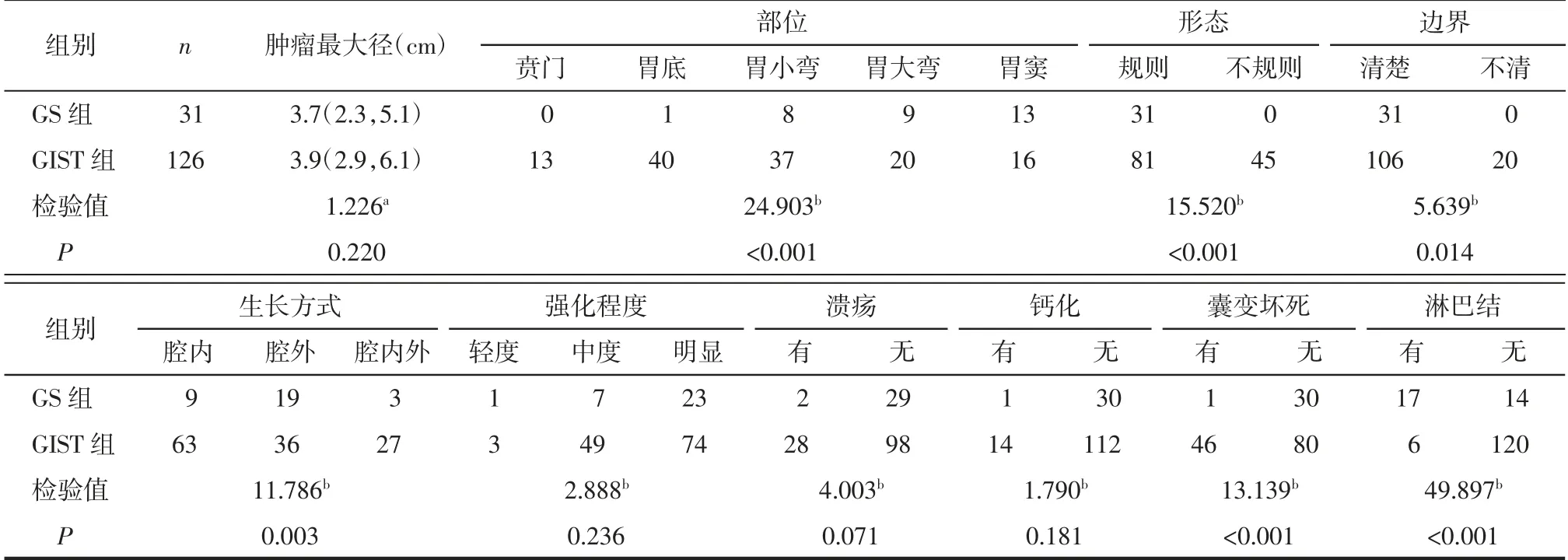
表2 2 组肿瘤CT 特征比较
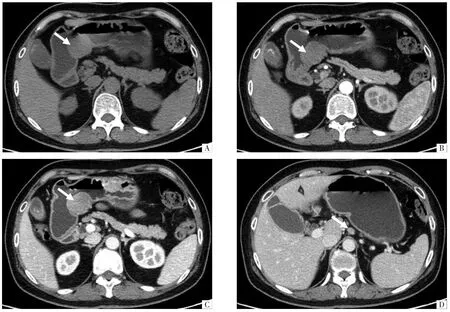
图1 GS 病人,女性,54 岁。 A 图,CT 平扫示胃窦部软组织肿物,形态规则,边界清楚,呈腔外生长,最大径3.7 cm(箭头);增强扫描后动脉期(B)及静脉期(C)可见肿物明显均匀强化(箭头);D 图,肝胃韧带区见淋巴结(箭头)。 平扫、动脉期、静脉期CT 值分别为44、54、88 HU。
2.4 多因素Logistic 回归分析 肿瘤发生部位和周围脂肪间隙伴淋巴结是多层螺旋CT 鉴别GS 与GIST 的预测因素(P<0.05),见表4。
3 讨论
GS 起源于胃壁肌间Auerbach’s 神经丛神经鞘Schwann 细胞,是一种生长缓慢的神经源性肿瘤,恶性者罕见[4],而GIST 具有潜在恶性,可经血行或种植转移,两者在手术选择、术后辅助治疗、预后及随访等方面有较大差别[3-4],因而鉴别两者至关重要。
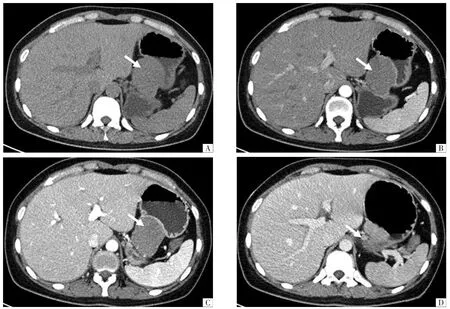
图2 GS 病人,女性,40 岁。 A 图,CT 平扫示胃体小弯侧软组织肿物,形态规则,边界清楚,呈腔外生长,最大径5.1 cm(箭头);增强扫描后动脉期(B)及静脉期(C)可见肿物明显均匀强化(箭头);D 图,肝胃韧带区见淋巴结(箭头)。 平扫、动脉期、静脉期CT 值分别为35、49、70 HU。

图3 GIST 病人,女性,50 岁。 A 图,CT 平扫示胃体小弯侧软组织肿物,形态不规则,边界不清,呈腔内外生长,最大径9.5 cm(箭头);增强扫描后动脉期(B)及静脉期(C)可见肿物明显不均匀强化,内有囊变坏死区(箭头)。 平扫、动脉期、静脉期CT 值分别为33、40、62 HU。
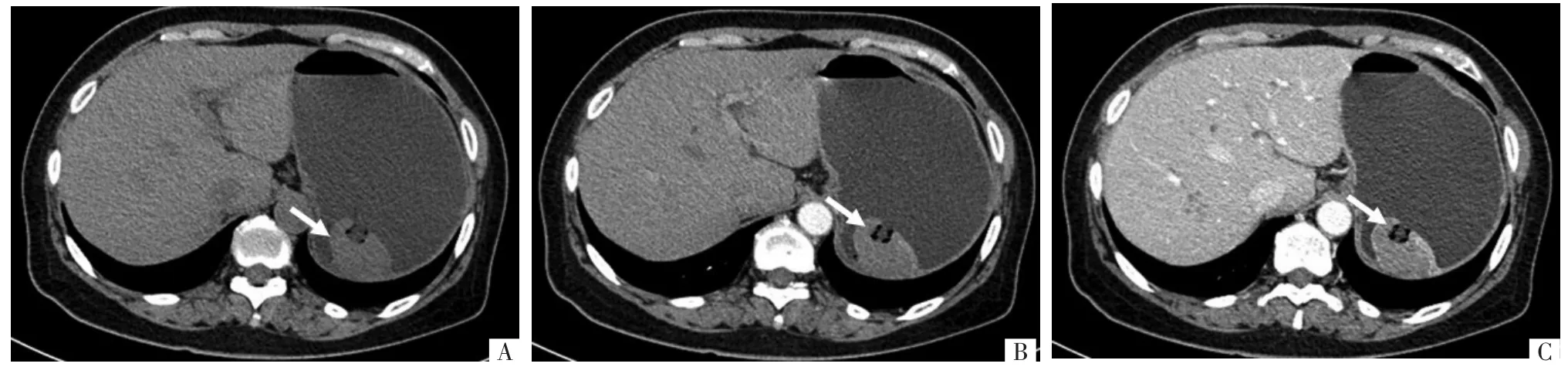
图4 GIST 病人,女性,50 岁。 A 图,CT 平扫示胃底软组织肿物,形态规则,边界清楚,呈腔内生长,最大径3.8 cm(箭头);增强扫描后动脉期(B)及静脉期(C)可见肿物明显均匀强化,表面有溃疡(箭头)。 平扫、动脉期、静脉期CT 值分别为20、36、61 HU。
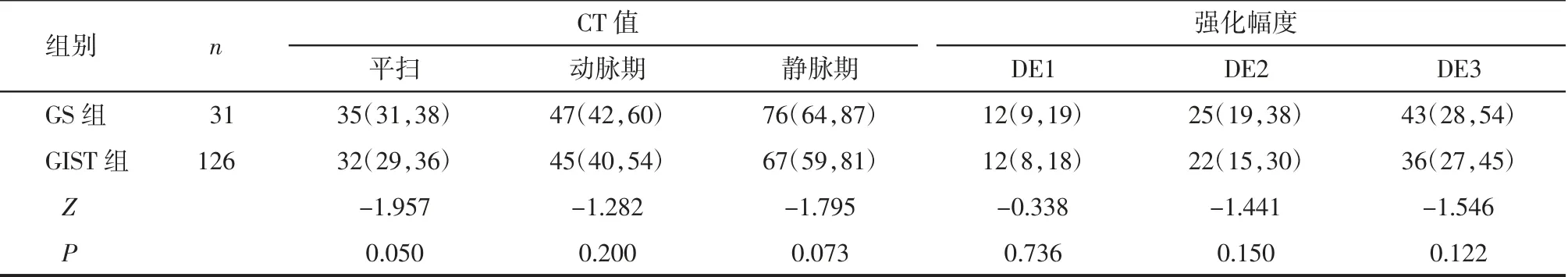
表3 2 组肿瘤CT 平扫及强化特点比较HU
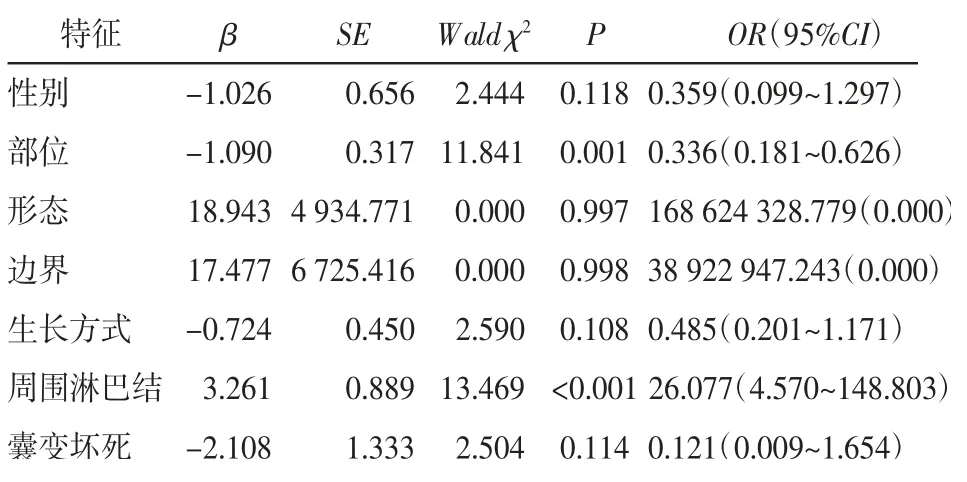
表4 GS 和GIST 特征的多因素Logistic 回归分析
3.1 临床表现 GS 和GIST 病人临床表现无特异性,常表现为腹痛、腹胀,部分GIST 病人可表现为胃肠道出血,有的是在体检时发现,术前诊断及鉴别诊断主要依据影像检查[3,5]。本研究中GS 和GIST 病人年龄差异无统计学意义,这与王等[6]报道的研究结果一致。 有研究[7-8]报道GS 女性病人多于男性,GIST 病人男女比例相近,本研究结果与此报道相符。
3.2 CT 表现
3.2.1 肿瘤发生部位、形态、边界、生长方式 有研究[9-10]显示GS 好发于胃体部,且多发生于大弯侧,其次为胃窦;GIST 多发生于胃体及胃底。 本组31 例GS 17 例来源于胃体,其中9 例发生于胃大弯,其次13 例发生于胃窦;126 例GIST 57 例来源于胃体,40例来源于胃底,2 组肿瘤发生部位差异有统计学意义,与文献[9-10]报道结果基本相符。有研究者[11-12]报道GS 多为良性肿瘤,侵袭性低,肿瘤生长缓慢,多呈圆形或类圆形,无分叶,肿瘤边界清楚;GIST 多形态规则、边界清楚,而部分体积大、侵袭性高者,其形态不规则、边界不清,据此有助于GIST 诊断。GS 和GIST都是来源于胃黏膜下的实体肿瘤, 根据其生长方式分为腔内型、腔外型或腔内外型。 Li 等[11]研究发现,GS 主要呈腔外生长,而GIST 多呈腔内生长,其次是腔外。本研究中GS 多呈腔外生长(19 例),其次为腔内生长(9 例), 腔内外生长极其少见;126 例GIST中半数病例呈腔内生长, 余者呈腔外生长和腔内外生长。2 种肿瘤生长方式的差异有统计学意义,提示肿瘤生长方式对两者的鉴别诊断有一定参考价值。
3.2.2 肿瘤溃疡、囊变坏死、钙化 Choi 等[13]报道GS 不会出现退行性改变,肿瘤细胞生长速度及新生血管形成速度较慢,肿瘤不易发生钙化、溃疡和囊变坏死;GIST 具有恶性潜能,肿瘤生长快,当肿瘤新生血管速度达不到肿瘤生长速度时,肿瘤内血供不足,容易导致肿瘤细胞缺血坏死, 从而肿瘤内发生囊变坏死。 部分GIST 瘤腔内隆起的表面会出现“凹陷”的溃疡, 这可能与肿瘤表面黏膜局部缺血对胃酸的耐受力下降有关[14]。 Li 等[11]研究还表明GIST 发生囊变坏死较多,而GS 很少发生,因而肿瘤内伴囊变坏死有助于鉴别诊断GIST;对无囊变坏死的GIST,依据病人性别及不同CT 征象也可辅助鉴别。 本组31例GS 中2 例伴溃疡,1 例伴囊变坏死,1 例伴钙化;126 例GIST 中伴囊变坏死的多达46 例, 其次为伴溃疡和伴钙化的病例。 2 种肿瘤内有囊变坏死的差异有统计学意义, 表明囊变坏死这一征象有助于两者的鉴别诊断, 而2 种肿瘤内是否伴钙化及溃疡的差异无统计学意义。 本研究结果与Li 等[11]研究结果基本相符。 还有一些研究[15-17]发现,随着GIST 危险度增高,肿瘤囊变坏死发生率增高。
3.2.3 肿瘤周围脂肪间隙伴淋巴结、肿瘤大小、强化程度 GS 内含有大量炎性细胞,肿瘤边缘有淋巴细胞反应带,周边可见淋巴细胞增生形成淋巴细胞套,甚至形成生发中心,可刺激肿瘤周围淋巴结增生,肿瘤周围常伴增大淋巴结;GIST 主要经血行转移,虽然肿瘤可以生长很大,但很少发生周围组织浸润,通常转移复发的部位在肿瘤局部或肝脏, 而周围淋巴结转移很少见[13,18-19]。 本组31 例GS 中17 例周围脂肪间隙伴淋巴结,126 例GIST 中6 例伴淋巴结,这与上述研究[13,18-19]的结果基本一致。本研究中2 组肿瘤的周围脂肪间隙伴淋巴结的差异有统计学意义,提示出现肿瘤周围脂肪间隙伴淋巴结更倾向于诊断GS。 有研究[14,20]报道GS 大多≤10 cm,10 cm 以上者极其少见,而GIST 最大径可从1~30 cm 不等,肿瘤越大,危险度越高、侵袭性越强;≤10 cm 的GIST 恶性度相对低, 因而≤10 cm 的GS 和GIST 依据肿瘤大小鉴别两者价值不大。Li 等[11]研究表明,强化程度对GS 和GIST 的鉴别诊断有重要意义,然而本研究中GS 和GIST 的强化程度差异无统计学意义,这点与Choi 等[13]研究结果一致。 肿瘤强化程度这一特征对鉴别GS 和GIST 是否有价值,目前不同研究中的结论并不一致,后续还需收集更多病例进行研究。
3.3 CT 测量值 本研究中2 组肿瘤平扫、 动静脉期增强CT 值及各期强化幅度差异均无统计学意义,这主要是由于GS 和GIST 都来源于胃黏膜下的间叶组织,而且肿瘤血供丰富,使增强扫描后2 种肿瘤均多呈中度和/或明显强化,因此其强化特点也很相近, 可见肿瘤CT 测量值及不同强化幅度在两者鉴别诊断中无明显意义。
3.4 多因素Logistic 回归分析 本研究单因素分析结果显示多项CT 特征及临床资料可以鉴别GS 和GIST,多因素Logistics 回归分析结果表明,肿瘤发生部位和周围间隙伴淋巴结对鉴别两者有重要意义, 提示我们临床诊断工作中更应重点关注这两种征象。
本研究尚存在一定局限性: ①本研究为回顾性研究,不排除在数据分析中存在一定偏倚;②本研究是针对≤10 cm 的2 组肿瘤进行鉴别诊断, 对不同风险度GIST 与GS 的鉴别未进行分析; ③由于GS罕见, 本研究中纳入GS 和GIST 的病例数不对等,后续研究需增加GS 病例数以利于进行更多的前瞻性、多中心研究。
综上所述,病人性别,肿瘤发生部位、形态、边界、生长方式、囊变坏死及周围脂肪间隙是否伴淋巴结在GS 和GIST 的鉴别诊断中有重要意义;肿瘤大小、强化程度、溃疡、钙化及各组CT 测量值、不同强化幅度对两者的鉴别价值不大。 多因素Logsitic 回归进一步分析显示, 肿瘤发生部位及周围脂肪间隙是否伴淋巴结是鉴别诊断GS 和GIST 的2 个重要预测因素。 当肿瘤发生于胃体或胃窦, 肿瘤周围脂肪间隙伴淋巴结时更倾向于诊断为GS。 总之,应用多层螺旋CT 结合临床资料有助于术前鉴别GS 和GIST,能为临床决策提供一定的参考。
