重组人血管内皮抑制素联合SOX 方案治疗晚期结直肠癌患者疗效及肿瘤标志物水平变化的观察
2020-04-09薛凌飞雷彬花
薛凌飞 雷彬花
(河南省三门峡市中心医院肿瘤科,河南 三门峡 472000)
结直肠癌(colorectal cancer,CRC)发病隐匿,早期无典型症状,容易漏诊。化疗为临床治疗晚期CRC 的主要方法,其中SOX 一线化疗方案由替吉奥+奥沙利铂组成,对部分患者可有效杀灭肿瘤细胞,但仍有部分患者获益不佳[1]。重组人血管内皮抑制素具有抑制肿瘤细胞增殖、转移的作用。本研究中对86 例晚期CRC 患者采用重组人血管内皮抑制素联合SOX 一线化疗方案治疗,观察其疗效及血管内皮生长因子(VEGF)和肿瘤标志物水平的变化,报告如下。
1 病例与方法
1.1 病例 2015 年5 月—2017 年9 月在我院初诊并收治的晚期CRC 患者86 例,均经病理学诊断确诊为CRC,临床分期[2]Ⅲ~Ⅳ期;卡氏(KPS)评分≥70 分;对本研究药物无使用禁忌证;意识清晰,无沟通交流障碍;患者及家属已签署知情同意书。排除合并其他原发恶性肿瘤者,心、脑、肝、肾等重要脏器严重病变者,预估生存期≤3 个月者,不能配合完成研究者。根据分层随机抽样法和对照设计原则将患者分为对照组和研究组各43 例,两组性别、年龄、临床分期、病理类型、KPS 评分等一般资料比较,差异无显著性(P>0.05),见表1。本研究经我院伦理委员会审批通过。
1.2 治疗方法 两组患者均以21 d 为1 个化疗周期,至少完成3 个周期化疗,再根据效果决定再次化疗时间。
1.2.1 对照组 采用SOX 一线化疗方案:第1 天奥沙利铂(海南锦瑞制药有限公司,国药准字H20143024)130 mg/m2静脉滴注,第1 ~14 天替吉奥胶囊(江苏恒瑞医药股份有限公司,国药准字H20113281)40 mg/m2口服。
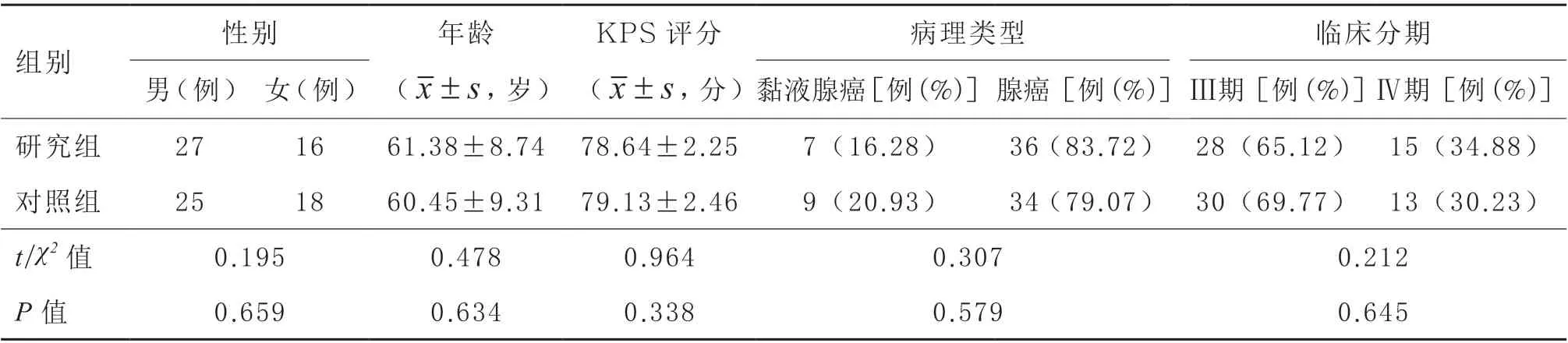
表1 两组一般资料比较(n=43)
1.2.2 研究组 在对照组SOX 一线化疗方案治疗的基础上,于第1 ~14 天给予重组人血管内皮抑制素(山东先声生物制药有限公司,国药准字S20050088)15 mg,静脉缓慢滴注3 ~4 h, 每日1 次。
1.2.3 血清指标检测 于治疗前和化疗3 个周期后采集晨起静脉血3 ml,3 000 r/min(离心半径8 cm)离心10 min,取血清,VEGF 水平采用双抗体夹心酶联免疫吸附法检测,血清细胞角蛋白19 片段21-1(CYFRA21-1)水平采用电化学发光法检测,血清癌胚抗原(CEA)水平采用放射免疫法检测,试剂盒均购自北京市肿瘤防治研究所。
1.3 疗效判定 完全缓解(CR):病灶完全消失,未出现新病灶,维持4 周以上;部分缓解(PR):病灶最长径之和降低30%及以上,维持4 周以上;疾病进展(PD):病灶最长径之和增大20%及以上,或有新病灶出现;稳定(SD):病灶最长径之和降低未达PR 标准,增大未达PD 标准。疾病控制率=(SD+PR+CR)/患者总数×100%。参照文献[2]标准,两组均连续化疗至少3 个周期,于化疗3 个周期后进行评估。
1.4 观察指标 ①化疗3 个周期后的疗效和疾病控制率。②两组治疗前、化疗3 个周期后血清VEGF、CYFRA21-1、CEA 水平。③不良反应发生情况。④随访2年,随访期间需要再次化疗者,维持原化疗方案,统计两组无进展生存期和总生存期。⑤两组生存质量改善率:根据治疗前、化疗3 个周期后KPS 评分变化情况评估,化疗3 个周期后KPS 评分增加≥10 分为改善,降低>10 分为降低,介于两者之间为稳定。
1.5 统计学方法 数据处理采用SPSS22.0 软件,计量资料以表示,两组间比较采用t 检验;计数资料以例数(%)表示,两组间比较采用χ2检验。P <0.05 为差异有显著性。
2 结 果
2.1 疗效 研究组疾病控制率(74.42%)明显高于对照组(53.49%,P <0.05)。见表2。
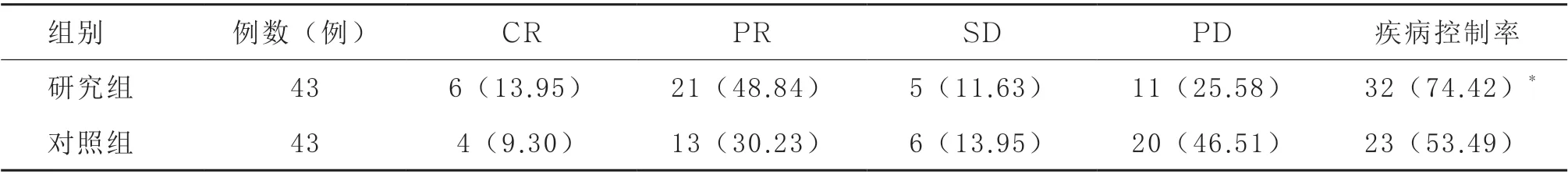
表2 两组疗效对比[例(%)]
2.2 血清VEGF、CYFRA21-1 和CEA 水平 治疗前,研究组血清VEGF、CYFRA21-1、CEA 水平与对照组比较差异无显著性(P >0.05)。化疗3 个周期后,两组上述指标均下降,且研究组降低更明显(P <0.05)。见表3。
表3 两组血清VEGF、CYFRA21-1 和CEA 水平比较()
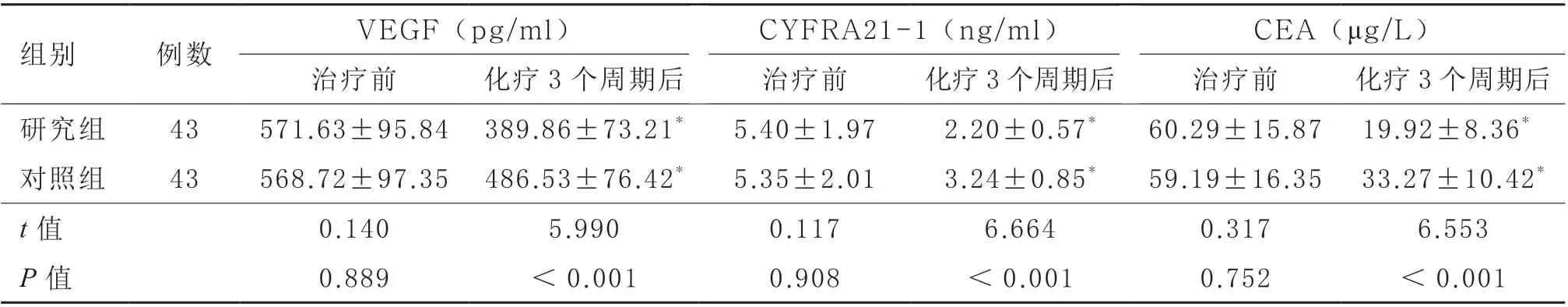
表3 两组血清VEGF、CYFRA21-1 和CEA 水平比较()
注:与本组治疗前比较:*P <0.05
组别 例数 VEGF(pg/ml) CYFRA21-1(ng/ml) CEA(μg/L)治疗前 化疗3 个周期后 治疗前 化疗3 个周期后 治疗前 化疗3 个周期后研究组 43 571.63±95.84 389.86±73.21* 5.40±1.97 2.20±0.57* 60.29±15.87 19.92±8.36*对照组 43 568.72±97.35 486.53±76.42* 5.35±2.01 3.24±0.85* 59.19±16.35 33.27±10.42*t 值 0.140 5.990 0.117 6.664 0.317 6.553 P 值 0.889 <0.001 0.908 <0.001 0.752 <0.001
2.3 不良反应 研究组恶心/ 呕吐、骨髓抑制、口腔黏膜炎、腹泻、血小板减少、肝功能损害、白细胞减少等不良反应发生率与对照组比较差异均无显著性(P >0.05)。见表4。
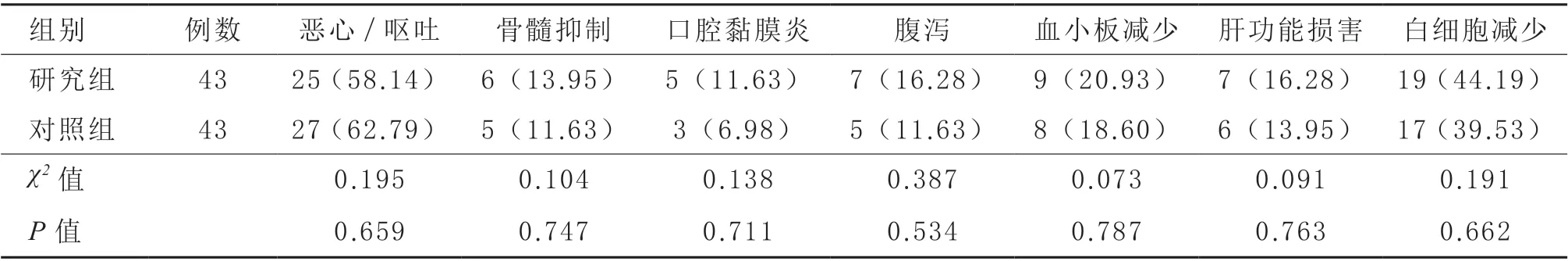
表4 两组不良反应发生情况比较[例(%)]
2.4 生存期 在随访2 年期间,研究组进行过3 个周期化疗者3 例,4 个周期者5 例,5 个周期者10 例,>5 个周期者25 例;对照组分别为5 例、7 例、10 例、21 例。研究组无进展生存期、总生存期均较对照组长(P <0.05)。见表5。
表5 两组生存期比较(,月)
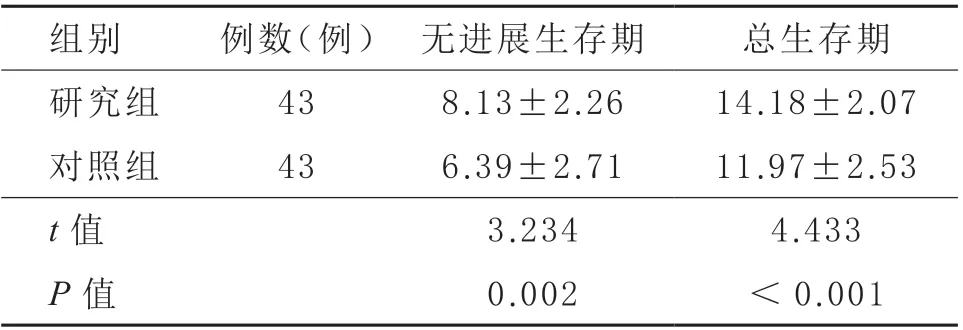
表5 两组生存期比较(,月)
组别 例数(例) 无进展生存期 总生存期研究组 43 8.13±2.26 14.18±2.07对照组 43 6.39±2.71 11.97±2.53 t 值 3.234 4.433 P 值 0.002 <0.001
2.5 生存质量改善率 化疗3 个周期后,研究组生存质量改善率(65.12%)较对照组(41.86%)高(P <0.05)。见表6。
3 讨 论
目前,临床治疗晚期CRC 患者的方法较多,其中SOX一线化疗方案应用较广泛,该化疗方案由替吉奥和奥沙利铂组成,前者可破坏肿瘤细胞DNA,有效杀死肿瘤细胞、抑制肿瘤增殖;后者具有促进5-氟尿嘧啶形成的作用,二者联合可发挥协同作用,具有良好抗肿瘤效果,临床应用广泛。但单独采用SOX 方案一线化疗仍有部分患者获益不佳。
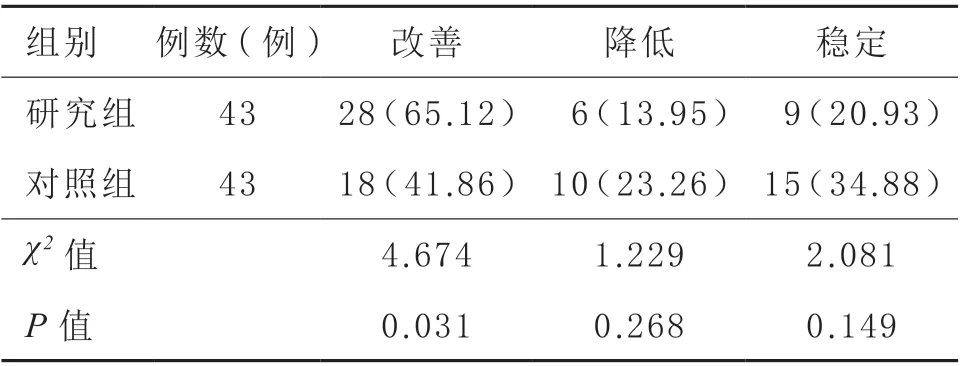
表6 两组生存质量改善率比较[例(%)]
肿瘤组织中存在大量新生血管,新生血管为肿瘤细胞的增殖、转移提供了动力支持[3]。抑制肿瘤内血管生成可以抑制肿瘤细胞的生长,因此抗血管生成药物的治疗作用越来越受到临床重视。作为目前常用的抗血管生成类药物,重组人血管内皮抑制素不仅能阻止血管生成、抑制血管内皮细胞迁移,还可加速细胞毒类药物在体内的分布,促使肿瘤内血管正常化,有效抑制肿瘤细胞增殖[4]。本研究中43 例晚期CRC 患者采用SOX 方案一线化疗联合应用重组人血管内皮抑制素治疗,疾病控制率高达74.42%,明显高于单用SOX方案化疗的对照组(P <0.05),而各种不良反应的发生率与对照组比较差异无显著性(P >0.05),显示治疗效果显著改善的同时未增加不良反应,具有一定安全性。重组人血管内皮抑制素可抑制肿瘤内新生血管生成,通过阻碍肿瘤血液供应达到抑制肿瘤细胞养分供给的目的,肿瘤因缺乏必要养分支持,从而逐渐缩小或消退[5]。本研究中,研究组化疗3 个周期后血清VEGF 水平低于对照组(P <0.05)。VEGF 作为血管形成的重要调节因子,其水平升高可促进机体形成新生血管,与肿瘤细胞增殖、浸润及转移复发存在紧密关系[6]。SOX 方案联合重组人血管内皮抑制素治疗能有效降低血清VEGF 水平,抑制肿瘤内新血管生成,这是其抑制肿瘤增殖的重要机制。
报道显示,血清CYFRA21-1、CEA 均为肿瘤标志物,二者在恶性肿瘤患者体内的高表达与患者病情密切相关[7]。本研究中发现,重组人血管内皮抑制素联合SOX 方案一线化疗能明显下调晚期CRC 患者血清CYFRA21-1 和CEA水平,且能提高患者生存质量改善率,延长无进展生存期和总生存期。表明重组人血管内皮抑制素联合SOX 方案一线化疗能进一步控制肿瘤细胞增殖,改善患者生存质量,延长患者生存期。
本研究尚存在样本选取量较少等不足,有待以后多渠道、多中心选取样本,进一步研究。
