S2–和Na+胁迫下黄河三角洲高潮滩芦苇光合作用和抗氧化酶活性的响应
2020-04-09陈琳张俪文刘子亭路峰颜坤韩广轩
陈琳, 张俪文, 刘子亭, 路峰, 颜坤, 韩广轩
S2–和Na+胁迫下黄河三角洲高潮滩芦苇光合作用和抗氧化酶活性的响应
陈琳1, 2, 张俪文2,*, 刘子亭1,*, 路峰3, 颜坤2, 韩广轩2
1. 聊城大学, 环境与规划学院, 山东 聊城 252000 2. 中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所), 山东省海岸带环境过程重点实验室, 中国科学院烟台海岸带研究所, 山东 烟台, 264003 3. 山东黄河三角洲国家级自然保护区管理委员会, 山东 东营 257500
潮汐湿地的土壤硫含量和钠离子含量很高, 然而该生境中的S2–以及S2–与Na+联合胁迫对植物生理生态影响认识不足。以黄河三角洲高潮滩芦苇为材料, 进行了对比实验(S2–浓度相同处理: 50 mmol·L–1Na2S VS. 50 mmol·L–1K2S处理; Na+离子浓度相同处理: 40 mmol·L–1Na2S VS. 80 mmol·L–1NaCl处理), 研究了S2–、Na+的联合胁迫以及它们的单独胁迫对芦苇的光合作用及抗氧化酶活性的影响差异。结果表明: Na2S比K2S和NaCl处理对芦苇光合速率的抑制作用更显著, 因此S2–和Na+的联合胁迫比它们的单独胁迫作用更强。对于抗氧化酶活性, 50 mmol·L–1Na2S处理后过氧化氢(H2O2)、过氧化物酶(POD)、超氧化物歧化酶(SOD)浓度显著升高, 说明在抵御S2–和Na+离子胁迫时, POD和SOD发挥重要的作用, 而在 Na2S处理下, 过氧化氢酶(CAT)则呈显著下降的趋势。总之, 硫和钠离子的同时存在严重抑制高潮滩芦苇的光合速率, 而POD和SOD、CAT对于抵御S2–和Na+胁迫起到重要的作用。
黄河三角洲; 盐胁迫; 芦苇; 光合作用; 抗氧化酶活性
0 前言
硫元素是植物生长代谢的重要元素之一, 参与多种生理代谢过程[1–2]。硫元素为植物生长所需的营养元素, 但硫过量会抑制植物的光合作用[2], 并破坏植物细胞膜的结构及功能的表达, 影响植物的生长发育[1]。Na+胁迫会抑制植物根系吸收水分, 导致植物出现生理干旱。同时, 植物吸收过多的Na+, 抑制其它离子的吸收, 造成营养不均衡[3]。此外, Na+胁迫还会抑制植物的光合作用[4-6], 抑制植物的生长发育。环境胁迫包括盐胁迫使得植物产生大量的活性氧(ROS)[7-8], 植物产生多种抗氧化酶对活性氧进行清除, 以适应环境胁迫。因此, 抗氧化酶活性是表征植物适应胁迫的重要生理生态指标。对于盐胁迫对植物生理生态影响的研究非常多[3, 9], 然而未见比较S2–和Na+离子对植物生理生态指标的单独作用和联合影响的研究。
在潮汐湿地生态系统, S2–和Na+离子普遍存在。潮汐带来大量的硫酸盐, 而潮汐的浸淹导致厌氧环境, 造成大量S2–的产生。同时, 潮汐作用控制着盐分运移, 不规律的潮水涨、退使潮滩处于非淹水与淹水的交互过程, 在淹水期间, 潮汐作用带来了大量的盐, 在非淹水期间, 地下水携带盐分向土壤表层富集, 使土壤表层盐分析出, 加重土壤盐渍化[10]。因此, 生长在潮汐湿地的植物受到S2–和Na+的双重影响, 那么这两种离子双重影响比单独胁迫作用大吗?比较S2–和Na+对植物生理生态指标的单独作用和联合影响有助于加深了解潮汐湿地环境条件对植物生长的影响机制。
黄河三角洲位于山东省东营市黄河入海口, 渤海湾南岸和莱州湾西岸[11]。黄河三角洲土壤以粉砂和细砂为主, 地下水中的盐分容易集聚到地表。由于受咸、淡水影响, 以及地下水较浅等原因, 黄河三角洲土壤盐渍化程度严重[12]。黄河三角洲滨海湿地土壤含硫量也很高[13-14], 其空间分布为从黄河河滩到近海光滩逐渐升高[15]。芦苇()是黄河三角洲潮汐湿地高潮滩植物群落重要的优势种群, 在气候和环境的调节及维持生物多样性等方面也具有重要作用[16]。黄河三角洲高潮滩芦苇具有明显的遗传分化和独特的遗传信息[17]。目前, 部分关于黄河三角洲滨海湿地芦苇对盐胁迫的研究主要表现在渗透物质及其贡献[18]、气体交换[19–20]以及生长[20]等方面。而本研究对黄河三角洲滨海湿地高潮滩芦苇在S2–和Na+胁迫下的光合特征和抗氧化酶活性指标进行了研究, 以期探明S2-和Na+离子单独胁迫及联合胁迫对高潮滩芦苇的光合作用影响大小, 对于S2–和Na+的胁迫植物抗氧化酶活性如何响应, 为黄河三角洲滨海湿地的生态修复提供参考。
1 材料与方法
1.1 实验材料
于2017年5月15日, 在山东黄河三角洲国家级自然保护区的高潮滩(37°43′32.3″N, 119°13′ 55.61″E), 采集芦苇的地下根茎并带回中国科学院烟台海岸带研究所人工气候室。将芦苇根茎泡入水中, 待其生须根发芽后, 将其栽入花盆(上口径为11.0 cm、底径为8.0 cm、盆高为10 cm)。每两天向花盆中浇灌150 mL的Hoagland营养液。人工气候室内的昼温为(28±2) ℃, 夜温为(20±2) ℃, 光周期为14 h(光照)+10 h(黑暗)。培养60 d后, 于2017年7月17日, 开始进行盐胁迫实验。
1.2 Na2S与K2S胁迫实验设计
为了探明Na2S对芦苇的胁迫影响是否是由S2–单独胁迫引起的, 开展Na2S与K2S处理对比实验(K+对植物不存在胁迫作用而且营养液中有充足的K+), 对比S2-单独胁迫(即K2S处理)和Na+、S2–联合胁迫(即Na2S处理)对高潮滩芦苇的光合作用和抗氧化系统的影响。挑选110 cm左右的芦苇9株, 设置三个浓度, 即0 mmol·L–1(CK)、50 mmol·L–1K2S或Na2S处理, 每个浓度3个重复。将各浓度所需的K2S与Na2S分别溶解于营养液中, 为避免盐冲击效应, 先进行预处理, 第一天的浓度分别为0 mmol·L–1(CK)、25 mmol·L–1, 每次递增25 mmol·L–1, 第二天达到处理浓度, 每次150 mL溶液, 预处理第三天达到最终浓度。正式处理时, 隔一天处理一次, 共处理四次,每两次处理后测一次光合指标, 共测两次。处理时通过盆下垫底盘重复淋洗三次后回收外渗溶液, 最后一次光合指标测定后进行叶片采集, 立即用液氮冷冻, 放置于-80 ℃冰箱保存待测。
1.3 Na2S与NaCl胁迫实验设计
为了探明Na2S对芦苇的胁迫影响是否是由Na+单独胁迫引起的, 开展Na2S与NaCl胁迫对比实验(Cl-在80 mmol·L–1时未够成胁迫作用), 对比Na+单独胁迫(即NaCl处理)和Na+、S2-联合胁迫(即Na2S处理)对高潮滩芦苇的光合作用和抗氧化系统的影响。挑选芦苇9株, 设置三个浓度, 即0 mmol·L–1(CK)、40 mmol·L–1Na2S、80 mmol·L–1NaCl。将各浓度所需的Na2S与NaCl分别溶解于营养液中, 进行预处理, 第一天的处理浓度分别为0 mmol·L–1(CK)、10 mmol·L–1Na2S、20 mmol·L–1NaCl, 每次递增20 mmol·L–1浓度第四天达到处理浓度。其余实验步骤同1.2。
1.4 测定指标与方法
光合指标测定[21]: 取每株芦苇顶端向下第3片完全展开、成熟的叶片, 保持叶片自然受光状态, 利用LI-6400便携式光合仪测定芦苇的光合速率()、实际光化学效率(φ)、光化学猝灭()和非光化学猝灭(), 测定时间为8: 00-18: 00, 设置光强为800 μmol·(m2·s)–1, 叶室温度为25 ℃, 待各指标达到稳定后记录。抗氧化系统指标: 超氧化物歧化酶(superoxide dismutase, SOD), 过氧化氢酶(catalase, CAT), 过氧化物酶(per-oxidase, POD)和过氧化氢含量(H2O2)测定均采用南京建成生物工程公司试剂盒提取粗酶液, 利用紫外可见分光光度计测定酶的活性[22]。
1.5 数据处理
对本研究中所有测定的指标, 采用R软件进行残差正态性与方差齐性检验, 利用单因素方差分析(One-way ANOVA)分析各处理对高潮滩芦苇叶片光合指标和抗氧化酶活性是否具有显著影响, 并用TukeyHSD法进行多重比较。本文中的百分数均为平均值百分比。
2 结果与分析
2.1 Na2S与K2S处理对高潮滩芦苇叶片光合指标和抗氧化系统的影响
2.1.1 Na2S与K2S处理对高潮滩芦苇叶片光合指标的影响
由图1可知, 随着处理次数的增加, 在 Na2S处理下的高潮滩芦苇净光合速率()呈显著下降趋势。50 mmol·L–1Na2S处理下, 第二次处理和第四次处理存在极显著差异, 分别较CK显著降低94.1%(<0.05)和90.5%(<0.05);50 mmol·L–1K2S处理下, 第二次和第四次处理分别较CK降低12.96%(=0.089)和10.42%(=0.07)。
由图1可知, 随着处理次数的增加, 高潮滩芦苇的实际光化学量子效率()、光化学猝灭()、非光化学猝灭(), 在50 mmol·L–1Na2S处理均显著下降,第二次和第四次处理分别较CK显著降低47.4%(<0.05)和60.8%(<0.05), 下降的原因可能与碳同化反应的强度受到抑制有关;第二次和第四次处理分别较CK显著降低47.4%(<0.05)和60.8%(<0.05);第二次和第四次处理分别与对照相比显著下降23.3%(<0.05)和26.1%(<0.05)。而与空白处理相比, K2S胁迫下这些光合作用指标均无显著变化。由此表明, K2S处理对高潮滩芦苇光合作用无影响, Na2S处理中, 50 mmol·L–1Na2S处理则明显抑制芦苇叶片的光合作用, 因此, 单独S2-胁迫不能抑制芦苇叶片光合作用, 可能是单独Na+胁迫或者Na+和S2–联合胁迫对高潮滩芦苇光合作用产生抑制作用。
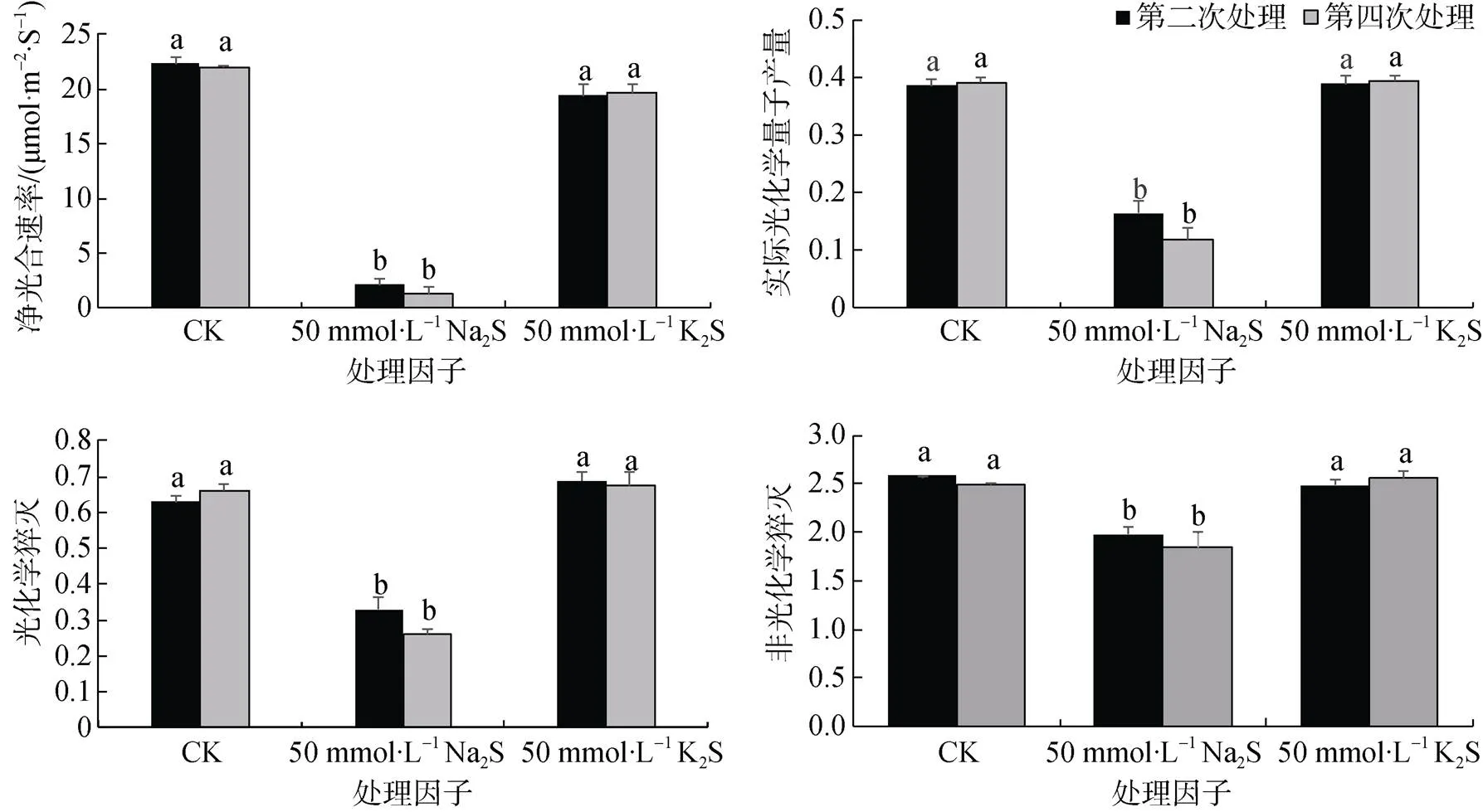
注: 图中标注不同的小写字母表示CK(0 mmol·L–1)与2种处理因子间差异水平显著(P<0.05), 下同;图中数值均为3次重复平均值+标准误, 下同。
Figure 1 Changes of photosynthesis in leaves ofunder Na2S and K2S stress
2.1.2 Na2S与K2S处理对高潮滩芦苇抗氧化酶的影响
实验中以H2O2为代表分析了两种盐处理下高潮滩芦苇叶片活性氧的变化情况, 由表1可知, 50 mmol·L–1Na2S处理下, H2O2的含量及POD、SOD的活性显著升高。但CAT活性呈显著下降趋势;在50 mmol·L–1K2S处理下H2O2显著升高, 其他抗氧化酶与CK无显著变化, 说明高潮滩芦苇的抗氧化系统对K2S处理无响应。
2.2 Na2S与NaCl处理对高潮滩芦苇叶片光合指标和抗氧化系统的影响
2.2.1 Na2S与NaCl处理对高潮滩芦苇光合指标的影响
由图2可知, 40 mmol·L–1Na2S处理对高潮滩芦苇有显著下降趋势, 40 mmol·L–1Na2S第四次处理较CK显著下降30.5%(<0.01)。80 mmol·L–1NaCl处理无显著差异。随着胁迫次数的增加, 显然是Na2S处理比NaCl处理对高潮滩芦苇净光合速率的影响大;由图2可知, 40 mmol·L–1Na2S和80 mmol·L–1NaCl处理对高潮滩芦苇的、、等光合作用指标无显著差异。因此单独Na+胁迫也对高潮滩芦苇的光合作用影响不显著, 再结合Na2S VS. K2S处理的对比实验结果(即单独S2–胁迫不起作用), Na2S处理抑制高潮滩芦苇的光合速率是由Na+和S2–联合胁迫的结果。
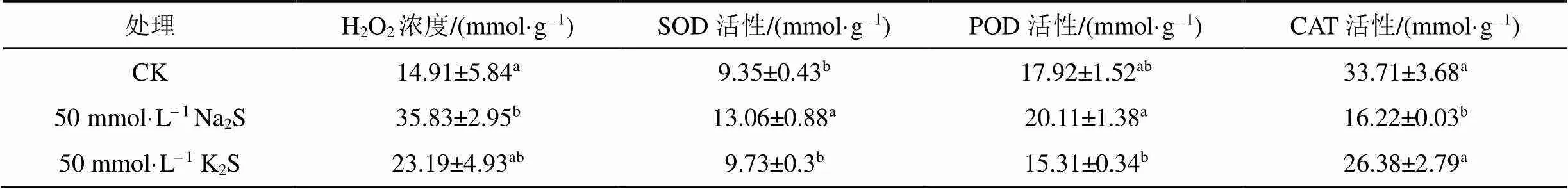
表1 Na2S与K2S处理下芦苇叶片抗氧化酶活性的变化
注: 不同小写字母表示CK与处理因子间差异显著(<0.05), 表中数值均为3次重复平均值±SE, 下同;各抗氧化系统指标是基于蛋白计算。
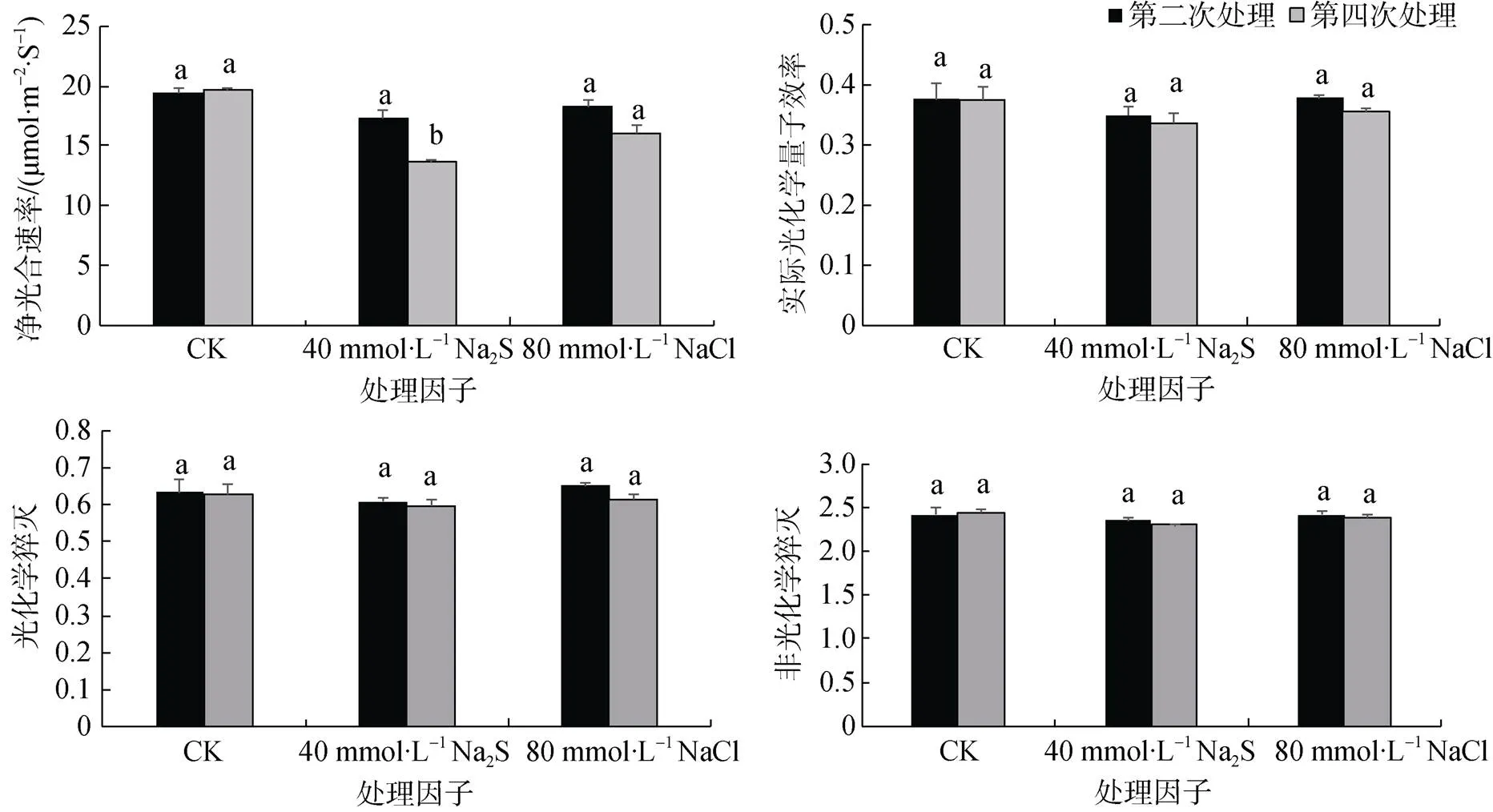
图2 Na2S和NaCl处理下芦苇叶片光合指标的变化
Figure 2 Changes of photosynthesis in leaves ofunder Na2S and NaCl stress
2.2.2 Na2S与NaCl处理对高潮滩芦苇抗氧化指标的影响
由表2可知, 40 mmol·L–1Na2S处理的高潮滩芦苇产生的H2O2的含量与CK、80 mmol·L–1NaCl相比显著增加148.48%、298.86%, 且POD、SOD活性也无显著差异, 但CAT活性较CK、80 mmol·L–1NaCl显著下降。
3 讨论
随着滨海湿地土壤盐渍化程度加重, 研究盐胁迫对植物的危害及植物对胁迫的响应迫在眉睫。在我们的前期研究中发现, 40 mmol·L–1Na2S处理下, 高潮滩芦苇的株高生长受到Na2S处理的抑制(空白处理株高的增长: 44 cm;40 mmol.L–1Na2S处理株高增长: 5.5 cm(<0.01))由此可见盐胁迫会造成高潮滩芦苇发育缓慢。盐胁迫不仅抑制植物生长, 还能使发育期提前[23], 造成生长代谢的紊乱。为了进一步阐明高潮滩芦苇对S2–和Na+离子胁迫的生理生态响应机制, 本研究测定了高潮滩芦苇在Na2S胁迫下的生理生态指标并讨论其内在调控机理。
在两个对比实验中, 在相同的S2–和Na+浓度下, 单独S2–(K2S)和Na+(NaCl)胁迫不能抑制芦苇叶片光合作用, 而Na+和S2–联合胁迫对高潮滩芦苇光合作用产生抑制作用。盐胁迫对光合作用造成影响主要表现为显著降低光合速率, 从而抑制植物的光合作用[24]。本研究结果表明, 在两个对比实验中的Na2S处理下, 高潮滩芦苇叶片的净光合速率均呈显著下降的趋势, 这与胡楚琦等[2]的研究结果类似。已有研究表明, 盐胁迫可以使 PSII受到损害, 进而导致光合作用下降[21], 而在50 mmol·L–1Na2S处理下,呈显著下降的趋势, 说明50 mmol·L–1Na2S处理降低了碳同化的运转。两种荧光猝灭和反应的是植物热耗散能力的变化[25], 且均呈显著下降趋势, 说明盐胁迫下高潮滩芦苇的叶片PSII的激发能分配方式发生变化, PSII的电子传递的活性减弱, 叶片不能通过非光化学猝灭提高热耗散消耗过多的激发能, 从而导致光合作用的显著下降。过高的S2-也会降低电子的活性, 并且当Na2S处理后逐渐产生的H2S气体对C3植物的光合作用也造成影响, 在叶青等[26]的研究中发现, 外源加入H2S会导致植物气孔的关闭。而Na2S产生的H2S也可能诱导叶片气孔关闭后, 作为C3植物的芦苇不能进行光合作用, 致使各光合指标下降, 从而降低光合作用。Na+的存在可能加剧了这些抑制作用, 但是两种离子如何联合抑制可能需要更深层次的分子实验来深入探讨。
植物在受到生物胁迫(叶绿体和过氧化物酶等)和非生物胁(盐度、干旱和重金属等)迫时会增加活性氧含量[27], 还会通过一系列的生理代谢等氧化伤害破坏植物的正常生长[28]。有研究表明高盐胁迫会增加活性氧含量[29], 且含量过高会使植物体受到伤害, 甚至死亡[30]。本研究结果表明, S2–和Na+共同抑制植物的光合作用, 但有研究表明H2S也提高H2O2的含量[26]。但本研究中的K2S处理未提高H2O2的含量。在Na2S和NaCl 处理实验中, 40 mmol·L–1Na2S处理下高潮滩芦苇活H2O2含量较CK显著上升, CAT较CK显著下降, 而SOD和POD活性无显著性差异。在Na2S和K2S实验处理中, 50 mmol·L–1K2S处理下, 高潮滩芦苇的各抗氧化酶的活性变化不明显, 可能是盐、硫胁迫在该处理的浓度较低, 不足以对高潮滩芦苇的抗氧化系统造成影响。在50 mmol·L–1Na2S处理下, H2O2、SOD和POD活性较CK显著升高, SOD是防御系统的第一关, 它可以催化自由基[31], SOD过量表达表明, SOD酶能有效地防御氧自由基对生物组织的损伤[32], POD可以表现为保护效应, 也表现为植物体衰老到一定阶段的产物[33], SOD和POD均可消除H2O2。而CAT的活性较CK显著下降, 这与彭立新等[34]人的研究结果类似。CAT也是重要的抗氧化酶, 有研究也表明, CAT活性的下降和含量的降低, 细胞清除过氧化氢的能力下降, 也导致过氧化氢含量的积累[35], 最终可导致细胞的死亡。因此, 在50 mmol·L–1Na2S处理下, 可能是由于CAT活力下降和SOD活力上升形成过多的H2O2, 从而打破芦苇细胞活性氧代谢平衡, 造成生理代谢紊乱, 并且结合光合指标也发现, 净光合速率及荧光猝灭显著下降, 且电子传递效率下降, 芦苇不能消耗过多的激发能, 导致一系列的生理紊乱。因此, 从光合指标和抗氧化系统指标来综合判定在相同的S2–和Na+浓度下, S2–和Na+联合胁迫(Na2S)比单独S2–(K2S)、Na+(NaCl)胁迫对芦苇的生长的抑制更严重。总之, 本研究中在两个对比实验中表明, S2–和Na+的联合胁迫显著降低了黄河三角洲高潮滩芦苇的光合作用, 最终影响生长发育, 这可能是芦苇长期适应盐、硫胁迫的响应机制, 其深层机制还有待从蛋白质组学等分子机制角度来进一步探讨。研究盐、硫联合胁迫以期为退化湿地的生态修复中提供数据支撑和理论支持。另外, 在退化湿地生态修复中, 我们应采取一定的措施减少其中一种离子来减轻甚至避免植物受到S2–和Na+的双重胁迫。

表2 Na2S和NaCl处理下芦苇叶片抗氧化酶活性的变化
注: 各抗氧化指标是基于叶片重量计算。
[1] 徐莹. 硫素胁迫对烟草生长和生理过程的影响研究[D]. 福州: 福建农林大学, 2010.
[2] 胡楚琦, 刘金珂, 王天弘, 等. 三种盐胁迫对互花米草和芦苇光合作用的影响[J]. 植物生态学报, 2015, 39(1): 92–103.
[3] 胡涛, 张鸽香, 郑福超, 等. 植物盐胁迫响应的研究进展[J]. 分子植物育种, 2018, 16(9): 3006–3015.
[4] 周琦, 祝遵凌. 盐胁迫对鹅耳枥幼苗光合作用和荧光特性的影响[J]. 林业工程学报, 2015, 29(2): 35–40.
[5] 燕辉, 彭晓邦, 薛建杰, 等. NaCl胁迫对花棒叶片光合特性及游离氨基酸代谢的影响[J]. 应用生态学, 2012, 23(7): 1790–1796.
[6] MAHLOOJI M, SHARIFI R, RAZMJOO J, et al. Effect of salt stress on photosynthesis and physiological parameters of three contrasting barley genotypes[J]. Photosynthetica, 2018, 56(2): 549–556.
[7] 沈文燕, 陆长梅, 周长芳. 互花米草和芦苇抗氧化系统在抵御硫胁迫过程中的响应差异[J]. 复旦学报, 2011, 5(50): 653–661.
[8] 张秋芳, 彭嘉贵, 林琼, 等. 硫素营养对不同品种水稻叶片活性氧代谢的影响[J]. 福建农业学报, 2003, 18(2): 116–119.
[9] 陈坚, 李妮亚, 刘强, 等. NaCl处理下两种引进红树的光合及抗氧化防御能力[J]. 植物生态学报, 2013, 37 (5): 443–453.
[10] 韩广轩. 潮汐作用和干湿交替对盐沼湿地碳交换的影响机制研究进展[J]. 生态学报, 2017, 37(24): 1–9.
[11] 韩美, 张晓惠, 刘丽云. 黄河三角洲湿地研究进展[J]. 生态环境, 2006, 15(4): 872–875.
[12] 范晓梅, 刘高焕, 唐志鹏, 等. 黄河三角洲土壤盐渍化影响因素分析[J]. 水土保持学报, 2010, 24(1): 139–144.
[13] 褚磊. 黄河三角洲滨海湿地土壤-植物系统硫时空分布的特征研究[D]. 北京: 中国科学院大学, 2014.
[14] GAGNON C, MUCCI A, PELLETIER E. Vertical distribution of dissolved sulphur species in coastal marine sediment[J]. Marine Chemistry, 1996, 52: 195–209.
[15] 于君宝, 陈小兵, 孙志高, 等. 黄河三角洲新生滨海湿地土壤营养元素空间分布特征[J]. 环境科学学报, 2010, 30(4): 855–861.
[16] 谢涛, 杨志峰. 水分胁迫对黄河三角洲河口湿地芦苇光合参数的影响[J]. 应用生态学报, 2009, 20(3): 562–568.
[17] 张俪文, 王安东, 赵亚杰, 等. 黄河三角洲滨海湿地芦苇遗传变异及其与盐度的关系[J]. 生态学杂志 2018, 16(1): 1–8.
[18] 赵可夫, 冯立田, 张圣强. 黄河三角洲不同生态型芦苇对盐度适应生理的研究Ⅰ.渗透调节物质及其贡献[J]. 生态学报, 1998, 18(5): 463–469.
[19] 赵可夫, 冯立田, 张圣强, 等. 黄河三角洲不同生态型芦苇对盐度适应生理的研究Ⅱ不同生态型芦苇的光合气体交换特点[J]. 生态学报, 2000, 20(5): 795–799.
[20]许振伟, 宋慧佳, 李明燕, 等. 不同生态型芦苇种群对盐胁迫的生长和光合特性[J]. 生态学报, 2019, 39(2): 1–8.
[21] 颜坤, 赵世杰, 徐化凌, 等. 盐胁迫对不同倍性金银花光合特性的影响[J]. 中国农业科学, 2015, 48(16): 3275– 3286.
[22] 管博, 于君宝, 陆兆华, 等. 黄河三角洲滨海湿地水盐胁迫对盐地碱蓬幼苗生长和抗氧化酶活性的影响[J]. 环境科学, 2011, 32(8): 2422–2429.
[23] 杨少辉, 季静, 王罡. 盐胁迫对植物的影响及植物的抗盐机理[J]. 世界科技研究与发展, 2006, 28(4): 70–76.
[24] PRAXEDS S, LACERDA C, DAMATTA F, et al. Salt tolerance is associated with differences in ion accumulation, biomass allocation and photosynthesis in cowpea cultivars[J]. Journal of Agronomy and Crop Science, 2010, 196(3): 193–204.
[25] 刘晓龙, 徐晨, 徐克章, 等. 盐胁迫对水稻叶片光合作用和叶绿素荧光特性的影响[J]. 作物杂志, 2014, 2: 88–92.
[26] 叶青, 侯智慧, 刘菁, 等. H2O2介导H2S诱导的拟南芥气孔关闭[J]. 植物生理学报, 2011, 47(12): 1195–1200.
[27] GILL S S, TUTEIA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48: 909–930.
[28] FOYER C H, NOCTOR G. Redox homeostasis and antioxidant signaling: a metabolic interface between stress perception and physiological responses[J]. The Plant Cell. 2005, 17: 1866–1875.
[29] HASEGAWA P, BRESSAN R, ZHU J K, et al. Plant cellular and molecular response to high salinity[J]. Annual Review Plant Physiology and Molecular Biology, 2000, 51: 463–499.
[30] 陈涛, 王贵美, 沈伟伟, 等. 盐胁迫对红麻幼苗生长及抗氧化酶活性的影响[J]. 植物科学学报, 2011, 29(4): 493–501.
[31] LIU A, HU Z R, BI A, et al. Photosynthesis, antioxidant system and gene expression of bermudagrass in response to low temperature and salt stress[J]. Ecotoxicology, 2016, 25: 1445–1457.
[32] 张俊霞, 刘晓鹏, 向极钎. 植物抗氧化系统对逆境胁迫的动态响应[J]. 湖北民族学院学报(自科版), 2015(4): 435–439.
[33] 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007, 23(1): 105–110.
[34] 彭立新, 周黎君, 冯涛, 等. 盐胁迫对沙枣幼苗抗氧化酶活性和膜脂过氧化的影响[J]. 天津农学院学报, 2009, 16(4): 2–4.
[35] 谢晓红. 植物抗氧化酶系统研究进展[J]. 化工管理, 2015(32): 99–100.
The response of the photosynthesis and antioxidant enzyme activities into S2–and Na+stress
CHEN Lin1, 2, ZHANG Liwen2,*, LIU Ziting1,*, LU Feng3, YAN Kun2, HAN Guangxuan2
1.College of Environment and Planning, Liaocheng University, Liaocheng 252000, Shandong, China 2. CAS Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Yantai Institute of Coastal Zone Research (YIC), Chinese Academy of Sciences(CAS); Shandong Key Laboratory of Coastal Environmental Processes, YICCAS, Yantai264003, Shandong, China 3. Administration Committee of the Yellow River Delta National Nature Reserve, Dongying 257091, Shandong, China
The soil sulfur content and Na+are very high in the tidal wetland. The physiological ecological response ofto S2–stress and S2–& Na+joint stress is unclear. Usingfrom the high tidal marsh in the Yellow River Delta as experimental materials, two comparison experiments were conducted (The same S2–concentration: 50 mmol·L–1Na2S VS. K2S; The same Na+concentration: 40 mmol·L–1Na2S VS. 80 mmol·L–1NaCl). The effects of S2-, Na+and their joint stress on photosynthesis and antioxidant enzyme activities were compared. The results showed that: Na2S inhibited the photosynthetic rate more strongly than the K2S and NaCl, and thus the joint effect of S2–and Na+stress was more serious than their single effect. Furthermore, for the antioxidant enzyme activities, under 50 mmol·L–1Na2S stress, the activities of H2O2, POD and SOD were higher than the control treatment, thus POD and SOD played an important role in resisting Na2S stress. Overall, the coexistence of S2–and Na+depressed themore severely, and POD and SOD played an important role in resisting S2-and Na+stress.
Yellow River Delta; salt stress;; photosynthetic indexes; autioxidant enzyme activities
10.14108/j.cnki.1008-8873.2020.02.021
Q945.79
A
1008-8873(2020)02-175-07
2019-07-07;
2019-10-10
国家自然科学基金项目(31670533); 中国科学院青年创新促进会项目(2018247)
陈琳(1990—), 女, 山东省聊城人, 硕士研究生, 主要从事滨海湿地植物生态学研究, E-mail: 463973219@qq.com
张俪文, 副研究员, E-mail: lwzhang@yic.ac.cn;刘子亭, 副教授, E-mail: zitingliu@126.com.
陈琳, 张俪文, 刘子亭, 等. S2–和Na+胁迫下黄河三角洲高潮滩芦苇光合作用和抗氧化酶活性的响应[J]. 生态科学, 2020, 39(2): 175–181.
CHEN Lin, ZHANG Liwen, LIU Ziting, et al. The response of the photosynthesis and antioxidant enzyme activities intoS2–and Na+stress [J]. Ecological Science, 2020, 39(2): 175–181.
