两种AM真菌对箭筈豌豆白粉病的防治效果
2020-04-09张伟珍段廷玉
张伟珍, 段廷玉,*
两种AM真菌对箭筈豌豆白粉病的防治效果
张伟珍1,2,3, 段廷玉1,2,3,*
1. 兰州大学草地农业科技学院, 兰州 730000 2. 兰州大学草地农业生态系统国家重点实验室, 兰州 730000 3. 农业农村部草牧业创新重点实验室, 兰州 730000
箭筈豌豆()是重要的豆科牧草和绿肥作物。白粉病是箭筈豌豆常见病害, 可抑制作物生长, 严重时甚至导致植物死亡, 造成巨大的经济损失。丛枝菌根真菌(Arbuscular mycorrhizal fungi, AMF)广泛存在于自然界中, 可与植物根系形成共生体, 对宿主植物生长、养分吸收及水分循环均有促进作用, 从而增加宿主对逆境胁迫的抗性。以箭筈豌豆为试验材料, 在温室条件下, 探究两种AM真菌和单独及混合接种对箭筈豌豆白粉病的影响。结果表明:、及两种AM真菌混合接种均显著降低箭筈豌豆白粉病的发病率及病情指数, 接种处理效果最显著, 其病情指数为37.37, 较NM处理降低56.26%;、和两种AM真菌混合接种的茎叶干重较NM处理增加64.47%、51.32%和70.49%, 根干重增加24.02%、15.64%和44.69%; AM真菌处理显著提高了植物超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)以及多酚氧化酶(PPO)等防御酶活性(<0.05), 促进了植物可溶性糖、可溶性蛋白以及叶绿素含量(<0.05)。
箭筈豌豆; AM真菌; 白粉病; 干重; 防御性酶活性
0 前言
箭筈豌豆()系豆科野豌豆属植物, 具有适应性广, 抗逆性强, 鲜草产量高和营养价值丰富等特点, 是家畜的优质饲草[1-2], 其籽粒粗蛋白含量可达30%, 广泛用于食品加工业及畜牧养殖业[3]。由于其良好的固氮作用, 在我国北方农区, 箭筈豌豆常与小麦()、燕麦()进行轮作、间作或套作, 在南方亦作为重要的冬闲田绿肥和饲草, 可有效改善土壤质量, 提升耕地质量, 提质增效, 兼具良好的经济、社会和生态效益[4-9]。
白粉病在许多重要农作物上发生普遍, 危害严重且较难防治, 是一种世界性病害, 可在作物一个生长季节反复多次侵染植株, 环境条件适宜时, 极易暴发流行[10-11]。箭筈豌豆感染白粉病后植株的干物质含量明显降低, 养分含量也有所下降, 牧草产量及品质严重受损, 造成巨大的经济损失[12-13]。箭筈豌豆白粉病主要由白粉菌属如内丝白粉菌()[14]、豌豆白粉菌()[15]等引起, 病原常以闭囊壳在病株残体上越冬, 属气传病害, 广泛发生于我国箭筈豌豆种植区[16-18]。
由丛枝菌根(arbuscular mycorrhizal, AM)真菌与植物形成的菌根共生体广泛存在于自然界中, 可改善寄主的养分状况和水分代谢, 促进植物生长, 改善植物的根际微生物环境并增强植物的抗病性[19-20]。已有研究表明, AM真菌对多种豆科植物病害均有抑制作用。如AM真菌中的摩西球囊霉()与紫花苜蓿()共生, 可以减轻由尖孢镰刀菌()引起的根腐病, 降低病害危害, 提高牧草产量[21]。另有研究表明, 摩西球囊霉同样对由烟色织孢霉()引起的紫花苜蓿根腐病有抑制作用[22]。而在对大豆()的研究中发现, 聚生球囊霉()可以抑制大豆胞囊线虫()卵囊增长, 减少产卵数及幼虫数量, 显著降低病害发生程度[23]。
目前有关箭筈豌豆白粉病防治的研究少有报道, 生产中常采用喷施硫磺、石硫合剂、甲基托布津、代森锰锌等药剂对作物白粉病进行防治, 但这将不可避免地对环境造成污染, 尤其是作为家畜饲草的箭筈豌豆, 不推荐施用化学药剂。微生物—植物互作, 尤其是利用共生微生物激发植物抗病性是国际上研究的热点, 本文以兰箭3号春箭筈豌豆作为试验材料, 研究了AM真菌对箭筈豌豆植株生长以及白粉病发生的影响, 旨在明确AM真菌对箭筈豌豆白粉菌的影响及作用机理, 为进一步利用AM真菌调控箭筈豌豆白粉病做好前期研究。
1 材料与方法
1.1 试验材料
1.1.1 供试植物
兰箭3号春箭筈豌豆(cv. Lanjian No.3)。
1.1.2 供试土壤
试验用土由草炭土和沙子两部分混合组成, 均购自兰州花市。草炭土于121 ℃高压蒸汽灭菌两次, 每次灭菌1 h, 间隔24 h。沙子过2 mm筛后, 置于烘箱中, 170 ℃干热灭菌6 h, 再将草炭土与沙子以1: 3的比例均匀混合, 即为土壤基质。混合基质全N为15.75 mg·kg-1, 全P为19.38 mg·kg-1, pH为7.2。
1.1.3 供试菌剂
供试AM真菌菌剂为扭形球囊霉()与根内根孢囊霉()。购买于北京市农林科学研究院植物营养与资源研究所, 中国丛枝菌根真菌菌种资源保藏中心, 宿主为三叶草(), 用河沙扩繁所得的孢子、菌根根段、根外菌丝及培养基质作为接种物。
1.2 试验设计
盆栽试验于2018年4月—8月在兰州大学榆中校区草地农业科技学院智能温室进行。4个AM真菌接菌处理:、、混合(Mix)与不接菌(NM)处理, 每处理6盆, 共24盆。各处理随机摆放。
AM真菌处理: AM真菌接种剂量为每盆100 g, 接种菌剂为用三叶草扩繁所得的孢子、菌根根段、根外菌丝及培养基质。菌根接种剂以层播的方法接种, 每盆先加入1500 g土壤基质, 后准确称取100 g菌剂均匀平铺于土壤上, 之后再加入400 g土壤基质覆盖在菌剂上面。NM处理则用100 g灭菌的土壤基质代替菌剂即可。
播种: 挑选大小一致、籽粒饱满且健康无病虫害的种子, 先用10%的H2O2(质量分数)对种子表面消毒10 min, 然后用无菌水清洗3遍。在已灭菌的培养皿中放入灭菌滤纸, 以无菌水浸湿, 用灭菌的镊子将种子均匀摆放于培养皿内, 每皿50粒, 置于25℃恒温培养箱培养48 h。待种子露白后即可移栽, 选取长势基本一致, 大小相近的植株分别移栽至花盆中, 播种深度为1—2 cm, 每盆移栽6株, 盆顶覆盖保鲜膜。出苗1周后, 选取长势一致的植株定苗至4株。
试验管理: 出苗后每周观察记录植株叶片数、株高、分枝数。生长期间, 每隔一天称重浇水。在温室生长9周后收获, 测定植物生长及生理生化指标。
1.3 测定指标及方法
发病率、病情指数: 从植株发病当日起, 每隔一天统计发病率, 共统计7次。并根据植株发病程度计算发病第7 d的病情指数。
生物量: 105 ℃杀青20 min, 然后放入烘箱80℃烘干至恒重后称重。
AM真菌侵染率及侵染强度: 采用Giovannetti等[24]的方法对植株根系进行染色, 然后在解剖镜下用“十字交叉法”检测菌根侵染情况。按照Trouvelot等[25]制定的菌根侵染和丛枝丰度的分级标准, 统计对应等级参数, 数据录入MYCOCALC.EXE软件, 计算AM真菌侵染率及侵染强度:
(菌根侵染率) = (被侵染根段数 / 镜检总根段数)×100%
(菌根侵染强度) = (0.95×5+ 0.7×4+ 0.3×3+ 0.05×2+ 0.01×1) /全部根段数×100
其中0.95, 0.7, …分别代表各级所占权重;5,4, …分别代表各级根段数。
植物超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)以及多酚氧化酶(PPO)等防御酶活性参照李合生[26]的方法测定; 可溶性糖含量采用蒽酮比色法[27]; 可溶性蛋白质含量采用考马斯亮蓝染色法[28]; 植物样本通过石墨消解仪制备消煮液, 然后使用流动注射仪(FIAstar 5000 Analyzer, FOSS, Sweden)测定植物地上及地下部的全氮、全磷含量[29]; 叶绿素含量参照许大全的方法测定[30]。
1.4 数据处理与分析
试验数据按照不同处理, 录入Microsoft Excel 2010进行整理汇总。用JMP IN 4统计软件对各指标进行交互效应以及方差分析, 结果用GraphPad Prism 5.01作图。
2 结果
2.1 发病率、病情指数
不论是否接种AM真菌, 温室盆栽箭筈豌豆在生长36 d后均发生白粉病。不接种AM真菌的处理(对照)发病率最高, 在第9 d时已达100 %。单独接种与或两种AM真菌混合接种均显著降低箭筈豌豆白粉病的发病率。其中接种的处理发病率最低, 观察至第13 d, 发病率为60%(图1a)。
AM真菌对病情指数的影响如图1b所示。不接种AM真菌的处理(对照)病情指数最高, 为85.43。单独接种与或两种AM真菌混合接种均显著降低箭筈豌豆白粉病的病情指数(<0.05)。接种的处理病情指数最低, 为37.37, 与对照相比, 病情指数降低56.26%。
2.2 生物量
接种AM真菌的处理显著提高了箭筈豌豆的地上生物量、地下生物量, 促进了箭筈豌豆的生长(<0.05)。接种、和两种AM真菌混合接种的茎叶干重较NM处理增加64.47%、51.32%和70.49%, 根干重增加24.02%、15.64%和44.69%。综合来看, 两种AM真菌混合接种对箭筈豌豆生长的促进作用更加显著(图2)。
2.3 N、P含量
AM真菌分别提高植物地上、地下部分N含量38.63%—86.52%和20.43%—63.49%, 提高植物地上部分P含量44.91%—72.38%(图3a, b, c), 地下部分P含量仅在混合接种时较对照增加(73.19%), 单独接种任一AM真菌未对地下P含量产生显著影响(图3d)。
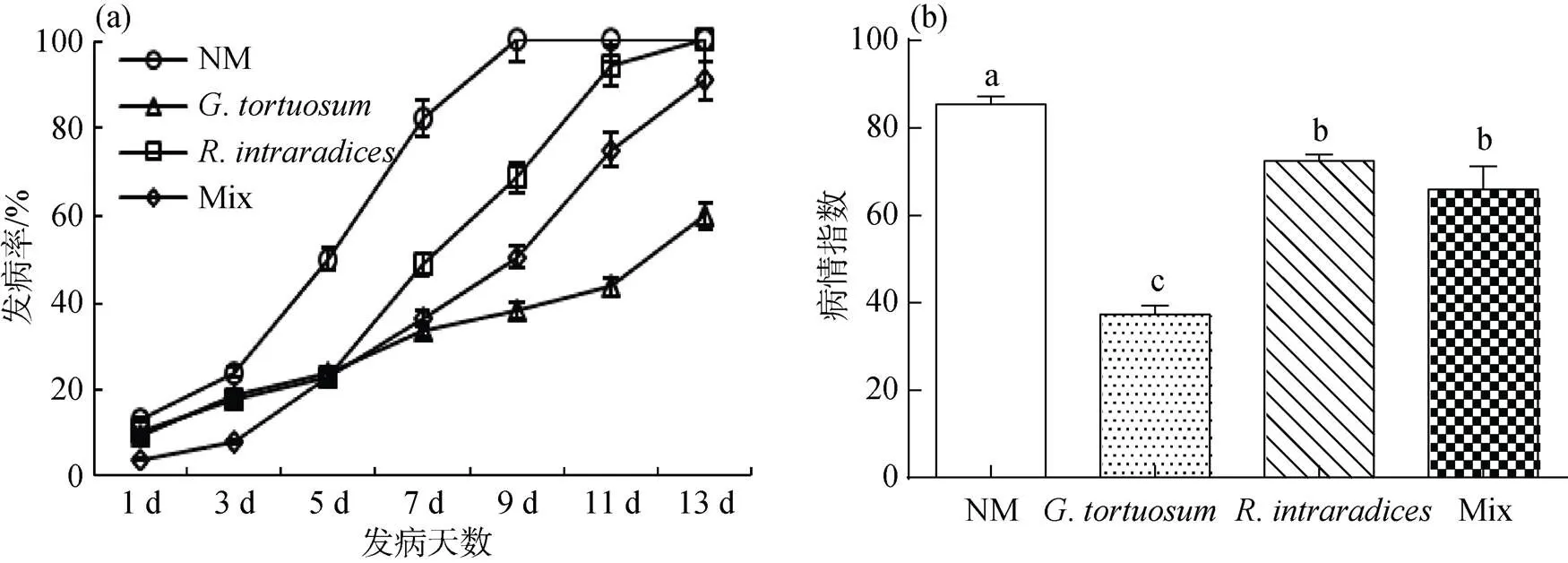
注: NM表示不接种AM真菌处理, Mix表示两种AM真菌混合接种处理, 不同小写字母表示不同处理间差异显著(P<0.05), 下此。
Figure 1 Effect of AM fungi on the disease occurrence ofpowdery mildew

图2 AM真菌对箭筈豌豆生物量的影响
Figure 2 Effect of AM fungi on the biomass of

图3 AM真菌对箭筈豌豆N、P含量的影响
Figure 3 Effect of AM fungi on content of N and P
2.4 AM真菌侵染率、侵染强度
NM处理未发现菌根侵染。接种、和两种AM真菌混合接种的菌根侵染率分别为40.42%、39.58%和32.92%, 侵染强度分别为14.00、12.08和11.25(图4)。由试验结果可看出,和对箭筈豌豆的侵染较强, 而两种AM真菌混合接种对箭筈豌豆的侵染较弱。
2.5 防御酶活性
AM真菌处理下植株中的POD和PPO活性均高于不接AM真菌的处理(<0.05), 其中对POD活性的影响最为显著, 较NM处理增加79.06%; 三种AM处理对PPO活性的影响无显著差异, 较NM处理增加49.52%—57.60%。相比于NM处理,和Mix处理显著提高了植株中SOD的活性, 这与POD和PPO活性的试验结果一致, 但对SOD活性的影响并不显著。Mix处理下植株中的CAT活性较NM处理提高了53.81%, 但和对CAT活性并未产生显著影响(图5)。四种植物防御性酶活性的提高说明植物的抗逆性得以增强, 故AM真菌有益于植物在逆境胁迫下的生长。
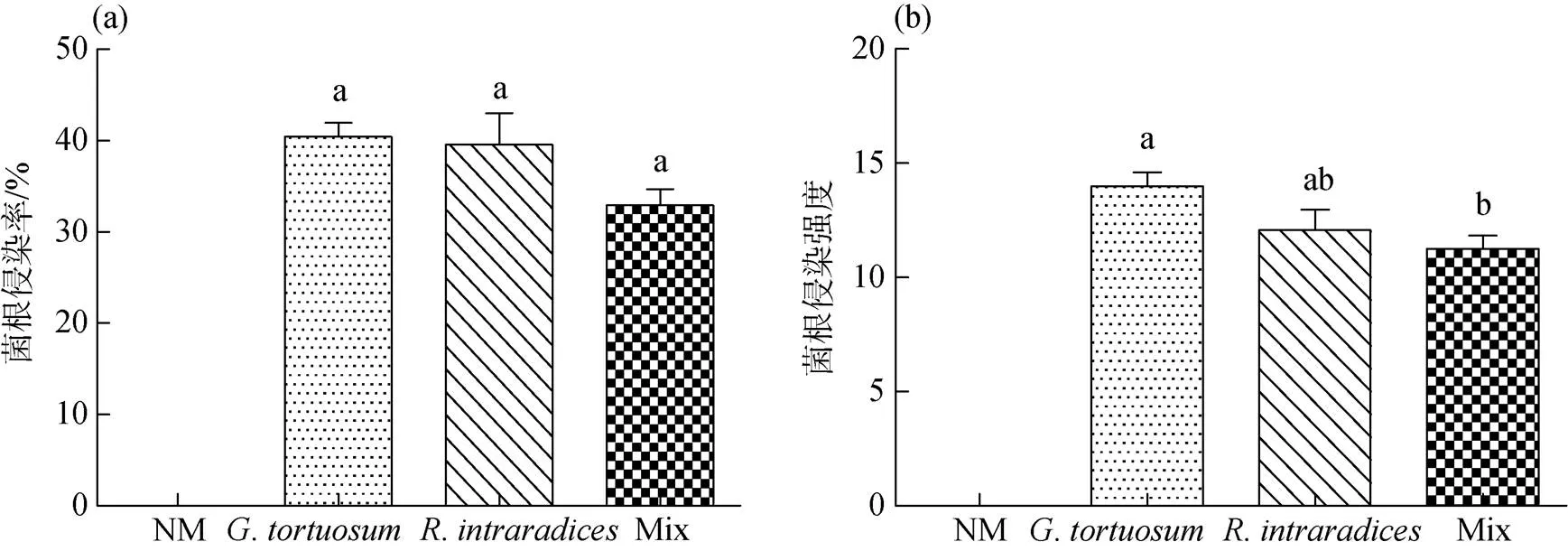
图4 AM真菌侵染率及侵染强度
Figure 4 AM colonization and AM colonization intensity

图5 AM真菌对箭筈豌豆防御酶活性的影响
Figure 5 Effect of AM fungi on defense enzyme activity of
2.6 可溶性糖、可溶性蛋白
接种、和Mix处理均显著提高植株中可溶性糖的含量(<0.05), 分别比NM处理增加95.27%、53.00%和109.09%, 单独接种或两种AM真菌混合接种对可溶性糖含量的影响最明显(<0.05)。
AM真菌对箭筈豌豆中可溶性蛋白含量的影响与可溶性糖含量的一致, 接种、和Mix处理均显著提高了植株中可溶性蛋白的含量(<0.05), 分别比NM处理增加83.46%、83.46%和145.86%。两种AM真菌混合接种对可溶性蛋白含量的影响最明显, AM真菌处理间无显著差异(图6)。
2.7 叶绿素与丙二醛含量
与对照相比, 单接种、和Mix处理均显著提高了箭筈豌豆叶绿素含量, 降低了丙二醛含量(<0.05), 其中叶绿素含量增加79.73%、67.57%和37.30%, 丙二醛含量降低38.87%、47.77%和42.51%, 说明AM真菌降低了白粉病对植物造成伤害(图7)。
3 讨论
本研究在温室条件下, 探究了接种丛枝菌根真菌对箭筈豌豆生长、生理生化指标以及白粉病发生的影响, 结果表明AM真菌可以促进箭筈豌豆生长和N、P养分吸收, 增加地上及地下干物质含量, 并诱发植物抗病性相关酶及生理生化指标作出响应, 从而减轻白粉病的发生。试验结果对于进一步利用AM真菌调控箭筈豌豆白粉病具有积极的意义。
AM真菌可以促进宿主植物生长, 增加其对营养元素的吸收和利用, 从而提高植物产量, 并增强其抗逆性, 这就起到了壮苗的作用, 可以使植株更好地抵抗病原菌的侵染[31-32]。本研究表明, 接种AM真菌显著促进了箭筈豌豆生长, 促进了对N、P元素的吸收和利用。同时促进了植物SOD、CAT、PPO等抗病性相关酶的活性, 尤其是混合接菌处理, 效果更好, 这表明在田间条件下, 可通过改变土壤中AM真菌多样性, 调控植物病害发生。SOD、CAT、PPO等4种植物保护酶, 可清理植物细胞中的有毒化学物质, 从而缓解和避免植物受到逆境因子的毒害, AM真菌对防御酶活性的正向促进作用可以增强植物的抗氧化防御系统, 提高植物对逆境胁迫的抵抗能力[33-34]。另外, AM真菌降低了植株中的丙二醛含量, MDA含量是衡量膜脂过氧化程度的一个重要标志, MDA含量越高说明细胞膜的损害程度越严重, 接种AM真菌后MDA含量降低, 这也间接说明AM真菌可以保护植物细胞及组织免受逆境因子造成的危害[35]。而叶绿素含量的增加则说明AM真菌可以减缓叶绿素分解速度, 增强植物细胞质膜的稳定性, 从而减缓逆境因子对植物细胞膜的伤害[36-37]。上述试验结果进一步丰富了AM真菌调控植物-病原菌互作多样性内容[38-41], 综合试验, 认为AM真菌可以对箭筈豌豆白粉病产生抑制效应。
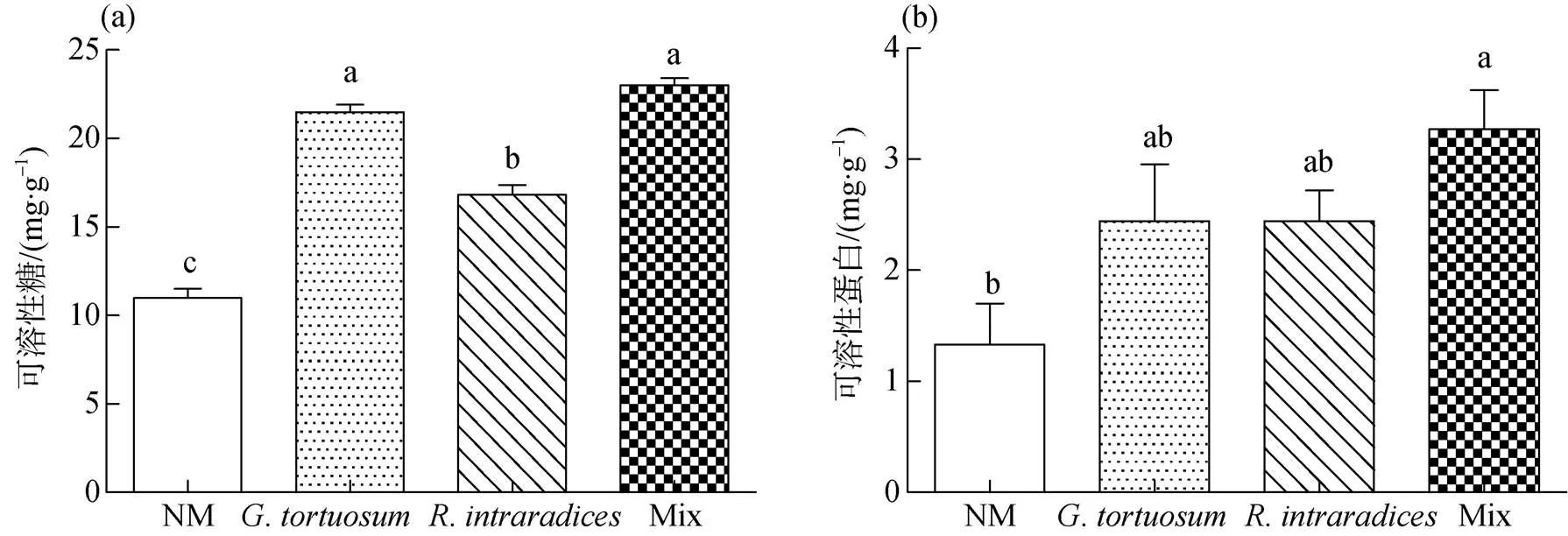
图6 AM真菌对箭筈豌豆可溶性糖、可溶性蛋白含量的影响
Figure 6 Effect of AM fungi on content of soluble sugar and soluble protein

图7 AM真菌对箭筈豌豆叶绿素、丙二醛含量的影响
Figure 7 Effect of AM fungi on content of chlorophyll and MDA
农业结构调整, 粮改饲等政策, 极大的促进了箭筈豌豆等牧草的种植。党的十八大以来, 国家更是提出了绿色健康可持续发展, 提出绿水青山就是金山银山, 大力提倡发展绿肥、有机肥, 减少化肥农药的使用, 箭筈豌豆作为绿肥其重要地位更是凸显。在此大背景下, 箭筈豌豆种植面积日益增加, 种植结构亦趋向复杂化, 明确不同区域、不同模式下箭筈豌豆病害, 尤其是白粉病等气传病害的发生规律, 利用植物-微生物互作机理, 调控植物病害发生, 是切实可行的途径。AM真菌作为一种广泛存在的土壤共生微生物, 可以促进植物生长, 抑制病害发生[42-44], 其对豆科植物结瘤、固氮, 改善土壤理化性质, 培肥地力, 促进植物根系下扎[45-46], 丰富土壤微生物区系和多样性亦有积极作用[47-49]。应进一步加大其在植物病害防治中的研究, 提质增效, 促进农业健康可持续发展。
4 结论
接种AM真菌可降低箭筈豌豆白粉病的发病率及病情指数, 对白粉病产生抑制效应。另外AM真菌可以提高箭筈豌豆生物量, 促进植物生长, 促进对N、P元素的吸收; 同时对防御酶SOD、POD、CAT、PPO活性也产生了正向作用, 促进植株对可溶性糖及可溶性蛋白的合成与积累, 增加了植株对病原菌的抵抗能力。因此, AM真菌有作为箭筈豌豆白粉病的生物防治因子的潜力, 进行后续相关研究, 有望为箭筈豌豆白粉病的防治寻找新途径。
[1] 洪汝兴, 李荣. 肥、饲、粮兼用作物—箭筈豌豆[J]. 中国种业, 1985(3): 14–16.
[2] 宋敏, 于洪柱, 娄玉洁, 等. 山野豌豆生物学特性及其利用[J]. 草业与畜牧, 2011(4): 5–6.
[3] 焦彬. 农区绿肥饲料兼用作物——箭筈豌豆[J]. 作物杂志, 1985, 1: 34–35.
[4] Tomm G O, Foster R K. Effect of intercropping wheat with forage legumes on wheat production and ground cover[J]. Pesquisa Agropecuária Brasileira, 2001, 36(3): 465–471.
[5] 刘国一. 西藏中部农区冬小麦套种箭舌豌豆研究[J]. 西藏农业科技, 2005, 27(1): 27–30.
[6] 关卫星, 金涛, 宋国英, 等. 不同燕麦品种与箭舌豌豆的混播试验初报[J]. 西藏农业科技, 2011(4): 19–22.
[7] Nan Zhibiao, Zhang Jiyu, Wang Yanrong, et al. Genotype×environment interactions and consistency analysis for agronomic characteristics of fivelines[J]. Acta Ecologica Sinica, 2004, 24(3): 395–401.
[8] Liu Zhipeng, Liu Peng, Luo Dong, et al. Expl oiting Illumina sequencing for the development of 95 novel polymorphic EST-SSR markers in common vetch (subsp. sativa)[J]. Molecules, 2014, 19(5): 5777–5789.
[9] Dong D K, Dong R, Liu Z P, et al. Diversity of compound leaf phenotypic characteristics of 532germplasms[J]. Pratacultural Science, 2015, 32(6): 93 5–941.
[10] 曹静, 胡明江. 园林植物白粉病的发生及其防治[J]. 现代园艺, 2009(6): 45–46.
[11] 霍治国, 叶彩玲, 钱拴, 等. 气候异常与中国小麦白粉病灾害流行关系的研究[J]. 自然灾害学报, 2002, 11(2): 85–90.
[12] Moneim A M A, Cocks P S, Swedan Y. Yield stability of selected forage vetches (spp.) under rainfed conditions in west Asia[J]. The Journal of Agricultural Science, 1988, 111(2): 295–301.
[13] Papastylianou I. Effect of rainfall and temperature on yield ofunder rainfed Mediterranean conditions[J]. Grass and Forage Science, 1995, 50(4): 456–460.
[14] Khodaparast S A, Takamatsu S, Hedjaroude G A. Phylogenetic structure of the genus(Erysiphales: Erysiphaceae) inferred from the nucleotide sequences of the rDNA ITS region with special reference to the.species complex[J]. Mycological Research, 2001, 105(8): 909–918.
[15] Yin J. The pasture pathogen and pest of Yunnan[M]. Kunming: Yunnan Science and Technology Press, 1996.
[16] 刘若, 侯天爵. 我国北方豆科牧草真菌病害初步名录[J]. 中国草原, 1984, 1: 010.
[17] Gao L Q, Yang J R, Shang H S, et al. Studies on the Hyperparasite fungi–[J]. Acta Agriculture Boreali-occidentalis Sinica, 2004, 13(4): 41–44.
[18] Jin S L. Study on the Taxonomy of Erysiphales in Flora of Shanxi Provinces[D]. Yangling: Northwest Agricultural and Forestry University, 1988.
[19] Schroeder J I, Delhaize E, Frommer W B, et al. Using membrane transporters to improve crops for sustainnable food production[J]. Nature, 2013, 497(7447): 60–66.
[20] Harrier L A, Watson C A. The potential role of arbuscular mycorrhizal(AM) fungi in the bioprotection of plants against soil-borne pathogens in organic and/or other sustainable farming systems[J]. Pest Management Science: formerly Pesticide Science, 2004, 60(2): 149–157.
[21] Nursery T, Chakravarty P. Effects of vesicular-arbuscular mycorrhizal fungi on the development ofandof alfalfa[J]. Plant Disease, 1992, 76(3): 239–243.
[22] 李应德, 闫智臣, 高萍, 等. 摩西球囊霉对紫花苜蓿烟色织孢霉根腐病的影响[J]. 中国生物防治学报, 2018, 34(4): 598–605.
[23]李海燕, 刘润进, 束怀瑞. 丛枝菌根真菌与大豆胞囊线虫相互作用研究初报[J]. 植物病理学报, 2002, 32(4): 356–360.
[24] Giovannetti M, Mosse B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]. New Phytologist, 1980, 84(3): 489–500.
[25] Trouvelot A, Kough J L, Gianiazzi-Pcarson V. Measurement of VA mycorrhiza system: Methods of the estimation of its function[J]. Physiological and Genetical Aspects of Mycorrhizae. Paris: INRA Press, 1986: 217–221.
[26] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[27] 王学奎. 植物生理生化实验原理和技术. 第2版[M]. 北京: 高等教育出版社, 2006.
[28] 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[29] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003.
[30] 许大全. 叶绿素含量的测定及其应用中的几个问题[J]. 植物生理学通讯, 2009, 45(9): 896–898.
[31] Akhtar M S, Siddiqui Z A, Wiemken A. Arbuscular mycorrhizal fungi and Rhizobium to control plant fungal diseases [M]//Alternative farming systems, biotechnology, drought stress and ecological fertilisation. Springer, Dordrecht, 2011: 263–292.
[32] Smith G S. The role of phosphorus nutrition in interacttions of vesicular-arbuscular mycorrhizal fungi with soilborne nematodes and fungi[J]. Phytopathology, 1988, 78: 371–374 .
[33] HuLongxing, Li Huiying, Pang Huangcheng, et al. Responses of antioxidant gene, protein and enzymes to salinity stress in two genotypes of perennial ryegrass () differing in salt tolerance[J]. Journal of Plant Physiology, 2012, 169(2): 146–156.
[34] 杨海霞, 刘润进, 郭绍霞. AM真菌摩西球囊霉对盐胁迫条件下高羊茅生长特性的影响[J]. 草业学报, 2014, 23(4): 195–203.
[35] 王建明, 张作刚, 郭春绒, 等. 枯萎病菌对西瓜不同抗感品种丙二醛含量及某些保护酶活性的影响[J]. 植物病理学报, 2001, 31(2): 152–156.
[36] Zhu Xiancan, Song Fengbin, Liu Shengqun, et al. Effects of arbuscular mycorrhizal fungus on photosynthesis and water status of maize under high temperature stress[J]. Plant and Soil, 2011, 346(1/2): 189–199.
[37] 陈笑莹, 宋凤斌, 朱先灿, 等. 高温胁迫下丛枝菌根真菌对玉米光合特性的影响[J]. 华北农学报, 2013, 28(2): 108–113.
[38] Duan Tingyu, Facelli E, Smith S E, et al. Differential effects of soil disturbance and plant residue retention on function of arbuscular mycorrhizal (AM) symbiosis are not reflected in colonization of roots or hyphal development in soil[J]. Soil Biology and Biochemistry, 2011, 43(3): 571–578.
[39] Maya M A, Matsubara Y. Tolerance toand anthracnose diseases and changes of antioxidative activity in mycorrhizal cyclamen[J]. Crop Protection, 2013, 47: 41–48.
[40] Martínez-Medina A, Roldán A, Pascual J A. Interaction between arbuscular mycorrhizal fungi andunder conventional and low input fertilization field condition in melon crops:growth response and Fusarium wilt biocontrol[J]. Applied Soil Ecology, 2011, 47(2): 98–105.
[41] Kloppholz S, Kuhn H, Requena N. A secreted fungal effector ofpromotes symbiotic biotrophy[J]. Current Biology, 2011, 21(14): 1204–1209.
[42] 王立, 王敏, 马放, 等. 丛枝菌真菌对小麦的促生长效应与根腐病抑制效应[J]. 哈尔滨工业大学学报, 2015, 47(4): 15–19.
[43] 周宝利, 郑继东, 毕晓华, 等. 丛枝菌根真菌对茄子黄萎病的防治效果和茄子植株生长的影响[J]. 生态学杂志, 2015, 34(4): 1026–1030.
[44] 周昱. 不同丛枝菌根真菌对云杉生长及根腐病的影响[J]. 江苏农业科学, 2018, 46(14): 102–105.
[45] 张俊英, 许永利, 刘小艳. 丛枝菌根真菌对大棚番茄连作土壤的改良效果[J]. 北方园艺, 2018(3): 119–124.
[46] 陈保冬, 李雪静, 徐天乐, 等. 丛枝菌根真菌生物地理学研究进展[J]. 生态学报, 2018, 38(4): 1167–1175.
[47] 杨超, 蔡柏岩. AM真菌对连作作物根系代谢产物的影响[J]. 中国农学通报, 2018, 34(14): 35–39.
[48] Van der Heijden M G A, Boller T, Wiemken A, et al. Different arbuscular mycorrhizal fungal species are potential determinants of plant community structure[J]. Ecology, 1998, 79(6): 2082–2091.
[49] Lin Guigang, McCormack M L, Ma Chengen, et al. Similar below-ground carbon cycling dynamics but contrasting modes of nitrogen cycling between arbuscular mycorrhizal and ectomycorrhizal forests[J]. New Phytologist, 2017, 213(3): 1440–1451.
Effects of two kinds of AM fungi onpowdery mildew
ZHANG Weizhen1,2,3, DUAN Tingyu1,2,3,*
1. College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730000, China 2.State Key Laboratory of Grassland Agro-ecosystems, Lanzhou University, Lanzhou 730000, China 3. Key Laboratory of Grassland Livestock Industry Innovation, Ministry of Agriculture, Lanzhou 730000, China
is an important leguminous forage and green manure crop. Powdery mildew is a common disease that can reduce plant biomass, inhibit growth, and even leading to the death of plant, causing huge economic losses. Arbuscular mycorrhizal fungi (AMF) is widely distributed in nature ecosystems and can form a symbiont with plant roots, which promotes host plant growth, nutrient uptake and water cycle, thereby increasing host resistance to stress. In this study, we tested the effects of two AM fungi,and, alone or in combination on the occurrence ofpowdery mildew. The results showed that,and the mixed immunization significantly reduced the incidence and disease index ofpowdery mildew, of which,had the strongest inhibition to powdery mildew; the disease index was 37.37, which was 56.26% lower than that of NM treatment. Compared with NM treatment, the dry weight of stems and leaves was increased by 64.47%, 51.32% and 70.49% by the inoculation of,and the mixed immunization, and the root dry weight was increased by 24.02%, 15.64% and 44.69%, respectively. Plant defense related enzyme activities such as SOD, POD, CAT and PPO were also increased by the inoculation of AMF (<0.05). In addition, AM fungi treatment also significantly increased plant soluble sugar, soluble protein and chlorophyll content (<0.05).
; arbuscular mycorrhizal fungi; powdery mildew; dry weight; defense enzyme activity
10.14108/j.cnki.1008-8873.2020.02.011
S43
A
1008-8873(2020)02-082-08
2018-12-18;
2019-01-18
国家现代农业产业技术体系项目(CARS-22)
张伟珍(1993—), 女, 甘肃定西人, 在读硕士生, 研究方向为植物病理学, E-mail: zhangwzh16@lzu.edu.cn
段廷玉(1976—), 男, 甘肃靖远人, 教授, 博士, 研究方向为菌根生态学, E-mai: duanty@lzu.edu.cn
张伟珍, 段廷玉, 等. 两种AM真菌对箭筈豌豆白粉病的防治效果[J]. 生态科学, 2020, 39(2): 82-89.
ZHANG Weizhen, DUAN Tingyu, et al. Effects of two kinds of AM fungi onpowdery mildew[J]. Ecological Science, 2020, 39(2): 82-89.
