二苯乙烯苷抗氧化和抗炎作用的机制研究
2020-04-09陈子卓徐宇航赵九洲朱敬朴郑义鹏李文丽吴浩芝海春旭于卫华
陈子卓,徐宇航,#,赵九洲,#,朱敬朴,郑义鹏,李文丽,吴浩芝,海春旭,*,于卫华,*
(1.空军军医大学基础医学院,陕西 西安710032;2.空军军医大学军事预防医学院军事毒理学与防化医学教研室,陕西省自由基生物学与医学重点实验室,特殊作业环境危害评估与防治教育部重点实验室.陕西 西安 710032)
巨噬细胞是机体内重要的免疫细胞,可通过细胞吞噬和释放炎症因子发挥免疫调节作用[1-2]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁的主要成分,是一种内毒素和重要特异性抗原。巨噬细胞在LPS 的刺激下,会发生M1 型极化,并释放TNFα和IL-6等多种促炎因子[3]。大量证据表明,炎症反应与氧化应激关系密切,炎症过程会生成大量的活性氧(reactive oxygen species,ROS),而氧化应激也可促进炎症的发生发展,二者交互作用,形成恶性循环[4-5]。由于ROS与炎症信号的相互依赖性,单纯抗炎或单纯抗氧化往往效果不佳,寻找兼具抗炎和抗氧化作用的药物可能是解决问题的关键[6]。核因子E2 相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)可通过调控血红素加氧酶1(heme oxygenase 1,HO-1)、锰超氧化物歧化酶(manganese superoxide dismutase,SOD2)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX-1)等一系列抗氧化酶表达,从而清除细胞内过量ROS,减轻细胞的氧化损伤[7]。正常条件下Nrf2 存在于细胞质中且表达水平较低,但在氧化应激和抗氧化剂作用下Nrf2迅速激活,并转位至细胞核发挥转录活性[8]。二苯乙烯苷(2,3,5,4’-tetrahydroxystilbene-2-O-β-D-glucoside,TSG)是一种多羟基酚类化合物,是中药何首乌中提取的关键活性单体。研究表明,二苯乙烯苷具有较好的抗炎作用,在肠道炎症、关节炎和脂肪性肝炎防治中具有良好效果[9-10]。研究表明,二苯乙烯苷具有抗氧化活性,可抑制ROS生成,并阻断血管紧张素诱导的心脏成纤维细胞增殖[11]。此外,二苯乙烯苷可下调NADPH氧化酶介导的氧化应激,减轻小鼠缺血再灌注损伤[12-13]。查阅国内外文献发现,二苯乙烯苷发挥抗炎和抗氧化作用的内在机制并不清楚,特别是二苯乙烯苷与Nrf2抗氧化调控的研究较少。因此,本研究借助LPS 诱导的RAW264.7 巨噬细胞促炎分化模型,重点研究二苯乙烯苷对Nrf2相关抗氧化酶系统调控作用,进而探讨其抗炎抗作用机制,使人们正确认识二苯乙烯苷和中药何首乌的药理学作用,对于相关药物研发意义重大。
1 材料与方法
1.1 材料
1.1.1 主要试剂小鼠巨噬细胞系(RAW264.7)由第四军医大学毒理学教研室细胞库提供;TSG 由成都曼思特生物有限公司购买,纯度98%;LPS 和地塞米松试剂购自Sigma公司;H2DCFH-DA和Mito-SOXTM荧光探针购自Invitrogen 公司;小鼠TNF-α和IL-6 酶联免疫试剂盒购自武汉华美生物工程有限公司;寒鸦子酸(Brusatol)标准品自上海同田生物技术股份有限公司;Nrf2 抗体购自Santa Cruz 生物公司;细胞核蛋白提取试剂盒购自碧云天生物技术公司;DMEM 高糖培养液、胎牛血清、0.25%胰蛋白酶、PBS 购自上海吉诺医药生物技术有限公司。
1.1.2 仪器垂直流超净台购自ESCO,型号SCV-4A1;CO2培养箱购自Thermo 公司;全波段酶标仪购自infinite 公司,型号M200 PRO;激光共聚焦显微镜(Olympus fluo,FV10i);流式细胞仪购自BD 公司,型号Accuri C6,倒置显微镜购自Olympus 公司,型号IX7。
1.2 方法
1.2.1 RAW264.7细胞培养及实验分组小鼠巨噬细胞系(RAW264.7)培养条件为:DMEM 高糖培养基(含10%胎牛血清),置于37 ℃、CO2体积分数为5%的孵箱中。1 μg/mL LPS 处理细胞12 h,建立炎症模型[14]。药物干预组分别给予30、60和120 μmol/L二苯乙烯苷预处理4 h。同时,100 nmol/L 的地塞米松(dexamethasone,Dex)作为阳性对照药物预处理4 h。此外,为阐明Nrf2在二苯乙烯苷抗炎和抗氧化中关键作用,我们使用Nrf2 抑制剂寒鸦子酸(brusatol,50 μmol/L)与二苯乙烯苷(120 μmol/L)共同预处理4 h。本研究实验分组如表1所示。
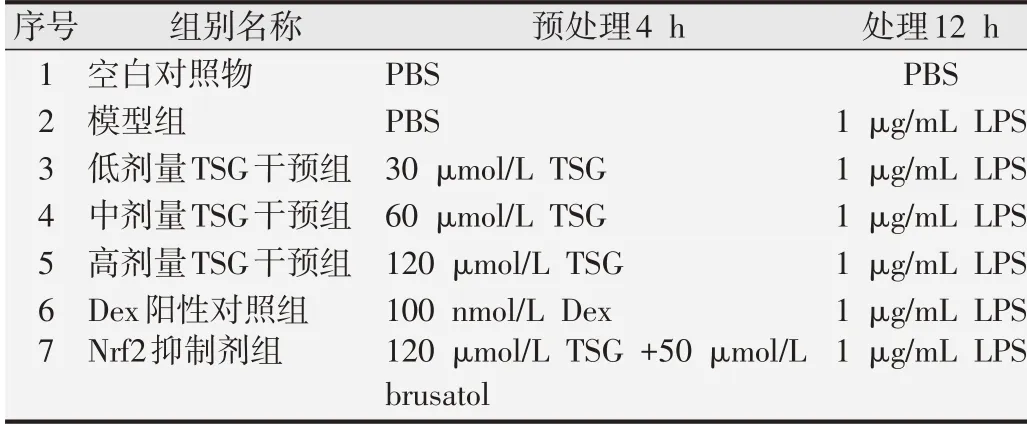
表1 实验分组及处理
1.2.2 光镜观察巨噬细胞形态并计算活化比例对照组和LPS 处理后巨噬细胞,倒置显微镜观察巨噬细胞形态。静息态巨噬细胞呈圆形,体积较小;而LPS 刺激激活的巨噬细胞胞体明显增大,且出现明显触角。因此,我们统计两组中不同形态细胞的数目,每组统计50个细胞,并计算细胞活化比例。
1.2.3 细胞炎症因子TNF-α和IL-6分泌水平检测采用酶联免疫法检测细胞培养基中TNF-α和IL-6 含量。按照实验分组1~7接种24孔板,每组重复3个样,处理完成后,采用无菌管收集细胞上清,2 000 r/min离心10 min作为待测样品。TNF-α和IL-6标准品按说明书稀释液为0、1.56、3.12、6.25、12.5、25、50、100 pg/mL,按照试剂盒说明书加入待测样品和标准品,37 ℃条件下孵育2 h,清洗后加入检测工作液,37 ℃条件下孵育30 min,酶标仪450 nm 处检测吸光度,根据标准曲线计算样品中TNF-α和IL-6浓度。
1.2.4 细胞ROS水平检测DCFH-DA是一种检测细胞内ROS总体水平的荧光探针,自身被氧化后发出绿色荧光,因此荧光越强,表示ROS 水平越高。接种RAW264.7细胞于6孔板,按实验分组1~5处理完成之后,加入终浓度为10 μmol/L的DCFH-DA,37℃条件下孵育30 min。PBS 清洗后,吹悬细胞,流式细胞仪检测绿色荧光水平。因DCFH 荧光激发波长488 nm,发射波长525 nm,选择FL1-A通道分析。
1.2.5 线粒体ROS 水平检测MitoSOXTM是一种新型线粒体靶向性荧光探针,可选择性检测线粒体内的超氧化物水平。探针可透过活细胞膜,选择性进入线粒体,继而被超氧化物特异性的氧化,发出红色荧光。接种RAW264.7细胞于6孔板,按实验分组1~5处理完成之后,加入终浓度为5 μmol/L 的MitoSOXTM,37 ℃条件下孵育30 min。PBS 清洗后,吹悬细胞,流式细胞仪检测红色荧光水平。因DCFH 荧光激发波长510 nm,发射波长580 nm,选择FL2-A通道分析。
1.2.6 免疫荧光法检测Nrf2亚细胞定位通过免疫荧光方法检测细胞内Nrf2亚细胞定位。激光共聚焦培养皿中RAW264.7 细胞生长至汇合度为70%时,给予120 μmol/L 二苯乙烯苷处理4 h。4%的多聚甲醛室温固定细胞30 min,加入0.1% TritonX-100室温条件下处理10 min。然后用5%的BSA 溶液封闭,37 ℃条件下1 h。培养皿中加入1∶100 稀释的兔来源Nrf2 一抗,37 ℃湿盒中孵育过夜。PBS 洗细胞3 次,每次5 min。用1∶100 稀释的FITC 标记羊抗兔二抗,37 ℃孵育1 h。最后加入终浓度为10 μg/mL 的DAPI,37 ℃染色30 min。PBS 洗细胞3 次,每次5 min。采用激光共聚焦显微镜检测荧光强度,FITC(绿色)选择Ex/Em:495 nm/530 nm;DAPI(蓝 色)选 择Ex/Em:340 nm/488 nm。
1.2.7 细胞核蛋白提取接种RAW264.7 细胞于6 孔板,分别给予0,30,60,120 μmol/L 二苯乙烯苷处理4 h。采用凯基细胞核提取试剂盒,按说明书进行操作:①收集2×106个细胞,加入1 mL 冰冷PBS 均浆,4 ℃条件下,500 g转速离心3 min,弃上清;②每20 μL 体积沉淀,加入200 μL 预冷的Buffer A(Buffer A∶DTT∶PMSF∶蛋白酶抑制剂=1 000∶1∶5∶5),剧烈涡旋振荡15 s,放置冰上10~15 min;③加入11 μL 冷Buffer B,最大转速涡旋剧烈振荡5 s,放置冰上1 min;④剧烈涡旋振荡5 s 后,4 ℃离心,16 000 g 转速离心5 min;⑤在沉淀(细胞核)中加100 μL 预冷的Buffer C (Buffer C∶DTT∶PMSF∶蛋白酶抑制剂=1 000∶1∶5∶5),剧烈涡旋振荡15 s,放置冰上40 min;⑥4 ℃、16 000 g转速离心10 min,即得核蛋白;⑦对提取的核蛋白进行蛋白定量(BCA法),分装并保存于-80 ℃。
1.2.8 蛋白凝胶电泳测定细胞核中Nrf2蛋白表达采用BCA法测定提取的核蛋白样品中蛋白含量,根据标准曲线计算蛋白浓度。蛋白凝胶电泳实验检测细胞核中Nrf2 蛋白表达,取定量处理后蛋白每组上样20 μg,选用10%凝胶。PCNA 作为核蛋白内参,计算标准化处理后的Nrf2相对表达水平。
1.2.9 PCR 检测细胞中抗氧化酶谱的mRNA 表达接种RAW264.7 细胞于6 孔板,给予120 μmol/L 二苯乙烯苷处理4 h。使用Trizol法提取细胞中总RNA,采用核酸定量仪检测RNA 浓度。采用TIANGEN 公司反转录试剂盒,按照说明书操作获得cDNA。小鼠GAPDH、 HO-1、 SOD2、 SOD1、 CAT、 NQO-1 和GPX-1对应的RNA引物由北京奥科鼎盛生物合成,序列如表2 所示。以cDNA 为模板,使用Tiangen 公司荧光定量PCR 试剂盒进行扩增,以GAPDH 为内参标准化,计算各组抗氧化酶谱的mRNA相对表达量。

表2 引物序列
1.3 统计学方法
实验数据以均数±标准差表示,采用方差分析和LSD t 检验进行各组间数据比较,以α=0.05 为检验水准,数据统计分析采用SPSS 13.0软件。
2 结 果
2.1 TSG抑制LPS诱导的RAW264.7细胞激活
二苯乙烯苷和脂多糖处理后RAW264.7 细胞形态学变化见图1A。RAW264.7 细胞是小鼠巨噬细胞系,正常状态下贴壁生长,形态为圆形或椭圆形,体积较小。在暴露于内毒素或不利生长环条件下,细胞会被激活并伴有形态和功能改变,主要表现为胞体增大,伸出大量伪足,形态不规则。我们统计了激活态细胞的比例,见图1B。1 μg/mL LPS 的处理12 h 后,RAW264.7 细胞激活比例达到80%,而120 μmol/L TSG 干预组仅有约20%的细胞发生形态改变。说明二苯乙烯苷可阻断LPS介导的RAW264.7细胞激活。
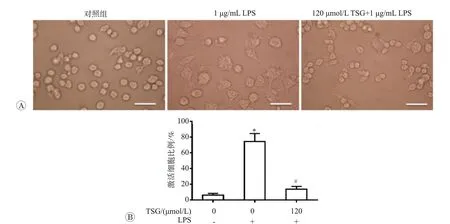
图1 二苯乙烯苷和脂多糖干预对RAW264.7细胞激活状态的影响
2.2 TSG 阻断LPS 诱导的RAW264.7 细胞炎症因子释放
巨噬细胞在内毒素等不利因素刺激下,可以释放大量促炎因子如TNF-α、IL-8、IL-6、IL-1等。我们采用ELISA法检测培养基中炎症因子IL-6和TNF-α水平,如果如图2 所示。1 μg/mL 的LPS 处理后IL-6 和TNF-α分别增加了17 倍和16 倍(P<0.05),而60 和120 μmol/L 的TSG 干预有效抑制了LPS 介导的炎症因子释放(P<0.05)。同时,我们使用100 nmol/L的Dex作为抗炎的阳性对照药物。结果发现120 μmol/L的TSG处理后抗炎效果优于地塞米松干预组(P<0.05)。上述结果表明,TSG可以有效抑制LPS诱导的炎症反应。
2.3 TSG抑制LPS诱导的RAW264.7细胞ROS升高
炎症与氧化应激密不可分炎症过程会释放大量的ROS杀伤入侵的细菌病毒。同时ROS的释放又可以进一步诱导炎症因子释放,加重炎症反应。我们采用DCFH-DA 和MitoSOXTM染色检测细胞和线粒体水平ROS 水平,结果见图3。1 μg/mL LPS 处理后细胞内DCFH-DA 和MitoSOXTM荧光强度均明显增强(P<0.05),表明细胞处于氧化应激状态。给予30、60 和120 μmol/L TSG干预后细胞和线粒体ROS均明显下调(P<0.05)。表明二苯乙烯苷具有抗氧化作用,可有效抑制LPS诱导的氧化应激。
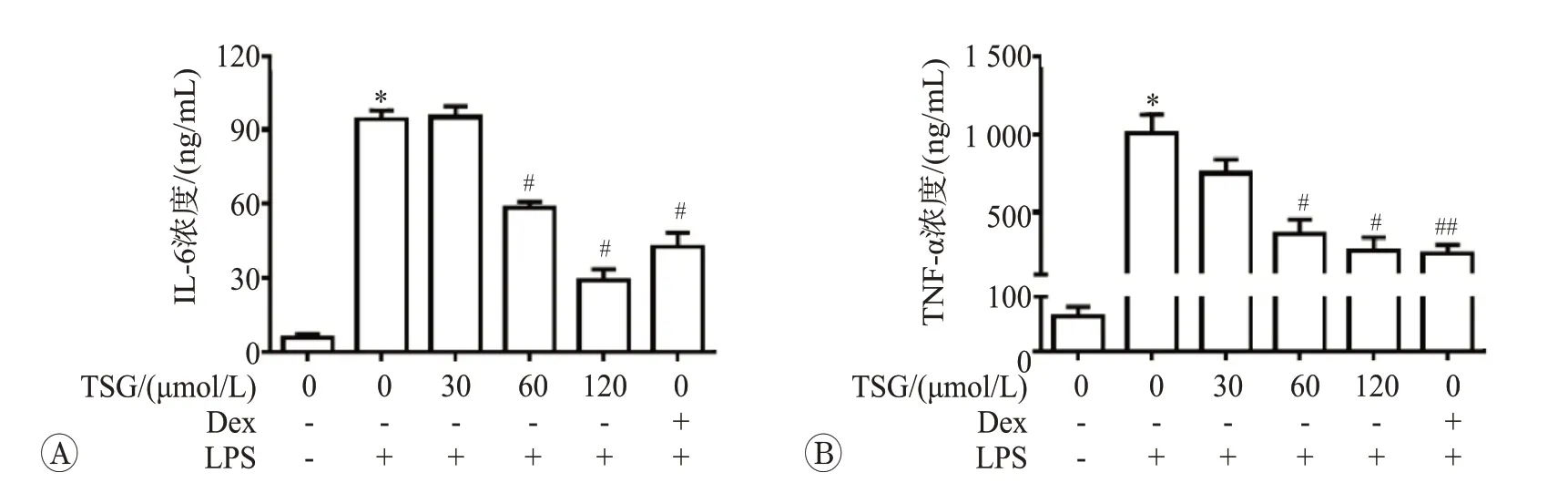
图2 二苯乙烯苷对脂多糖诱导RAW264.7细胞释放IL-6和TNF-α水平影响

图3 二苯乙烯苷对脂多糖诱导RAW264.7细胞ROS生成的影响
2.4 TSG促进Nrf2为核心的抗氧化酶系统表达
二苯乙烯苷对RAW264.7 细胞Nrf2 及其下游抗氧化酶系统影响见图4。Nrf2 是重要的氧化还原调控因子,在正常情况下表达量较低且存在于细胞质中,在ROS和抗氧化剂刺激下便可迅速转位至细胞核,通过与抗氧化原件(ARE)结合,激活下游抗氧化酶系统。免疫荧光结果表明,给予120 μmol/L TSG处理后Nrf2绿色荧光增强,且出现大量核内聚集现象(图4A)。为进一步证实TSG 是否导致了Nrf2 核转位,我们使用30、60和120 μmol/L TSG处理RAW264.7细胞,提取细胞核蛋白。如图4B 所示,Western blot 结果表明,与对照组相比,TSG 处理组细胞核中Nrf2 水平明显升高(P<0.05)。检测Nrf2 下游抗氧化酶表达发现,120 μmol/L TSG明显促进抗氧化酶HO-1、SOD2和CAT表达(P<0.05)。特别指出的是HO-1 表达增强尤为明显,是对照组的26 倍(图4C)。这些结果证明,TSG 激活了Nrf2为核心的抗氧化酶系统。
2.5 TSG的抗炎效应依赖于调控Nrf2抗氧化系统
为进一步验证Nrf2 在TSG 介导的抗炎效应中作用,我们使用Nrf2 特异性抑制剂寒鸦子酸(Brusatol)干预,并检测细胞培养基中IL-6和TNF-α的水平,结果见图5。结果表明,120 μmol/L TSG 明显抑制了LPS介导的TNF-α和IL-6释放,而给予50 μmol/L Brusatol处理,可显著阻断TSG 发挥抗炎作用。这些结果证实,TSG 介导的抗炎反应依赖于Nrf2 抗氧化系统的激活。
3 讨 论
炎症反应是机体重要的自我防御机制,当机体遭遇病原体侵袭或创伤时,会招募免疫细胞到感染位点并释放炎症因子,清除病原菌。但是炎症失控也会引起一系列的病理反应,如严重的感染、败血症、阿尔茨海默氏症、动脉粥样硬化、2 型糖尿病和肿瘤等。巨噬细胞是机体内重要的炎症效应细胞,可以通过吞噬作用和释放炎症因子发挥免疫效应。RAW264.7 细胞是小鼠来源巨噬细胞系,正常情况下为圆形,体积较小。脂多糖刺激后胞体明显增大,形成大量伪足,形态不规则[15]。我们的研究也证实,脂多糖刺激后RAW264.7 细胞发生显著的形态学改变,激活形态的细胞比率增加。TNF-α和IL-6 既是重要的炎性介质,也可激活其他细胞因子的合成释放。LPS 刺激后培养基中TNF-α和IL-6水平明显升高,这表明LPS促进了巨噬细胞的活化和炎症反应过程。
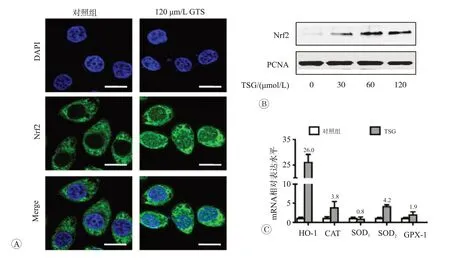
图4 二苯乙烯苷对RAW264.7细胞Nrf2及其下游抗氧化酶系统影响
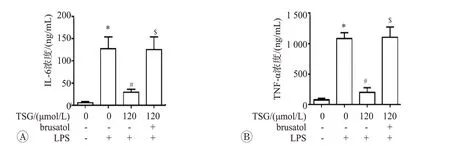
图5 二苯乙烯苷调控的抗炎效应依赖于Nrf2通路的激活
二苯乙烯苷是一种多羟基酚类化合物,是中药何首乌的主要活性成分。大量研究表明,二苯乙烯苷具有广泛的生物学作用,具有神经保护、抗衰老、抗血脂、抗动脉粥样硬化以及抗肿瘤的功能[16-18]。炎症在上述疾病的发生和发展过程中均发挥关键作用,但二苯乙烯苷介导抗炎作用及相关机制并不清楚。我们前期研究发现,二苯乙烯苷可抑制亚硝胺诱导的肝毒性,减轻肝脏炎症和DNA损伤[19]。而在本研究中,二苯乙烯苷预处理可抑制LPS 诱导的小鼠巨噬细胞活化,降低培养基中TNF-α和IL-6水平,且在一定剂量范围内呈现剂量效应关系。与地塞米松阳性对照药物相比,二苯乙烯苷表现出了良好的抗炎效果,有望作为一种抗炎药物使用。
炎症和氧化应激密不可分,炎症可以导致ROS的大量生成,ROS也会促进NFκB和COX2等炎症转录因子的激活,二者形成级联反应[20]。因此,氧化应激是巨噬细胞激活和炎症反应中的关键事件,而抑制ROS生成或者给予抗氧化剂可阻断LPS 等诱导的巨噬细胞炎症因子增多[21-22]。本研究中我们也发现,LPS刺激后RAW264.7 细胞和线粒体水平ROS 生成显著增多,而二苯乙烯苷干预后细胞中的ROS明显降低,提示二苯乙烯苷的抗炎效应可能与其清除细胞内ROS 能力相关。Nrf2 为核心的抗氧化系统,可通过激活HO-1、SOD2、SOD1、CAT、NQO-1 和GPX-1。等抗氧化酶谱表达,有效保护细胞应对多种不利性刺激造成的氧化损伤[23]。Nrf2 缺失可加剧血管紧张素II 诱导的炎症反应和心肌损伤[24]。Nrf2 信号通路激活在叶黄素、乌司他丁和天青素等介导的抗炎反应中发挥关键作用[25-26]。我们发现二苯乙烯苷可诱导Nrf2 蛋白水平的上调和核转位,并激活了下游HO-1、SOD2和CAT表达。其中,HO-1 升高最为显著,约为对照组的26倍。研究表明,HO-1 及其代谢产物胆红素和一氧化碳具有显著的抗氧化和抗炎作用,过表达HO-1 可抑制TNF-α诱导的气道炎症[27]。安石榴苷也可通过激活Nrf2/HO-1 表达抑制LPS 诱导的巨噬细胞促炎因子升高[28]。为进一步证明二苯乙烯苷是通过激活Nrf2 通路发挥抗炎效应,我们使用Nrf2 活性抑制剂Brusatol 与TSG共处理,发现Brusatol可逆转二苯乙烯苷介导的抗炎作用。这表明二苯乙烯苷可显著增强Nrf2及其下游抗氧化酶活性,可清除LPS 诱导巨噬细胞生成的ROS,降低炎症因子表达。
氧化应激是炎症反应的重要组成部分,因此在治疗全身炎症反应综合征及慢性炎症性疾病时不可忽视抗氧化应激的治疗[6,22]。联合使用抗氧化类和抗炎类药物是治疗炎性疾病的关键,这种观点受到越来越多基础研究和临床应用的支持。作为何首乌的主要活性成分,二苯乙烯苷刺激通过Nrf2表达及核转位,激活下游HO-1、SOD2和CAT等抗氧化酶表达,最终发挥了较好的抗氧化和抗炎作用。本研究明确了二苯乙烯苷的抗炎和抗氧化分子机制,指出了炎症相关疾病的预防和治疗新的思路,也为何首乌相关中药开发提供了理论支撑。
