1,25-二羟基维生素D3对PM2.5所致HBE细胞氧化损伤的保护作用
2020-04-09孙娇娇车碧众罗秋林翟兵中信丽丽
孙娇娇,车碧众,罗秋林,翟兵中,信丽丽*
(苏州大学医学部公共卫生学院,江苏 苏州215123)
近年来,随着雾霾天气的频发,大气颗粒物对健康造成的危害已成为全球公共卫生领域关注的焦点。细颗粒物(fine particulate matter,PM2.5)是指空气动力学直径≤2.5 μm 的颗粒物,其粒径小、比表面积大,且易吸附有毒有害物质并能沉积在呼吸系统深部,甚至可穿透肺泡到达血液循环系统,从而对机体产生健康损害效应。研究发现,PM2.5可引起活性氧自由基(reactive oxygen species,ROS)生成、炎症因子释放及胞内抗氧化酶活性下降,从而导致细胞内氧化-抗氧化系统失衡。氧化-抗氧化系统紊乱可进一步诱发蛋白质变性和脂质过氧化,进而损伤溶酶体、线粒体等细胞器,导致细胞功能障碍,进而损伤呼吸系统[1]。近年来,多项研究发现,维生素D作为机体内重要的维生素,不仅可发挥经典的钙磷调节作用,还可参与调控细胞氧化应激损伤。研究表明,包括呼吸道上皮细胞在内的几乎所有真核细胞均可表达维生素D受体(vitamin D receptor,VDR),且胞内存在1α-羟化酶,可通过自分泌和旁分泌的方式在局部合成活性维生素D3[1,25-(OH)2D3][2]。1,25-(OH)2D3可参与调节机体炎症反应和细胞增殖活性等,帮助维持机体氧化和抗氧化系统的平衡,保护细胞内蛋白质和细胞膜免受氧化损伤,以此减轻多种应激因素对细胞的损伤效应[3-4]。HBE细胞来源于正常人的支气管上皮细胞,在原代培养时经转染而永生化,现被广泛用于支气管上皮细胞和呼吸系统的研究。因此,本研究采集苏州市工业园区居民生活区大气中PM2.5颗粒物,并以HBE细胞为实验对象。PM2.5混悬液染毒和1,25-(OH)2D3干预后,分别测定细胞存活率、MDA 含量、GSH/GSSG 比值和抗氧化蛋白的表达水平,探讨1,25-(OH)2D3对PM2.5所致细胞氧化损伤可能的保护作用。
1 对象与方法
1.1 仪器与试剂
细胞恒温培养箱,购于美国Thermo 公司;CKX41SF 型倒置显微镜,购于日本Olympus 公司;粉尘采样器GilAir-5,购于美国Sensidyne 公司;多功能酶标仪Synergy 2,购于美国Bio-Tek 公司;G:BOX Chemi XRQ 凝胶成像仪,购于英国Syngene 公司;DMEM 高糖培养基,购于美国HyClone 公司;胎牛血清,购于中国碧云天生物技术有限公司;无水乙醇,购于中国国药集团化学试剂有限公司;1,25 二羟基维生素D3,购于美国Sigma-Aldrich 公司;Cell Counting Kit-8(CCK-8),购于中国碧云天生物技术有限公司;丙二醛(malondialdehyde,MDA)测试盒,购于中国南京建成生物工程研究所;GSH/GSSG-GloTM试剂盒,购于美国Promega公司。
1.2 PM2.5采集和成分分析
在苏州市工业园区居民生活区用TH-150C中流量大气采样器将空气中的PM2.5采集于Teflon滤膜上,采样流量为100 L/min,采样时间为8 h,连续采样1周,取单日PM2.5浓度最高的样品进行后续毒理学检测实验。对本次采集的PM2.5进行成分分析,发现其粒径主要集中分布在0.1~0.2 μm 范围内,无机元素Mg、Al、Cu、Zn 和Pb 的含量较高,其中Al 浓度最高为348.78 ng/m3,Cu为222.58 ng/m3;水溶性离子浓度μg/m3, CCl-=4.5 μg/m3, CK+=0.9 μg/m3, CNa+=0.4 μg/m3;此外,对该样本中的多环芳烃进行定量分析,共检测到25 种多环芳烃,其中荧蒽浓度最高为11.033 ng/m3,芘为9.213 ng/m3,菲为7.385 ng/m3[5]。
1.3 PM2.5混悬染毒液的制备
用超纯水洗脱滤膜,冰水浴超声4 h。真空冷冻干燥并称重后,将PM2.5颗粒物置于超净台紫外线灯下照射过夜。PBS 溶解并涡旋混匀后获得PM2.5混悬储备液(每毫升PBS中含有20 mg PM2.5颗粒物)。
1.4 1,25-(OH)2D3溶液制备
将0.1 mg 1,25-(OH)2D3(相对分子质量为416.64)溶解于1 mL 95%的乙醇中,得到浓度为2.4×10-4mol/L的1,25-(OH)2D3溶液。然后,将100 μL 1,25-(OH)2D3溶液加入到23.9 mL 95%乙醇中,得到浓度为1×10-6mol/L的1,25-(OH)2D3储备液,-20 ℃避光保存。
1.5 HBE细胞培养与处理
将HBE细胞接种于培养皿中,加入含10%胎牛血清的DMEM 高糖培养基,于37 ℃、CO2体积分数为5%、饱和湿度的细胞恒温培养箱中培养。取对数生长期的细胞,随后均匀接种到96 孔板(用于细胞存活率和GSH/GSSG 比值测定)和6 孔板(用于MDA 浓度和蛋白表达水平测定)。
1,25-(OH)2D3的细胞干预实验研究中,一般采取的是1×10-7、1×10-8(最接近人体内维生素D水平)和1×10-9mol/L 三种浓度。而我们的预实验结果发现1×10-8mol/L 1,25-(OH)2D3可将HBE 细胞存活率降低至80%左右,在此基础上,我们参照以往的多项研究选择了1×10-9mol/L作为本研究的干预剂量。
根据处理因素不同将细胞分为4组:溶剂(乙醇)对照组、1,25-(OH)2D3干预组、乙+PM2.5染毒组、PM2.5染毒+1,25-(OH)2D3干预组。溶剂对照组细胞用0.1%乙醇处理48 h,1,25-(OH)2D3干预组用1×10-9mol/L 的1,25-(OH)2D3处理48 h,乙醇+PM2.5染毒组用0.1%乙醇溶剂处理24 h 后更换为含乙醇的PM2.5(200 μg/mL)染毒液继续处理24 h,PM2.5染毒+1,25-(OH)2D3干预组用1×10-9mol/L 1,25-(OH)2D3预处理24 h 后更换为含1,25-(OH)2D3的PM2.5(200 μg/mL)染毒液继续处理24 h,每组设立3个平行样。
1.6 细胞存活率测定
采用CCK-8 试剂盒测定96 孔板中细胞存活率。以对照组细胞为参照,计算染毒组细胞的相对存活率。
染毒组细胞相对存活率/%=D(450)染毒组/D(450)对照组×100%
1.7 MDA浓度测定
采用细胞MDA 试剂盒测定细胞裂解液中MDA 浓度。按照试剂盒的方法进行操作,结果计算时需用不同组细胞的蛋白浓度进行校正。MDA 浓度用nmol/mL来表示。
1.8 谷胱甘肽含量测定
采用GSH/GSSG-GloTM试剂盒测定GSH/GSSG 的比值。具体方法为:PM2.5染毒结束后弃去染毒液,每孔加入50 μL GSH 或GSSG 裂解液,室温振荡混匀5 min。然后,每孔均加入50 μL 荧光素生成试剂,室温振荡混匀30 min。随后,每孔加入100 μL 荧光素检测试剂。室温平衡15 min 后,使用Synergy 2 多功能酶标仪测定细胞的化学发光值(luminscence,用RLU表示)。所有处理细胞组减去无细胞对照组的平均背景发光值,以得到每个处理组细胞的净发光值。
GSH/GSSG 比值=(总GSH 净发光值-GSSG 净发光值)/(GSSG净发光值/2)
1.9 Western blot检测
提取各组细胞总蛋白,BCA法测定蛋白浓度。参照试剂盒(SDS-PAGE凝胶配制试剂盒,碧云天)操作说明配制SDS-PAGE 凝胶,电泳结束后湿转至硝酸纤维素膜上,5%脱脂奶粉常温封闭1 h,一抗4 ℃孵育过夜,TBST 振荡洗涤,二抗37 ℃振荡孵育1 h。TBST振荡洗涤后滴加化学发光试剂,用G:BOX Chemi XRQ 凝胶成像仪进行显影并采用Image J 软件进行灰度值分析。
1.10 统计学分析
用SPSS 17.0 统计软件进行统计分析。多组间比较采用单因素方差分析,两两比较采用LSD法,以α=0.05为检验水准。
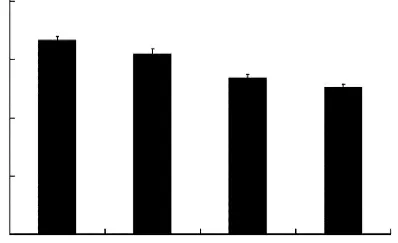
图1 1,25-(OH)2D3对PM2.5所致HBE细胞存活率的影响
2 结 果
2.1 1,25-(OH)2D3降低HBE细胞存活率
CCK-8 试剂盒检测各组细胞存活率的结果见图1。与对照组相比,1,25-(OH)2D3处理组HBE细胞的存活率下降;PM2.5染毒HBE 细胞24 h 后,细胞的存活率也显著下降(P 均<0.01)。然而,与PM2.5染毒组相比,1,25-(OH)2D3干预处理并不能改善PM2.5对细胞增殖的抑制作用,反而进一步降低了细胞的存活率(P<0.01)。
2.2 1,25-(OH)2D3改善PM2.5诱导的细胞氧化应激状态
用MDA 试剂盒和GSH/GSSG-GloTM试剂盒分别测定MDA浓度和GSH/GSSG比值,来反映细胞的氧化与抗氧化水平,结果见图2。与对照相比,PM2.5染毒后,细胞MDA 的浓度显著增加(P<0.05,图2A),而GSH/GSSG 的比值却明显降低(P<0.01,图2B)。然而,1,25-(OH)2D3处理可降低MDA 水平并可增加细胞的GSH/GSSG 比值(P<0.05)。此外,PM2.5染毒的细胞经1,25-(OH)2D3处理48 h 后,MDA 浓度明显降低,GSH/GSSG 比值显著增加,且其指标的差异有统计学意义(P<0.05)。以上结果显示,1,25-(OH)2D3可降低PM2.5所致HBE细胞的氧化应激水平。
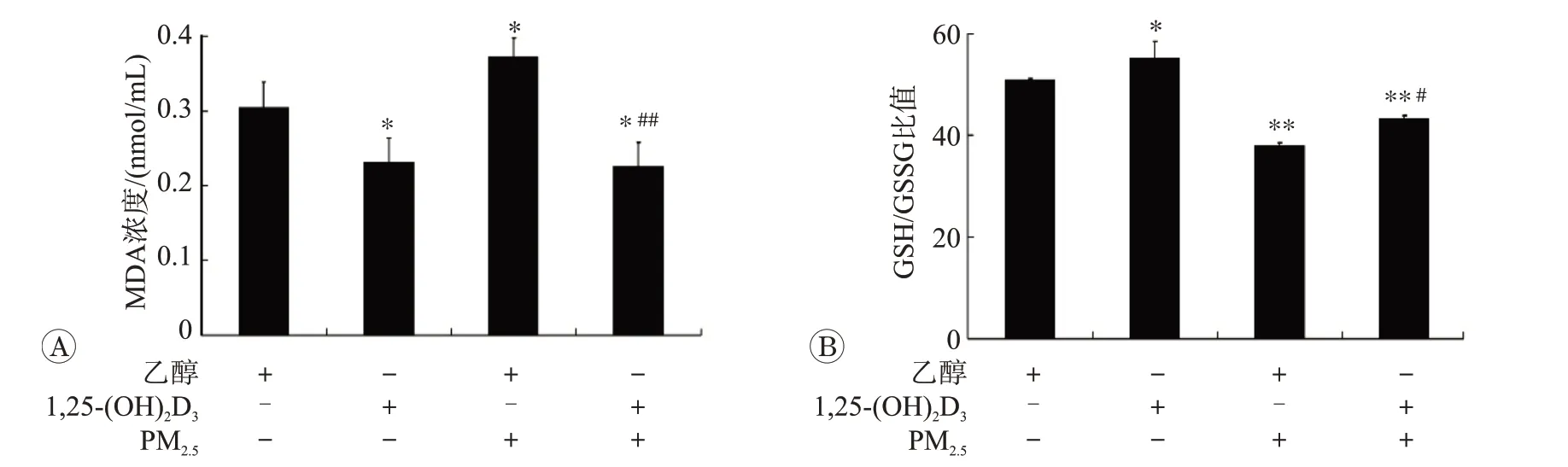
图2 1,25-(OH)2D3对PM2.5所致HBE细胞氧化和抗氧化水平的影响
2.3 1,25-(OH)2D3上调HBE细胞Nrf-2和HO-1蛋白的表达
Western blot实验的条带和灰度值分析结果分别见图3 和图4。与对照组相比,1,25-(OH)2D3处理48 h后,HBE 细胞VDR 的表达水平明显增加(P<0.01)。PM2.5染毒后HBE 细胞内发挥重要抗氧化作用的Nrf-2和HO-1 蛋白的表达水平均明显升高,差异有统计学意义(P<0.05)。1,25-(OH)2D3干预后,可发现HBE细胞内Nrf-2 和HO-1 的表达也显著增加(P<0.05 或0.01),但与乙醇+PM2.5染毒细胞组相比,蛋白表达水平的改变并无统计学差异。

图3 1,25-(OH)2D3对PM2.5所致HBE 细胞Nrf-2、HO-1 和VDR 蛋白表达的影响
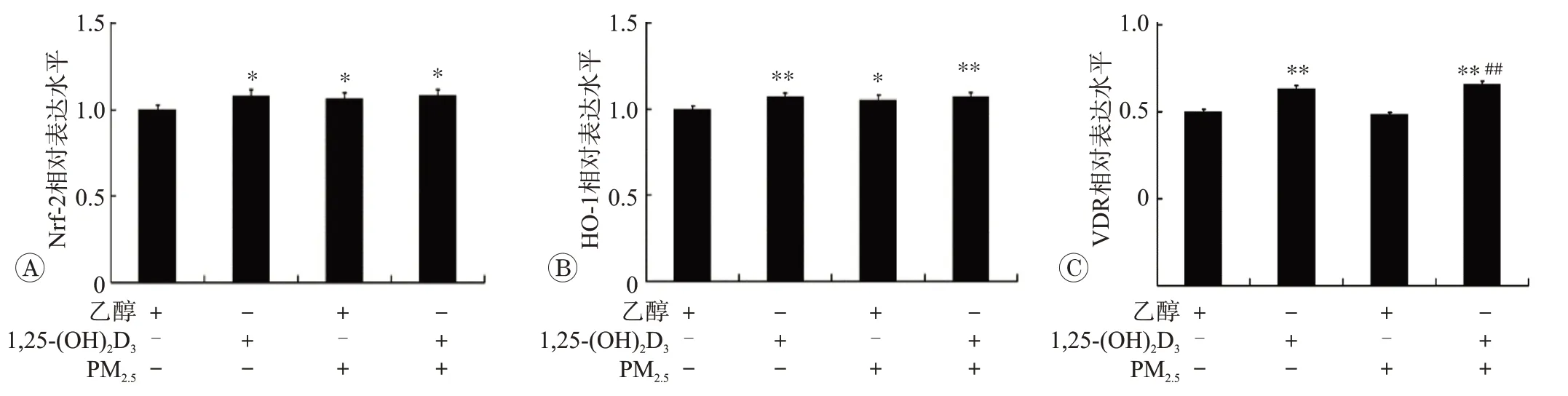
图4 1,25-(OH)2D3对PM2.5所致HBE细胞Nrf-2、HO-1和VDR蛋白的相对表达水平的影响
3 讨 论
PM2.5主要来源于汽车尾气、道路灰尘以及工业生产废气的排放,被吸入人体后,可沉积在支气管、细支气管和肺泡,并造成肺部损伤,而其成分中危害较大的主要是重金属离子、多环芳烃和硫酸盐等[6]。大量研究表明,氧化应激是PM2.5造成机体损伤的重要机制之一[7]。作为机体内重要的类固醇类激素,维生素D发挥着重要作用。除经典的钙磷调节作用外,维生素D 可在多种细胞和组织中发挥抑制细胞增殖、诱导分化、抑制血管生成和促进细胞凋亡等广泛的骨外生物学效应[8-9]。此外,维生素D还可通过上调内源性抗氧化系统清除细胞内过氧化物而降低细胞氧化应激水平[10]。因此,本研究从1,25-(OH)2D3可降低细胞氧化应激水平的角度出发,探讨其对PM2.5所致HBE细胞氧化损伤的潜在保护作用。我们的研究结果发现,PM2.5可诱导HBE细胞氧化损伤,主要表现为脂质过氧化水平升高、GSH/GSSG比值下降和抗氧化蛋白Nrf-2与HO-1 表达水平增加。在PM2.5所致细胞氧化应激效应中,1,25-(OH)2D3对细胞起到了一定的保护作用,这可能与VDR及Nrf-2/HO-1信号通路有关。
我们对所采集的居民生活区PM2.5颗粒物样本进行成分分析后发现,Mg、Al、Cu、Zn 等金属元素的含量较高,并可检测出较高浓度的多环芳烃类物质[5]。研究表明,PM2.5中含有Fe、Pb、Al、Mn、Zn 等多种共价金属,可参与氧化还原反应并诱导自由基的生成[11-12]。此外,颗粒物表面吸附的多环芳烃类物质也可经酶促反应代谢活化而诱导生成ROS[13-14]。当过量的ROS 超过机体抗氧化系统对自由基的清除能力时,细胞氧化还原的平衡状态将会被打破,从而产生氧化损伤效应[15]。我们的研究结果发现,PM2.5可诱导HBE细胞出现氧化损伤,主要表现为MDA 浓度的升高和GSH/GSSG 比值的降低,这与以往的研究结果基本一致[16]。而结合我们PM2.5样本的成分分析结果,PM2.5上附着的有机多环芳烃及过渡金属成分可能是引起HBE细胞氧化损伤的重要原因。此外,1,25-(OH)2D3处理48 h可显著降低PM2.5所诱导的细胞氧化应激水平,与乙醇+PM2.5染毒组细胞相比,1,25-(OH)2D3+PM2.5处理组细胞内MDA 浓度明显降低,GSH/GSSG 比值也显著增加。以上结果表明,1,25-(OH)2D3可降低细胞脂质过氧化水平,并显著提升HBE细胞的抗氧化水平。然而,与对照相比,1,25-(OH)2D3却显著降低了HBE 细胞的存活率,而对于PM2.5染毒组细胞,1,25-(OH)2D3的干预也进一步降低了细胞的存活率。以往的研究表明[17-18],维生素D 有对小鼠成骨细胞和软骨细胞增殖及人脐带间充质肝细胞增殖都具有抑制作用,且1,25-(OH)2D3可通过诱导细胞周期阻滞或促进细胞凋亡而降低细胞的存活率和增殖活性[19-20]。因此,我们推测,本研究中1,25-(OH)2D3所致细胞存活率的降低可能与其诱导细胞周期阻滞及促进PM2.5所诱导的已损伤细胞的凋亡有关,但具体的研究机制有待进一步阐明。
研究发现,1,25-(OH)2D3可通过以下几种途径降低氧化应激对细胞造成的损伤:①1,25-(OH)2D3可通过抑制多种炎性因子合成及其生物活性来抑制炎症反应,进而阻止氧化应激状态下过量生成的ROS和炎症反应形成的恶性循环[21];②因其与细胞膜结构类似,1,25-(OH)2D3在细胞膜中积累可增强细胞膜流动性,保护细胞膜免受自由基引起的氧化损伤[22];③1,25-(OH)2D3还可通过增加细胞内的超氧化物歧化酶与过氧化氢酶等抗氧化酶的活性而降低细胞的氧化应激水平。我们的结果表明,PM2.5染毒后,抗氧化蛋白Nrf-2 与HO-1 表达水平均明显升高。1,25-(OH)2D3可显著上调VDR 受体的表达水平,但对PM2.5染毒组细胞内Nrf-2 与HO-1 的蛋白表达水平的上调幅度较小。这提示我们,PM2.5所致细胞氧化损伤及1,25-(OH)2D3的干预作用可能与VDR 受体的激活及Nrf-2 介导的防御机制的激活有关。研究发现,1,25-(OH)2D3进入细胞后可与VDR的配体区结合,转运至细胞核与靶基因的VDR反应元件结合而调节多种氧化应激相关基因的转录和表达。Keap1-Nrf2-ARE 通路是PM2.5诱导细胞氧化应激的关键通路之一,氧化应激状态下,Nrf2将转移到细胞核,启动下游HO-1 基因的表达。Nfr2/HO-1 信号轴可以通过抗氧化、抑制线粒体的结构和功能障碍等作用来抵御氧化应激带来的细胞损伤[23]。因此,本研究中1,25-(OH)2D3对PM2.5所致HBE 细胞氧化损伤的保护作用可能与VDR 及Nrf-2/HO-1 通路的激活有关,但具体机制仍需深入研究。
综上所述,PM2.5可诱导HBE 细胞产生氧化损伤,并导致脂质过氧化终产物MDA 浓度的升高和GSH/GSSG 比值的降低。此外,1,25-(OH)2D3干预可在一定程度上降低PM2.5所致HBE细胞的氧化损伤,且该过程可能与VDR及Nrf2/ HO-1通路的激活有关。
