玉米秸秆固态和液态厌氧发酵产气性能与微生物种类比较研究
2020-04-09韦秀丽
蒋 滔,韦秀丽,肖 璐,刘 科,张 凯,李 平,王 冰
·农业资源循环利用工程·
玉米秸秆固态和液态厌氧发酵产气性能与微生物种类比较研究
蒋 滔1,韦秀丽1,肖 璐1,刘 科2,张 凯2,李 平1,王 冰1※
(1. 重庆市农业科学院,重庆 401329;2. 农业部农村可再生能源开发利用南方科学观测实验站,重庆 401329)
厌氧发酵产沼气是中国绿色农业发展过程处理农业废弃物的重要手段,该文以玉米秸秆为研究对象,开展液态、固态厌氧发酵产气性能、微生物系统多样性及演替规律的比较研究,得出如下结论:固态发酵总固体(TS)产气率及甲烷转化率略低于液态发酵,发酵结束后,前者沼液中N、P、C的含量要低于后者;乙酸是两发酵体系挥发性脂肪酸(VFAs)的主要组成,占总VFAs的70%以上。高通量测序结果发现,2个发酵系统中细菌主要以、、、、及为主,这6类菌群占总克隆数的80%以上。而,,以及是两系统优势古菌,并且随消化过程的进行,古菌群落呈现由乙酸型向氢营养型转变的趋势。发酵结束后,上述2类古菌在群落中的占比基本持平。对微生物多样性的聚类分析结果显示,在发酵第4天和第8天后,2个系统中细菌与古菌群落结构的差异逐渐明显。进一步分析表明,影响玉米秸秆液态发酵微生态结构的主要环境因子为乙酸,秸秆纤维素水解可能是制约物能转化率的关键过程;总磷(TP)是影响固态发酵系统微生态结构的关键环境因子,而如何增加产甲烷古菌的生物量是提高原料产气率的关键。该研究结果为调控玉米秸秆厌氧发酵过程、提高其生物降解效率提供了科学依据。
秸秆;发酵;甲烷;玉米秸秆;固态厌氧发酵;液态厌氧发酵;微生物群落
0 引 言
厌氧发酵生产沼气是中国绿色农业发展过程处理农业废弃物的重要手段[1],不仅解决了农村燃料短缺问题[2],而且实现了废弃物无害化处理及多层次资源化利用[3-4]。厌氧发酵按底物含固率不同可分成液态厌氧发酵(L-AD,TS<15%)和固态厌氧发酵(SS-AD,TS≥15%)[5]。L-AD料液流动性好,便于输送和搅拌,传热传质效果好,产生的沼气释放快,有利于厌氧生物过程的快速进行[6]。而SS-AD具有容积产甲烷率高、系统保温-加热的能量需求低、沼液产量少、沼渣水分低且易处理等优点[7],是国内外研究热点。目前中国秸秆沼气工程仍以L-AD为主,SS-AD在江苏、黑龙江等地都有较为成功的工程案例。研究证明,接种来自L-AD的沼液可以成功启动SS-AD,它可以提供丰富的微生物,水分及营养元素[8]。SS-AD的物能转化率与底物/接种物比(S/I比)相关,该值越低,系统稳定性越好,缓冲能力越强,有机物利用率越高[9];当S/I值为2时,秸秆SS-AD可获得最高的甲烷产量[10],而当底物/接种物大于4.4,系统酸化的风险较高[11]。秸秆厌氧发酵系统微生物多样性研究表明,细菌类的(厚壁菌门)、(拟杆菌门)、(变形菌门)是主要的优势种群[12];甲烷古菌主要隶属(广古菌门),包括(甲烷杆菌属)、甲烷鬃菌属等[13]。发酵温度、底物类型、接种物来源等宏观调控均会对秸秆厌氧发酵微生态结构产生影响,而微观上厌氧微生物种类及演替过程又会反作用于系统挥发性脂肪酸(VFAs)、甲烷产量等发酵系统的宏观指标。但目前固、液态秸秆厌氧发酵微生物群落结构的微观规律性及特异性差异尚不明晰,发酵代谢产物(如VFAs、产气量)与微生态系统之间的关联性尚待研究。
本文以玉米秸秆为研究对象,应用分子生物学手段对L-AD、SS-AD系统微生物多样性及演替规律进行比较研究;利用生态因子综合分析法,揭示2种发酵系统宏观环境因子与微观生态结构之间的相关性,以期为更好的调控玉米秸秆厌氧发酵过程、提高其生物降解效率提供依据。
1 材料与方法
1.1 试验材料
玉米秸秆采自重庆市白市驿镇九里村农田,采集后用清水洗净,自然风干后,将其剪短至2~5 cm,置干燥箱中55 ℃烘6 h;厌氧消化液取自猪场沼气罐,并测定各自的理化指标(见表1)。
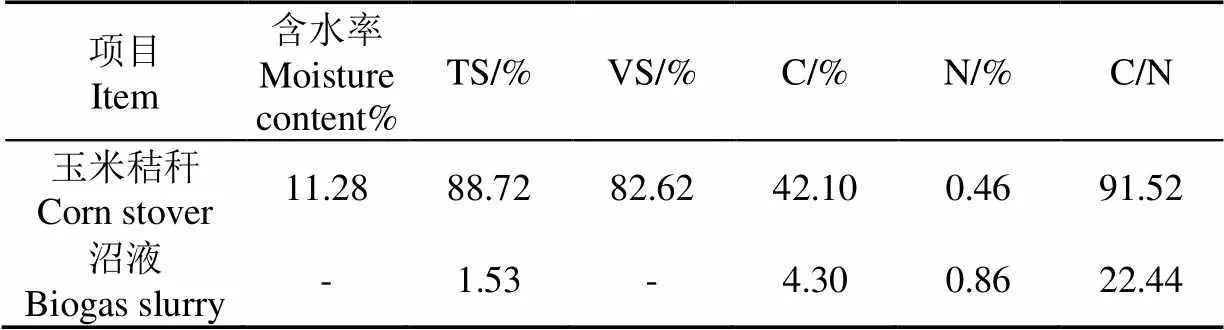
表1 玉米秸秆及沼液主要理化指标
1.2 试验设计
试验分别在固态、液态发酵2种装置中进行,其中液态发酵装置为全混式厌氧反应罐,固态发酵装置为渗滤床反应器[14]。先将320 g玉米秸秆分别放入6个8 L的恒温厌氧反应器中,加入2 L稀释后的沼液,拌匀使秸秆完全浸润,盖上罐盖以减少沼液的蒸发,每天人工翻堆一次,保持微好氧状态,7 d预处理结束后进行厌氧消化实验。分别在3个液态发酵罐中加入4 L完全发酵后的沼液,控制TS浓度约5%;另外3个固态反应器中加入2.5 L沼液,在秸秆床渗滤作用下,发酵TS浓度约为15%,每隔2 h将渗滤后的沼液回流喷淋一次。利用循环水浴控制发酵温度为35 ℃,沼气通过5 L铝箔集气袋收集,每种处理做3次重复。定期采集发酵过程中的沼液进行理化指标及微生物多样性分析。
1.3 理化指标测定
沼液pH值采用台式pH计(PHSJ-4F)测定,每次测量前用pH值为6.86和9.18的标准液校准。总氮(TN)及总有机碳(TOC)采用multi N/C®2100总碳总氮分析仪测定;总磷(TP,以P计)采用过硫酸钾氧化-钼锑抗分光光度法测定;乙酸、丙酸、丁酸及戊酸通过气相色谱(Agilent 7820A)进行定量分析。沼气中CH4及CO2体积分数采用GEM 2000 plus便携式沼气分析仪测定,使用前用标准气体进行校正;产气量采用100 mL的针筒抽取测定。
1.4 微生物多样性测定
沼液离心沉淀后,弃上清液,采用mobio土壤微生物DNA提取试剂盒PowerSoil®DNA Isolation Kit 进行提取。PCR所用引物为覆盖16S rRNA基因V3+V4区域的细菌、古菌通用引物338F(5′- ACTCCTACGGGAGGCAGCA-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)以及Arch349F(5′-GYGCASCAGKCGMGAAW-3′)、Arch806R(5'-GGACTACVSGGGTATCTAAT-3')这对引物对细菌和古菌的覆盖率很高,可准确反映微生物群落的多样性结构[15-17]。扩增产物通过琼脂糖凝胶电泳,试剂盒回收,分别采用NanoDrop及Agilent2100测定DNA纯度及浓度[18],最后按等摩尔比例混合成测序文库,混合好的16S rRNA扩增子文库用Hiseq2500测序仪测序(Illumina Inc., San Diego, CA)。
1.5 数据处理与统计分析
通过QIIME平台去除原始数据中的低质量序列,根据标签序列区分来自不同样品的序列[19-20]。利用Uchime软件去除PCR过程中形成的嵌合体[21],获得的高质量序列用Usearch方法进行聚类[22-23],以16S rRNA序列97%相似度作为分类操作单元(operational taxonomic units,OTUs)的划分标准。Coverage覆盖度、Chao1丰度和Shannon多样性指数的计算在QIIME平台上完成,通过RDP Classifier 鉴定OTU 代表性序列的微生物分类地位(80%置信水平)[24]。用非加权平均算法(UPGMA)分析样品之间的微生物群落结构差异,利用Canoco 5.0软件对微生物群落与理化指标之间的关联性进行冗余分析(RDA)。
2 结果与分析
2.1 产气量及物能转化率
如图1所示,L-AD及SS-AD日产沼气均呈“双峰”趋势。发酵开始的第2天,两发酵系统出现产气峰值,其主要成分为N2及CO2(体积分数约为38%),但L-AD的CH4体积分数在发酵第3天便达到33.9%,高于SS-AD的17.8%。L-AD在第11~16天达到产气高峰期,平均日产气2 190 mL,平均CH4体积分数57.4%;SS-AD在第15~22天进入产气高峰期,平均日产气2 890 mL,平均CH4体积分数为51.5%。37 d发酵过程中,L-AD平均累积产气量52 500 mL,其中CH4产量24 442 mL;SS-AD平均总产气48 295 mL,其甲烷产量21 078mL;计算所得玉米秸秆L-AD平均TS产气率为184.9 mL/(g·d),产甲烷率86.1 mL/(g·d);SS-AD的平均TS产气率为170.1 mL/(g·d),产甲烷率74.2 mL/(g·d)。初步得出如下结论:1)SS-AD产气高峰较L-AD晚4 d左右;2)SS-AD的TS产气率略低于L-AD;3)高峰期SS-AD系统CH4含量低于L-AD。
2.2 基本理化指标
图2、图3分别描述了L-AD、SS-AD沼液pH、TP、TN以及TOC的时序变化特征。结果表明,2个系统的pH值呈现先下降、后上升、而后趋于稳定的整体趋势,在发酵第6天基本达到最低值,其中SS-AD平均pH值略低于L-AD,其最低值约6.4。TP及TOC呈现先上升后趋势下降的态势,而TN则呈现先下降、后上升,而后振荡下降的特征。进一步分析可知,酸化水解阶段秸秆中有机物的溶出提高了沼液中TP及有机质的含量,而此阶段系统尚未完全厌氧,为反硝化脱氮创造了条件。当系统进入产甲烷阶段,沼液中P浓度的降低可能因沉积、吸附作用所致。此阶段伴随脱C产气过程的进行,沼液中TOC浓度下降,而N浓度则受微生物增殖N消耗速率及秸秆降解N补充速率共同影响[25]。发酵结束后,两系统pH值基本稳定在7.2~7.4之间,SS-AD沼液中TP、TN以及TOC浓度较初期分别下降73.0%,44.0%及27.1%,L-AD则分别下降了40.9%,3.0%和-42.8%。两者相比较,玉米秸秆SS-AD沼液中N、P以及C的含量要低于L-AD。
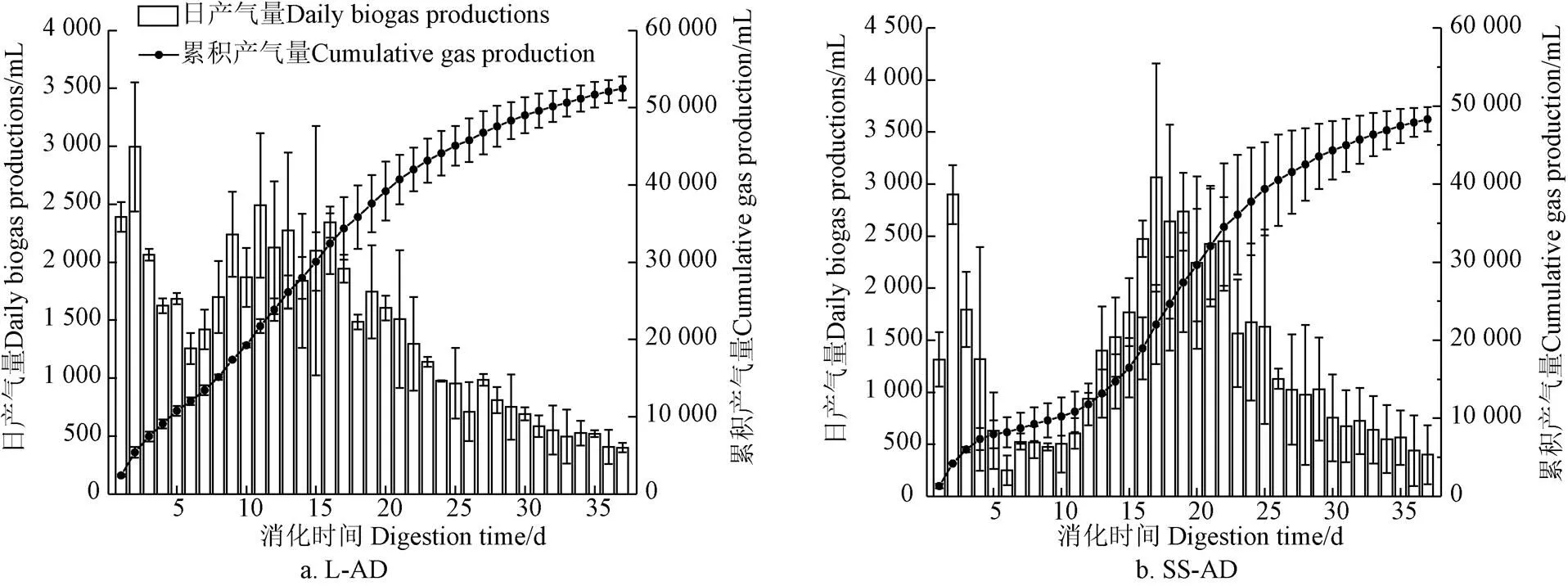
注:L-AD、SS-AD分别为液态厌氧发酵和固态厌氧发酵,下同。
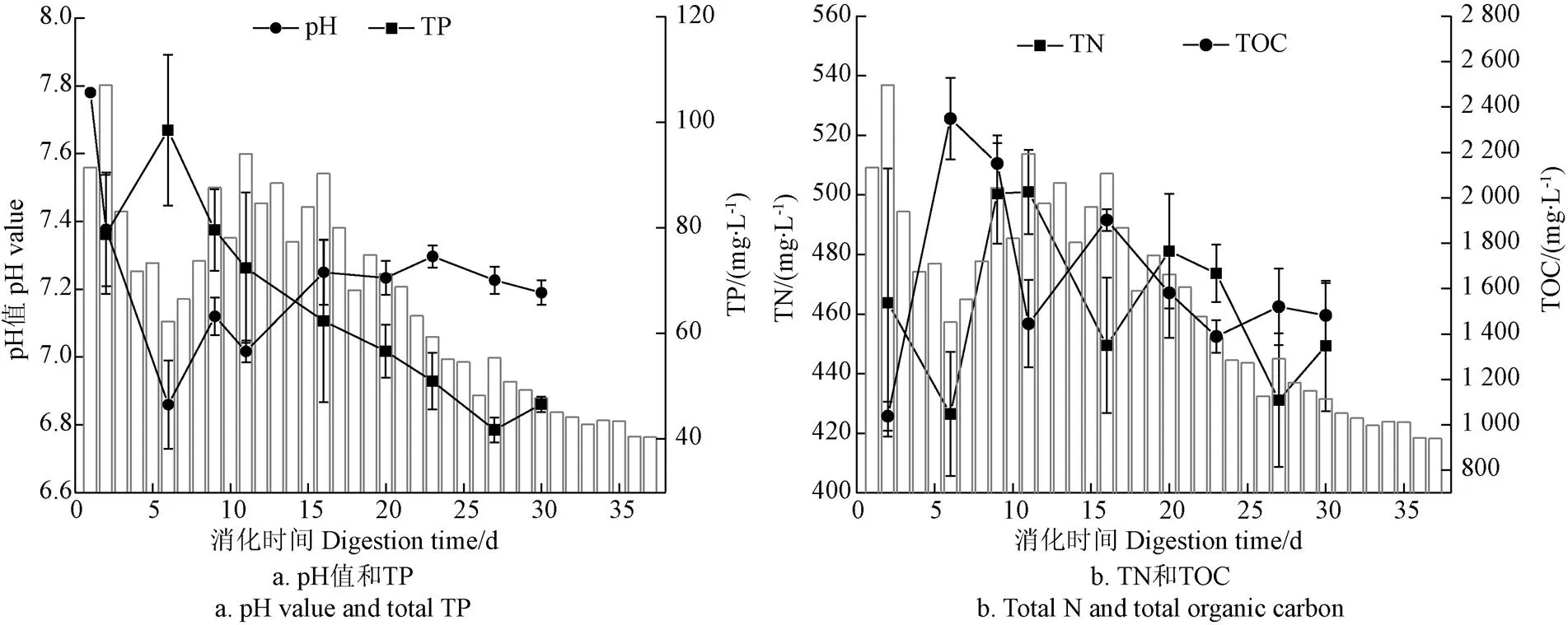
图2 玉米秸秆L-AD的理化指标变化特征
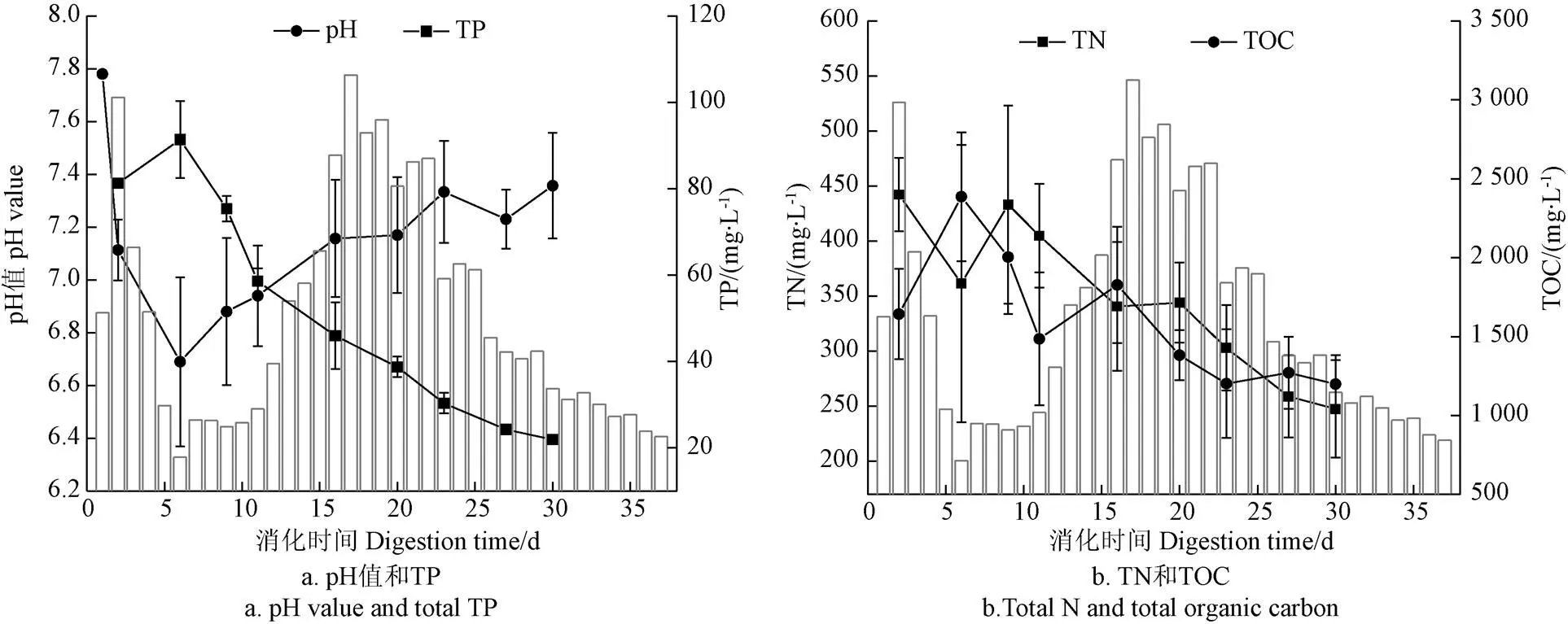
图3 玉米秸秆SS-AD的理化指标变化特征
2.3 挥发性脂肪酸
通常VFAs浓度超过10 000 mg/L会导致系统pH值的降低,进而抑制甲烷菌的活性。本研究过程中系统VFAs总量在2 000 mg/L以内,因此2个系统均未发生酸抑制现象。L-AD乙酸在VFAs体系占比最大(见图4),但随着时间推移,浓度逐渐下降,由开始的734 mg/L降至发酵结束后的19 mg/L;丙酸及戊酸在发酵前6 d有少量的增加,其中丙酸由19 mg/L升至41 mg/L,戊酸由低于检出限升至5.7 mg/L,但随后被微生物降解利用。发酵11 d后,除乙酸外,其余三类脂肪酸均低于色谱检出上限。SS-AD在装罐后第6 天出现酸峰值,乙酸由393升至1 346 mg/L;丙酸由13升至51 mg/L,丁酸及戊酸分别由低于检出限升至43.2、7.3 mg/L。丙酸在发酵第9天达到峰值124 mg/L,随后逐渐下降至发酵结束。对比研究发现,乙酸是玉米秸秆L-AD及SS-AD体系VFAs的主要组成,占总VFAs的70%以上;SS-AD系统在水解酸化阶段的VFAs浓度高于L-AD发酵,两系统在发酵第11天后,除乙酸外其余脂肪酸均无法检测出。

图4 玉米秸秆L-AD及SS-AD的VFAs比较
2.4 细菌多样性
根据序列相似性97%水平划分得到的细菌OTU总数分别为SS-AD 5364个,L-AD 5 614个。细菌多样性结果表明(表2),2系统无论在Chao1丰度指数还是shannon多样性指数上,均没有明显的差异(Sig.值分别为0.379及0.213),但发酵结束后细菌的丰度及多样性较发酵前略有下降。在门分类水平上的细菌群落组成如图5所示,两发酵系统中细菌主要以拟杆菌门()、厚壁菌门()、变形菌门()、、疣微菌门()、互养菌门()为主,这6类菌群占总克隆数的80%以上。其中为第一大菌群,分别占L-AD、SS-AD细菌总克隆数的31.0%~39.2%和22.2%~27.7%,在整个消化阶段其相对丰度较稳定;为第二大门,两系统中的相对丰度分别为13.5~27.4%和12.4%~26.8%。是纤维素降解及乙酸形成的主要参与者,而在降解多糖类物质中起关键作用[26]。研究表明忍耐不利环境的能力较强,在发酵系统中其相对丰度有先增加后下降的趋势[27],这与本研究的结果一致;同时高丰度期2系统中的乙酸浓度较高,在SS-AD系统尤为明显。为第三大菌群,在两系统中的相对丰度分别为6.9%~15.9%(L-AD)及12.5%~40.4%(SS-AD),该类菌群能够利用乙酸等简单的有机物,其中的假单胞菌可以在无氧条件下进行反硝化作用,2系统中该菌群的相对丰度随消化时间逐渐降低。属于未完全确定的一个细菌门类,研究表明该类菌群可以通过代谢氨基酸等获得碳源和能量[28],本研究中的相对丰度随消化时间逐渐上升,其中SS-AD系统由初期1.0%升至20.1%,L-AD系统由0.7%升至8.8%。及分别为第五、第六大菌群,前者是一种新型的甲烷氧化菌,甲烷是其唯一的能量来源;后者是中温严格厌氧氨基酸及丙酮酸降解菌,可能在秸秆厌氧降解中间产物的去除方面发挥作用[29]。两者相对丰度总和随发酵过程逐渐增大,其中L-AD由发酵前8.2%上升至发酵后20.3%,SS-AD由发酵前5.6%上升至发酵后13.8%。

表2 沼液中细菌群落多样性指数(序列相似性97%水平)
注:W为L-AD,D为SS-AD,其后数字代表消化时间,d。下同。
Note :W is L-AD,D is SS-AD, the number behind is digestion time, d. The same as below.
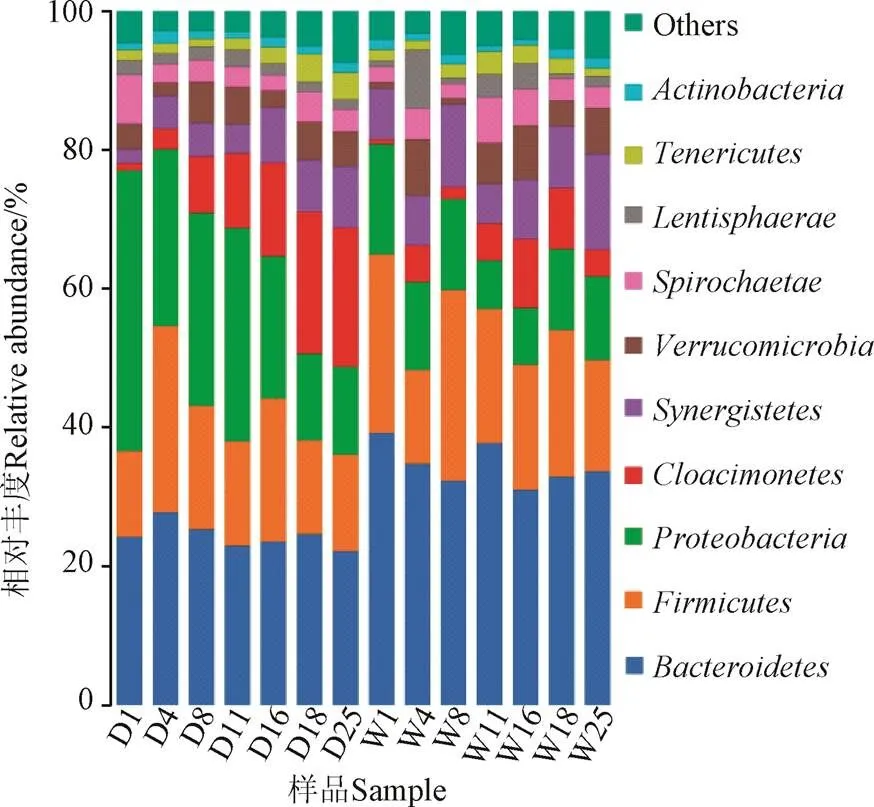
图5 沼气工程系统中细菌在门分类水平上的群落结构
2.5 古菌多样性
古菌多样性结果表明(见表3),SS-AD及L-AD的shannon指数没有明显差异(Sig.=0.434),但Chao1丰度指数存在显著差异(Sig.=0.022)。在属分类水平上的古菌群落结构如图6所示,2发酵系统中已鉴定的产甲烷古菌主要以甲烷鬃毛菌属(),甲烷螺菌属(),甲烷粒菌属(),以及甲烷囊菌属()为主,这4类古菌在SS-AD中占总克隆数的24.4%~39.6%,在L-AD系统中占27.9%~48.0%。其中以及是乙酸营养型古菌,其余2者为氢营养型古菌。时间尺度上,2系统总体呈现由乙酸型产甲烷菌向氢营养型产甲烷菌转变的趋势。如:SS-AD中及两者相对丰度总和由13.3%(4 d)降至9.5%(18 d),及总丰度由11.1%(4 d)升至15.9%(18 d);而L-AD系统乙酸营养型产甲烷菌占比由25.6%(4 d)降至20.6%(18 d),氢营养型产甲烷菌占比由10.0%(4 d)升至17.6%(18 d)。至发酵后第25天,2类古菌在系统中的占比基本平衡,SS-AD中乙酸营养型占比13.0%,氢营养型占比14.7%;L-AD中乙酸营养型占比24.8%,氢营养型占比23.2%,可见玉米秸秆L-AD产甲烷古菌总克隆数的相对丰度略高于SS-AD。

表3 沼液中古菌群落多样性指数(序列相似性97%水平)

图6 沼气工程系统中古菌在属分类水平上的群落结构
2.6 差异性与相关性比较
通过对样品细菌及古菌群落差异的UPGMA聚类分析,得到发酵不同阶段层次聚类树(如图7)。对于细菌群落,在发酵前4天SS-AD与L-AD的群落结构差异性较小,之后迅速变大,呈现明显的聚类差异性;而对于古菌群落,系统OTU结构之间的相似度在发酵第8天后显著降低。

图7 细菌及古菌群落的UPGMA聚类树
采用RDA对2系统宏观环境指标及微观群落结构进行分析(由于丁酸、戊酸部分数据低于检测下限,故不纳入分析),结果见图8。对于L-AD系统,Axis1轴和Axis2轴分别解释了55.17%和29.99%的变异性,其中日产气量对Axis1轴的贡献量最大,而VFAs、TN、TP对Axis2轴的贡献较大。总体上微生物群落演变解释度由大到小分别是乙酸>产气量>TN>pH>丙酸>TOC,因此影响L-AD微生态结构的主要环境因子为乙酸,对L-AD群落演替的解释度为29.1%。从样方分布看来,稳定产气阶段主要分布于第二、第三象限,发酵第11、16、18及25天4个样方的群落结构相似度较高。物种与环境因子的相关性表明,及与TOC正相关,与TOC呈极显著负相关,说明前者是TOC降解的关键微生物,而后者则是TOC的主要贡献者。与乙酸、丙酸及TP均呈明显正相关,说明该菌群承担了挥发性脂肪酸降解的主要任务,同时沼液中P是其生长的限制性因子。L-AD系统产气量与、正相关,与及呈负相关,而与其它微生物相关性不明显,推测对于L-AD,水解酸化是限制玉米秸秆产气的关键过程。对于SS-AD系统,Axis1轴和Axis2轴分别解释了63.57%和18.87%的变异性,其中TP、TN对Axis1轴的贡献量最大,TOC、pH值、乙酸对Axis2轴的贡献量最大。环境因子对SS-AD群落结构演变的结构度排序是:TP>pH值>TOC>乙酸>丙酸>TN,可见,TP是影响SS-AD系统微生态结构的关键环境因子,其解释度为38.9%。与L-AD相似,SS-AD稳定产气阶段也主要分布在第二、第三象限。物种与环境因子的分布方位可知,及是TOC、乙酸及丙酸的主要生产者,TN是与生长的限制因子。与L-AD不同的是,SS-AD的日产气量与及呈明显正相关,与负相关,可见甲烷古菌的数量是影响玉米秸秆SS-AD产气的关键环节。

图8 L-AD及SS-AD系统的冗余分析
3 讨 论
研究表明渗滤液回流既可提高秸秆原料纤维素、半纤维素的降解率及利用率,还可通过渗滤液入渗作用强化传热传质,提高厌氧发酵系统的发酵效率[30],因此本研究的SS-AD系统是完全合理可行的。通过计算本研究SS-AD及L-AD的S/I比在2~4之间,处于最佳的料泥比范围内[9,31],其数据具有一定的代表性。Brown等研究发现[32],以农作物秸秆及多年生草本为原料,L-AD与SS-AD的原料产甲烷率没有差异,但后者的容积产气率是前者的2~7倍。对于粪秆混合厌氧发酵,平均值干物质产气率对应的TS浓度依次为8%>20%>16%>12%>4%,并且存在显著的差异性[33]。可能是因为粪秆混合发酵为微生物生长提供了充足的N源,而纯秸秆发酵消化液中N素较少,微生物生长受限,故TS浓度对原料产气率的影响不显著。本文以纯玉米秸秆为底物,得到SS-AD的TS产气率略低于L-AD的结论,这与Brown的结果相似。
袁月祥等以玉米秸秆为原料,在中温(TS约6.4%)的条件下进行厌氧发酵,发现优势细菌种群为(相对丰度46.07%)、(相对丰度20.51%)和(相对丰度13.09%),并且不同细菌在发酵过程中的丰度变化趋势不同,发酵开始后相对丰度迅速上升,并最终保持在50%以上,及在发酵后持续下降,最终稳定在10%附近[34]。玉米秸秆SS-AD研究表明,(61.0%)相对丰度最大,其后依次为(17.9%)和(8.2%)[11]。本研究对比了不同发酵系统在不同阶段的微生物群落结构,与其它学者结果相比,上述3类细菌是玉米秸秆L-AD及SS-AD系统的优势菌群,但L-AD系统并未发现相对丰度上升的现象,可能是秸秆预处理方式不同所致,袁月祥以NaOH稀碱液为预处理手段,而本研究为稀释后的沼液,在预处理7 d内,相对丰度已发生改变。与袁月祥研究结果相似的是,无论是SS-AD还是L-AD,在消化结束后及2类菌群的最终相对丰度稳定在10%附近。同时本研究还发现的相对丰度随时间逐渐上升,消化结束后,其在SS-AD中的其相对丰度达到20.1%,超过了及
对于古菌群落,研究发现、、、是玉米秸秆L-AD的优势群落,除外,其余4种古菌相对丰度随着发酵时间逐渐增加[34]。Li等研究发现,在玉米秸秆L-AD系统中(29%),(19%)和(13%)是最丰富的属,而对于SS-AD,(53%)则占绝对优势,其次分别为、以及[35]。而Rojas-Sossa等研究则发现,、及是玉米秸秆厌氧发酵主要的古菌群落[27]。上述研究结果的差异一方面可能是因接种物不同造成的,三位学者的发酵接种物分别为猪粪、牛粪以及城市污泥;另一方面,目前绝大多数研究结果只代表了1个发酵时间点,而实际上古菌在发酵过程中的相对丰度是变化的。本研究所得优势古菌群落与袁月祥相似,同时还发现随厌氧消化过程的进行,古菌群落呈现由乙酸型向氢营养型转变的趋势,至发酵结束后,两类古菌在系统中的占比基本持衡,Wachemo研究了水稻秸秆L-AD古菌群落演变过程,也得出相似的结论[36]。
众多研究表明,随着原料TS浓度的上升,原料产气率会下降,主要是因为原料与微生物之间传质受阻,水解速率受限所致[37-38]。Riya则认为在L-AD系统中,当TS小于10%时,传质是影响原料产气料的关键因素;而当TS升至10%~25%时,传质不再是影响发酵效率的重要因子,在此范围中提高TS浓度对依赖传质的消化作用影响很微弱[39]。本研究通过渗滤液回流喷淋措施,很大程度上解决了秸秆SS-AD传质及水解速率问题,通过RDA分析得出日产气量与等水解细菌呈负相关的结论,而与及呈明显正相关,说明在SS-AD系统中秸秆纤维素水解不再是限制步骤,而如何增加产甲烷古菌的生物量才是提高原料产气率的关键。但对于玉米秸秆L-AD系统,以及为代表的细菌群落对秸秆纤维素的水解可能是制约物能转化率的关键过程。
4 结 论
本文以玉米秸秆为研究对象,应用分子生物学手段对L-AD、SS-AD系统微生物多样性及演替规律进行比较研究,并得出如下结论。
1)L-AD及SS-AD日产沼气均呈“双峰”趋势,同时SS-AD产气高峰期较L-AD晚约4 d,进入高峰期前者CH4含量也低于后者,统计得到的SS-AD的TS产气率略低于L-AD。
2)玉米秸秆发酵结束后,SS-AD沼液中N、P、C的含量要低于L-AD,乙酸是两发酵体系VFAs的主要成分,占总VFAs的70%以上。
3)2发酵系统中细菌主要以、、、、以及为主,这6类菌群占总克隆数的80%以上。为第一大菌群,在整个消化阶段其相对丰度较稳定;及两类菌群丰度在发酵开始后逐渐下降,并最终稳定在10%附近;而的相对丰度则随发酵时间逐渐上升,在SS-AD中的最大相对丰度可达20.1%。
4),,以及是2个系统的优势古菌,并且随消化过程的进行,古菌群落呈现由乙酸型向氢营养型转变的趋势,至发酵结束后,2类古菌在群落中的占比基本持平。
5)聚类分析结果显示,在发酵第4天和第8天后,2个系统中细菌与古菌群落结构的差异逐渐明显。冗余分析表明,影响L-AD微生态结构的主要环境因子为乙酸,以及为代表的细菌群落对秸秆纤维素的水解可能是制约物能转化率的关键过程;TP是影响SS-AD系统微生态结构的关键环境因子,而如何增加产甲烷古菌的生物量是提高该系统原料产气率的关键。
[1] 于佳动,赵立欣,冯晶,等. 序批式秸秆牛粪混合厌氧干发酵影响因素研究[J]. 农业工程学报,2018,34(15):215-221.
Yu Jiadong, Zhao Lixin, Feng Jing, et al. Influence factors on batch dry anaerobic digestion for corn stalks-cow dung mixture[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(15): 215-221. (in Chinese with English abstract)
[2] 孙永明,李国学,张夫道,等. 中国农业废弃物资源化现状与发展战略[J]. 农业工程学报,2005,21(8):169-173.
Sun Yongming, Li Guoxue, Zhang Fudao, et al. Status quo and developmental strategy of agricultural residues resources in China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2005, 21(8): 169-173.(in Chinese with English abstract)
[3] 高增月,杨仁全,程存仁,等. 规模化养猪场粪污综合处理的试验研究[J]. 农业工程学报,2006,22(2):198-200.
Gao Zengyue, Yang Renquan, Cheng Cunren, et al. Test study on integrated treatment of manure and wastewater for large scale pig farm[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2006, 22(2): 198-200. (in Chinese with English abstract)
[4] 马林,王方浩,马文奇,等. 中国东北地区中长期畜禽粪尿资源与污染潜势估算[J]. 农业工程学报,2006,22(8):170-174.
Ma Lin, Wang Fanghao, Ma Wenqi, et al. Assessments of the production of animal manure and its contribution to eutrophicationin Northeast China for middle and long period[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2006, 22(8): 170-174. (in Chinese with English abstract)
[5] Yang L, Xu F, Ge X, et al. Challenges and strategies for solid-state anaerobic digestion of lignocellulosic biomass[J]. Renewable and Sustainable Energy Reviews, 2015, 44: 824-834.
[6] 李文哲,罗立娜,窦钰程,等. 干湿耦合厌氧发酵工艺设计与发酵特性试验[J]. 农业机械学报,2013,44(5):148-153.
Li Wenzhe, Luo Lina, Dou Yucheng, et al. Wet and dry coupling anaerobic fermentation process and fermentation characteristic Test[J]. Transactions of the Chinese Society for Agricultural Machinery, 2013, 44(5): 148-153. (in Chinese with English abstract)
[7] Ge X, Xu F, Li Y. Solid-state anaerobic digestion of lignocellulosic biomass: Recent progress and perspectives[J]. Bioresource Technology, 2016, 205: 239-249
[8] Jian S, Xu F, Wang Z, et al. Effects of microbial and non-microbial factors of liquid anaerobic digestion effluent as inoculum on solid-state anaerobic digestion of corn stover[J]. Bioresource Technology, 2014, 157: 188-196.
[9] Mao C, Xi J, Feng Y, et al. Biogas production and synergistic correlations of systematic parameters during batch anaerobic digestion of corn straw[J]. Renewable Energy, 2019, 132: 1271-1279.
[10] Li Y, Wang Y, Yu Z, et al. Effect of inoculum and substrate/inoculum ratio on the performance and methanogenic archaeal community structure in solid state anaerobicco-digestion of tomato residues with dairy manure and corn stover[J]. Waste Management, 2018, 81: 117-127.
[11] Li Y F, Shi J, Nelson M C, et al. Impact of different ratios of feedstock to liquid anaerobic digestion effluent on the performance and microbiome of solid-state anaerobic digesters digesting corn stover[J]. Bioresource Technology, 2016, 200: 744-752.
[12] Li Y, Liu C, Wachemo A C, et al. Effects of liquid fraction of digestate recirculation on system performance and microbial community structure during serial anaerobic digestion of completely stirred tank reactors for corn stover[J]. Energy, 2018, 160: 309-317.
[13] Wang Y, Li G, Chi M, et al. Effects of co-digestion of cucumber residues to corn stover and pig manure ratio on methane production in solid state anaerobic digestion[J]. Bioresource Technology, 2018, 250: 328-336.
[14] 韦秀丽,蒋滔,李平,等. 粪秆混合厌氧发酵渗滤床工艺的消化性能[J]. 环境工程学报,2017,11(10):5644-5650.
Wei Xiuli, Jiang Tao, Li Ping, et al. Anaerobic digestion capability of corn straw and cow manure by using lab-scale leach bed reactors system[J]. Chinese Journal of Environmental Engineering, 2017, 11(10): 5644-5650. (in Chinese with English abstract)
[15] Ma K, Li X, Wang K, et al. Establishment of thermophilic anaerobic terephthalic acid degradation system through one-step temperature increase startup strategy: Revealed by Illumina Miseq Sequencing[J]. Chemosphere, 2017, 184: 951-959.
[16] Öner B E, Akyol Ç, Bozan M, et al. Bioaugmentation withto enhance the anaerobic biodegradation of lignocellulosic agricultural residues[J]. Bioresource Technology, 2018, 249: 620-625.
[17] Zhang J, Li W, Lee J, et al. Enhancement of biogas production in anaerobic co-digestion of food waste and waste activated sludge by biological co-pretreatment[J]. Energy, 2017, 137: 479-486.
[18] 汪其同,高明宇,刘梦玲,等. 基于高通量测序的杨树人工林根际土壤真菌群落结构[J]. 应用生态学报,2017,28(4):1177-1183.
Wang Qitong, Gao Mingyu, Liu Mengling, et al. Illumina miseq sequencing-based fungal community of rhizosphere soils along root orders of poplar plantation[J]. Chinese Journal of Applied Ecology, 2017, 28(4): 1177-1183. (in Chinese with English abstract)
[19] Yang S, Phan H V, Bustamante H, et al. Effects of shearing on biogas production and microbial community structure during anaerobic digestion with recuperative thickening[J]. Bioresource Technology, 2017, 234: 439-447.
[20] Ferguson R M W, Coulon F, Villa R. Understanding microbial ecology can help improve biogas production in AD[J]. Science of The Total Environment, 2018, 642(15): 754-763.
[21] Zhou J, Yang J, Yu Q, et al. Different organic loading rates on the biogas production during the anaerobic digestion of rice straw: A pilot study[J]. Bioresource Technology, 2017, 244(1): 865-871.
[22] Buettner C, Noll M. Differences in microbial key players in anaerobic degradation between biogas and sewage treatment plants[J]. International Biodeterioration & Biodegradation, 2018, 133: 124-132.
[23] Granada C E, Hasan C, Marder M, et al. Biogas from slaughterhouse wastewater anaerobic digestion is driven by the archaeal familyand bacterial familiesand[J]. Renewable Energy, 2018, 118: 840-846.
[24] Yekta S S, Ziels R M, Björn A, et al. Importance of sulfide interaction with iron as regulator of the microbial community in biogas reactors and its effect on methanogenesis, volatile fatty acids turnover, and syntrophic long-chain fatty acids degradation[J]. Journal of Bioscience and Bioengineering, 2017, 123(5): 597-605.
[25] 任海伟,姚兴泉,李金平,等. TS对青贮玉米秸秆与牛粪混合消化产气特性影响[J]. 太阳能学报,2019,40(4):1085-1092.
Ren Haiwei, Yao Xingquan, Li Jinping, et al. Effect of total solid concentration on biogas production performance during anaerobic co-digestion of maize silages and cattle manure[J]. Acta Energiae Solaris Sinica. 2019, 40(4): 1085-1092. (in Chinese with English abstract)
[26] Wang Y Y, Li G X, Chi M H, et al. Effects of co-digestion of cucumber residues to corn stover and pig manure ratio on methane production in solid state anaerobic digestion[J]. Bioresource Technology, 2018, 250: 328-336.
[27] Rojas-Sossa J P, Zhong Y, Valenti F, et al. Effects of ammonia fiber expansion (AFEX) treated corn stover on anaerobic microbes and corresponding digestion performance[J]. Biomass and Bioenergy, 2019, 127: 1052-1063.
[28] 余智勇. 厌氧膜生物反应器的污泥消化和膜污染特性[D].北京:清华大学,2015.
Yu Zhiyong. Characteristics of Sludge Digestion and Membrane Fouling in Anaerobic Membrane Bioreactor[D]. Beijing: Tsinghua University, 2015. (in Chinese with English abstract)
[29] 乔江涛,郭荣波,袁宪正,等. 玉米秸秆厌氧降解复合菌系的微生物群落结构[J]. 环境科学,2013,34(4):1531-1539.
Qiao Jiangtao, Guo Rongbo, Yuan Xianzheng,. Phylogenetic analysis of methanogenic corn stalk degrading microbial communities[J]. Environmental Science, 2013, 34(4): 1531-1539. (in Chinese with English abstract)
[30] 袁巧霞,程长菊,华朝辉,等. 渗滤液回流条件下多层床厌氧干发酵产气特性[J]. 农业机械学报,2014,45(2):182-187.
Yuan Qiaoxia, Cheng Zhangju, Hua Zhouhui, et al. Characteristic of biogas production in multi-layer anaerobic dry fermentation reactor under leachate recirculation conditions[J]. Transactions of the Chinese Society for Agricultural Machinery, 2014, 45(2): 182-187 (in Chinese with English abstract)
[31] 于佳动,赵立欣,冯晶,等. 序批式玉米秸秆牛粪混合厌氧干发酵产甲烷工艺优化研究[J]. 农业工程学报,2018,34(增刊):86-92.
Yu Jiadong, Zhao Lixin, Feng Jing, et al. Study on optimal technology of methane production by sequencing batch dry anaerobic digestion with corn straw and cattle manure[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(Supp.): 86-92. (in Chinese with English abstract)
[32] Brown D, Shi J, Li Y. Comparison of solid-state to liquid anaerobic digestion of lignocellulosic feed stocks for biogas production[J]. Bioresource Technology, 2012, 124: 379-386.
[33] 宋籽霖,李轶冰,杨改河,等. 温度及总固体浓度对粪秆混合发酵产气特性的影响[J]. 农业工程学报,2010,26(7):260-265.
Song Zilin, Li Yibing, Yang Gaihe, et al. Effects of total solid concentration and temperature on biogas yields of mixture of chicken manure and corn straw[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(7): 260-265. (in Chinese with English abstract)
[34] 袁月祥,文昊深,黄显波,等. 玉米秸秆产生物燃气及其微生物群落解析[J]. 化工学报,2014,65(5):1784-1791.
Yuan Yuexiang, Wen Haoshen, Huang Xianbo, et al. Biogas production using cornstalks and prokaryotic community composition[J]. CIESC Journal, 2014, 65(5): 1784-1791. (in Chinese with English abstract)
[35] Li Y F, Nelson M C, Chen P H. Comparison of the microbial communities in solid-state anaerobic digestion (SS-AD) reactors operated at mesophilicand thermophilic temperatures[J]. Applied Microbiology and Biotechnology, 2015, 99: 969-980.
[36] Wachemo A C, Tong H, Yuan H R, et al. Continuous dynamics in anaerobic reactor during bioconversion of ricestraw: Rate of substance utilization, biomethane production and changesin microbial community structure[J]. Science of the Total Environment, 2019, 687: 1274-1284.
[37] Sumardiono B S, Fofana F F M, Fauzi I, et al. The effect of solid-state anaerobic disgestion (SS-AD) and liquid anaerobic disgestion (L-AD) method in biogas production of rice husk[J]. Journal of Vocational Studies on Applied Research, 2019, 1(1): 5-17.
[38] Li Y Y, Lu J L, Xu F Q, et al. Reactor performance and economic evaluation of anaerobic co-digestion of dairy manure with corn stover and tomato residues under liquid, hemi-solid, and solid state conditions[J]. Bioresource Technology, 2018, 270: 103-112.
[39] Riya S, Suzuki K, Meng L Y, et al. The influence of the total solid content on the stability of dry-thermophilic anaerobic digestion of rice straw and pig manure[J]. Waste Management, 2018, 76: 350-356.
Comparison of biogas production and microbial species of corn straw in solid-state anaerobic digestion (SS-AD) and liquid anaerobic digestion (L-AD)
Jiang Tao1, Wei Xiuli1, Xiao Lu1, Liu Ke2, Zhang Kai2, Li Ping1, Wang Bing1※
(1.,401329,; 2.,,401329,)
Anaerobic digestion (AD) is an important method to dispose agricultural waste in the process of green agriculture development in China. It not only solve the problem of fuel shortages in rural areas, but also realize the harmless treatment and multi-level resource utilization of waste. Based on the total solids (TS) content of the feedstock, AD has been developed as liquid anaerobic digestion (TS<15%) and solid-state anaerobic digestion (TS≥15%) technologies. In this paper, the gas production performance and micro-ecological succession law of corn straw in liquid and solid biogas fermentation were compared. The result showed that: The peak period of SS-AD biogas production was about 4 days later than that of L-AD, and the CH4volume fraction of the SS-AD was lower than that of the L-AD in stable biogas production period. The biogas production rate of TS and methane conversion rate in SS-AD system were slightly lower than that of L-AD. After the fermentation, the contents of N, P and C in the SS-AD biogas slurry were lower than that of the L-AD. Acetic acid is the main component of VFAs in the two digestion systems, accounting for more than 70% of the total VFAs. High-throughput sequencing results showed that the bacteria in the two disgestion systems were mainly composed of,,,,and, which accounted for more than 80% of the total number of clones.is the largest class of bacteria, and its relative abundance is stable throughout the digestive stage, but the relative abundances ofandwere decreased gradually after the start of fermentation, and eventually stabilized around 10%. The relative abundance ofincreases with digestion time, and the maximum value can reach 20.1% in SS-AD systems. The sum of the relative abundances ofandincreases with the anaerobic digestion process.andare the dominant archaea in the two fermentation systems. These four types of archaea accounted for 24.4%-39.6% of the total number of clones in SS-AD system and 27.9%-48.0% in L-AD system. With the progress of the digestion, the archaea community showed a trend of transition from acetic acid nutrition to hydrogen nutrition. After fermentation, the proportion of these two types of archaea in the community wasin balance. The results of cluster analysis on microbial diversity showed that the difference between the bacteria and archaea community structure of the two systems gradually became obvious after the 4th and 8th day of fermentation. Further analysis showed that the main environmental factor affecting the L-AD micro-ecological structure of corn straw is acetic acid, and the hydrolysis of straw cellulose may be the key process to limit the conversion rate of raw materials. Phosphorus is the most important environmental factor affecting the micro-ecological structure of SS-AD systems, and how to increase the biomass of methanogenic archaea is the key to raise the biogas production rate of raw materials. The results of this study provide a scientific basis for regulating the anaerobic digestion process of corn straw and improving its bio-degradation efficiency.
straw; fermentation; methane; corn straw; solid-state anaerobic digestion; liquid anaerobic digestion; Microbial community
蒋 滔,韦秀丽,肖 璐,刘 科,张 凯,李 平,王 冰. 玉米秸秆固态和液态厌氧发酵产气性能与微生物种类比较研究[J]. 农业工程学报,2020,36(3):227-235.doi:10.11975/j.issn.1002-6819.2020.03.028 http://www.tcsae.org
Jiang Tao, Wei Xiuli, Xiao Lu, Liu Ke, Zhang Kai, Li Ping, Wang Bing. Comparison of biogas production and microbial species of corn straw in solid-state anaerobic digestion (SS-AD) and liquid anaerobic digestion (L-AD)[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(3): 227-235. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.03.028 http://www.tcsae.org
2019-10-25
2020-01-04
重庆市技术创新与应用示范专项(cstc2018jszx-zdyfxmX0009);重庆市技术创新与应用发展专项(cstc2019jscx-gksbX0158)
蒋 滔,助理研究员,研究方向为农业废弃物资源化利用。Email:273021978@qq.com.
王 冰,副研究员,主要从事农业生态环境保护研究。Email:565202729@qq.com.
10.11975/j.issn.1002-6819.2020.03.028
S216
A
1002-6819(2020)-03-0227-09
