固相萃取-液相色谱法测定环境水样中酰胺类化合物
2020-04-07罗青青牛禾严朝朝章心怡袁继委余彬彬
罗青青 牛禾 严朝朝 章心怡 袁继委 余彬彬


(1. 台州学院 医药化工与材料工程学院, 浙江 台州 318000; 2. 台州市环境监测中心站,浙江 台州 318000)
摘 要:建立了超高效液相色谱法测定环境水样中甲酰胺、N-甲基甲酰胺、N-甲基乙酰胺、N, N-二甲基甲酰胺(DMF)和N, N-二甲基乙酰胺(DMAC)等酰胺类化合物含量的方法。环境水样经活性炭固相萃取柱富集净化,上样1.0~50.0 mL,用3.0 mL 乙腈洗脱,洗脱液经过浓缩、溶剂置换后进行色谱分析。采用Athena C18-WP液相色谱柱,选择乙腈:水 (5∶95,V/V) 为流动相,设定流速为1.0 mL/min,柱温为30 ℃,紫外检测波长为195 nm。实验考察了固相萃取柱种类、样品上样量、洗脱溶剂用量、淋洗溶剂用量等对分析结果的影响。5种酰胺类化合物在最终优化条件下能在15 min 内实现分离,在0.4~10.0 mg/L 范围内呈良好线性关系(相关系数大于0.99),检出限为2×10-4~0.02 mg/L,方法加标回收率81.6%~100.6%,精密度为0.37%~0.94%。本方法操作简便、快速准确,可同时测定环境水样中的酰胺类化合物。
關 键 词:超高效液相色谱法;固相萃取;酰胺类化合物;环境水样
中图分类号:O652.63 文献标识码: A 文章编号: 1671-0460(2020)03-0741-04
Determination of Amides in Environmental Water Samples by
Solid Phase Extraction-Liquid Chromatography
LUO Qing-qing1, NIU He2, YAN Zhao-zhao1, ZHANG Xin-yi1, YUAN Ji-wei2, YU Bin-bin1*
(1. School of Pharmaceutical and Materials Engineering,Taizhou University, Zhejiang Taizhou 318000, China;
2. Taizhou Environmental Monitoring Center, Zhejiang Taizhou 318000, China)
Abstract: A method for the determination of formamide(FM), N-methylformamide (NMF), N-methylacetamide (NMAC), N,N-dimethylformamide(DMF) and N,N-dimethylacetamide (DMAC)in environmental water samples by ultra performance liquid chromatography was established. A cartridge containing carbon black was used for enrichment and cleanup of environmental water by solid phase extraction (SPE). The sample loaded was 1.0~50.0 mL, and then eluted with 3.0 mL acetonitrile, the elution was injected and analyzed by HPLC after concentration and solvent exchange. Athena C18-WP column and mobile phase of acetonitrile:water (5∶95,V/V) were used. The flow rate was 1.0 mL/min, the column temperature was 30 °C, and the UV detection wavelength was 195 nm. The effects of the type of solid phase extraction column, the amount of sample loading, rinsing solvent and elution solvent on the analysis result were investigated. The results showed that, five amide compounds were determined within 15 min under the optimized conditions. The calibration curves were linear in range of 0.4~10.0 mg/L with correlation coefficients of 0.99. The detectable concentration (LOD) was 2×10-4~0.02 mg/L, and the average recoveries were 81.6%~100.6%, with the precision of 0.37%~0.94%. The method is simple, rapid and accurate, and can simultaneously determine amide compounds in environmental water samples.
Key words: HPLC; solid phase extraction; amide; environmental water sample
酰胺类化合物在纤维、制药、染料、合成革和制衣等行业中应用广泛,可随工业废水排出进入水体环境中,从而对人体造成一定的毒害作用。这类化合物可经皮肤、呼吸道和消化道吸收,对人体心脏、肝脏、血管和神经等系统产生危害[1],影响着人体健康和对环境的污染,因此环境中的酰胺类化合物日益受到广泛关注。而国内目前缺少酰胺类化合物的相关水质检测标准和标准限值要求,关联较大的有环境空气和废气中的酰胺类化合物的测定[2],规定了甲酰胺、N, N-二甲基甲酰胺、N, N-二甲基乙酰胺和丙烯酰胺的测定方法。
研究报道中测定水中酰胺类物质的常见的分析检测方法有气相色谱法[3-6]、气相色谱-质谱法(GC-MS)[7]、紫外分光光度法[8]、高效液相色谱-质谱法[9-11]以及高效液相色谱法[12-15]等。由于酰胺类化合物的水溶性很强,而气相色谱仪不能进水相,需要复杂的衍生化处理后再用有机溶剂提取,过程繁琐复杂,而且成本相对较高,灵敏度也比较低。采用紫外分光光度法的缺点是易受硝酸盐等杂质的干扰,而且紫外分光光度法只能测定酰胺类化合物的总量,不能实现不同物质的同时检测与定量。高效液相色谱-质谱法由于价格昂贵,较难普及应用。相比而言,高效液相色谱法具有快速简便、高效准确等特点,能较好地测定出酰胺类化合物。因此本文建立了固相萃取-高效液相色谱法测定环境水样中甲酰胺(FM)、N-甲基甲酰胺(NMF)、N-甲基乙酰胺(NMAC)、N, N-二甲基甲酰胺(DMF)和N, N-二甲基乙酰胺(DMAC)等五种酰胺类化合物的方法,优化前处理方法,采集地表水样、工业废水和河道水样进行检测分析,为相关项目的检测分析和相关标准的建立提供参考方法。
1 实验部分
1.1 实验仪器及试剂
仪器:UHPLC超高效液相色谱仪(美国热电公司, Ultimate-3000),配紫外检测器;天平(梅特勒-托利多仪器上海有限公司,ME-204),精度为0.000 1 g;亲水PTFE针式滤器(圣贝诺上海医疗用品有限公司),13 mm×0. 22 μm;固相萃取装置 (北京莱伯泰科仪器股份有限公司);HLB 固相萃取柱(0.5 g/6 mL,美国waters公司OASIS系列),活性炭固相萃取柱(0.5 g/6 mL,天津博纳艾杰尔科技有限公司)(Cleanert-SPE: ND5006),活性炭(Cat.No. 01875-96,关东化学株式会社),聚苯乙烯/二乙烯苯(PEP-2)固相萃取柱(0.5 g/6 mL,天津博纳艾杰尔科技有限公司);N-EVAP-24氮吹仪(Organomation);色谱柱: Athena C18-WP液相色谱柱(上海安谱科学仪器有限公司,4. 6 mm×250 mm×5 μm)。
试剂:乙腈(流动相,HPLC级,上海安谱科学仪器有限公司),FM、NMF、NMAC、DMF和DMAC 5种标准品(含量>99.0%,分析纯,五种试剂均购自国药集团化学试剂有限公司)。
1.2 色谱条件
流动相:乙腈/水(5∶95,V/V);流速:1.0 mL /min;检测波长:195 nm;柱温:30 ℃;进样体积:10 μL。
1.3 标准曲线的制作
分别准确称取MF 0.126 9 g,NMF 0.101 0 g,NMAC 0.094 3 g,DMF 0.097 8 g,DMAC 0.096 6 g,置于25 mL容量瓶中,加超纯水定容至刻度,作为标准储备溶液,再吸取上述标准储备溶液1.0 mL于10 mL容量瓶中,则可得到稀释10倍的标准中间溶液,静置备用。
1.4 样品前处理的方法
考虑到环境样品中可能含有复杂的物质成分会干扰目标化合物的测定,采取固相萃取的方法先去除水样中的疏水性有机杂质。先用乙腈活化固相萃取小柱5 min,再用超纯水平衡5 min,随后上样操作,这里将甲酰胺和其他4种物质进行不同的上样量,甲酰胺上样量1.0 mL,其他4种物质上样量50 mL,用0.5 mL的纯水进行淋洗,待液体全部流完,最后用3.0 mL 乙腈进行洗脱,洗脱液经0.22 μm PTFE滤膜过滤,氮吹浓缩至约0.1 mL,用纯水置换乙腈定容至1.0 mL后上机进行色谱分析。
在固相萃取小柱的选择上,比较了三种类型的固相填料对酰胺类化合物的回收率,包括HLB、PEP、活性炭三種,其中活性炭除使用商品化购买的类型,还进行了自行手动填充的比较。
2 结果与讨论
2.1 SPE 条件的优化
2.1.1 SPE 萃取小柱的选择
本实验选用了不同的4种萃取小柱,分别有手动填充活性炭、商品化的活性炭SPE萃取小柱、HLB小柱和PEP-2小柱,选用3.0 mg/L的加标液,上样1.0 mL,考察固相萃取小柱的吸附效率。从图1可以看出,使用商品化的活性炭SPE萃取小柱中5种酰胺类化合物的回收率比其他3种萃取小柱高,效率最好。实验过程中由于手动填充活性炭SPE小柱在淋洗的时候会有部分活性炭被洗脱下来,目标物不被吸附,导致回收率比较低。因此本实验选择商品化的活性炭SPE萃取柱。
2.1.2 SPE 淋洗溶剂的用量
本研究考察了不同淋洗剂用量的回收效率,选用浓度为3.0 mg/L 的标准溶液,分别用0.5 mL和1.0 mL的纯水淋洗,结果表明淋洗剂纯水的用量为0.5 mL的回收率较好,主要是目标物甲酰胺会随着水的淋洗而被洗脱下来,导致回收率较低,因此选用0.5 mL用量的纯水作为淋洗剂。
2.1.3 SPE 洗脱溶剂的用量
本文选择乙腈作为SPE萃取小柱的洗脱溶剂,根据上述实验结果,使用浓度为3.0 mg/L 的标准溶液进行测试,考察洗脱溶剂不同用量的洗脱效率。结果如图2所示,乙腈用量为1.0 mL时洗脱效率最低,在40.5%~68.6%之间,当溶剂用量为2.0 mL洗脱效率提高到53.5%~80.6%,而用量增加到3.0 mL洗脱效率最高,为88.9%~100.8%。继续增加洗脱溶液2.0 mL,将这2.0 mL的洗脱液上机测定,结果表明后面增加的2.0 mL洗脱液中无目标物检出。因此,本研究选用3.0 mL的乙腈作为SPE 的洗脱溶剂。
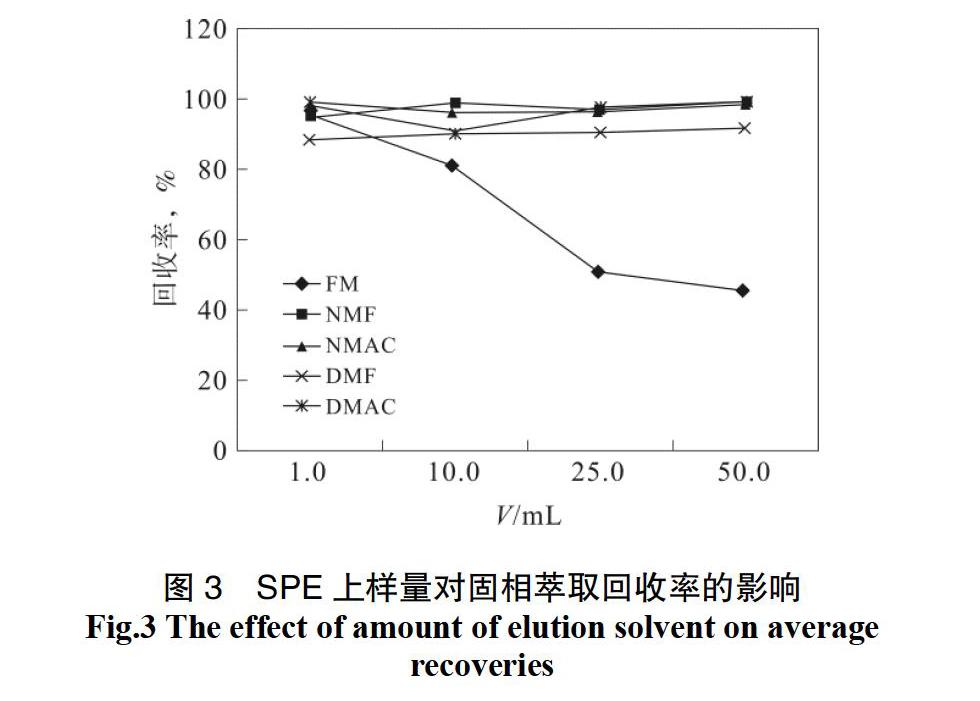
2.1.4 上样量考察
分别取浓度为3.0、0.3、0.24、0.12 mg/L的标准溶液,上样1.0、10.0、25.0、50.0 mL,考察SPE的上样体积的影响,结果如图3 所示。从图3可得,上样体积越大,甲酰胺在固相萃取柱上保留的效率越低,表明在上样过程就被洗脱下来。说明当上样体积增大后,甲酰胺在萃取柱内不能较好地保留,上样量为1.0 mL时甲酰胺回收率最高,为95.0%,上样体积为50 mL时,回收率降到45.6%。但其他4种化合物在上样体积为从1.0 mL增加50 mL时回收率的范围为91.5%~99.3%,说明上样体积的变化不会对这四种物质在活性炭上的吸附有明显影响。考虑到实际水样中酰胺类浓度可能较低。本文对于不同目标物采取不同的上样量:甲酰胺采用1.0 mL的上样量;其他4种物质采用上样量为50.0 mL进行固相萃取实验。
2.2 标准曲线绘制
分别吸取1.3节中的标准中间溶液1、2、4、6、8、10、16、20 μL配成混合标准溶液系列浓度梯度,用纯水定容至浓度分别为0.5、1、2、3、4、5、8、10 mg/L。
以保留时间定性,标准色谱图见图4,各种物质都能较好地分离,5种物质之间各不干扰。以浓度为横坐标,测得峰面积为纵坐标绘制标准曲线,5种物质线性关系良好,相关系数r为0.998 7~0.999 8,具体数据见表1。
色谱峰: 1-甲酰胺(FM); 2-N-甲基甲酰胺(NMF); 3-N-甲基乙酰胺(NMAC); 4-N,N-二甲基甲酰胺(DMF); 5-N,N-二甲基乙酰胺(DMAC)
2.3 方法检出限、回收率和精密度
配置浓度为检出限3~5倍的标准试液,按照1.4节的方法进行处理,样品平行测定7次,计算标准偏差S,根据MDL=S×t(在99% 置信区间,t6= 3.143)计算方法检出限。
结果显示,甲酰胺的方法检出限(LOD)为0.02 mg/L,其余4种化合物的方法检出限均为2×10-4 mg/L,具体见表2。
配置0.016~0.16 mg/L的3种不同水平的水溶液(甲酰胺浓度为0.8~8.0 mg/L),按照1.4节的方法进行精密度实验测试,每个浓度平行测定6次,方法平均回收率和精密度测定结果见表2。
从表2可知,5种酰胺类化合物的加标平均回收率在81.6%~100.6%之间,相對标准偏差(RSD)在0.37%~6.60%之间,说明该方法测得的数据准确可靠,具有可行性。
2.4 实际样品测试
为了验证方法的实用性,分别采集了3种不同环境的水样,包括地表水、台州市某化工厂废水以及台州市某河道水,按照方法进行测定,测定结果见表3,被测的台州市某地表水和台州市某河道水均未检出目标化合物,而化工厂废水含有一定浓度的N,N-二甲基甲酰胺,N,N-二甲基甲酰胺的含量为0.069 mg/L。
3 结 论
本文对酰胺类化合物的固相萃取条件进行了优化,采用固相萃取小柱预先净化,流动相乙腈∶水 (5∶95,V/V),流速为1.0 mL/min,柱温:30 ℃,检测波长在195 nm 条件下测定环境水样中的甲酰胺、N-甲基甲酰胺、N-甲基乙酰胺、DMF和DMAC5种物质在同一色谱分析条件下能够完全分离,互不干扰,峰型较好,检出限为2×10-4~0.02 mg/L。该HPLC方法具有灵敏快速、操作简便、准确度和精密度高等特点,适用于废水、河道水等环境水样中酰胺类化合物含量的测定。
参考文献:
[1] 周珊. 2011-2014年福建福鼎市合成革业二甲基甲酰胺职业危害现况[J]. 公共卫生与预防医学,2016,27(06): 60-62.
[2]HJ 801-2016,环境空气和废气中 酰胺类化合物的测定 液相色谱法[S]. 北京: 中华人民共和国生态环境部,2016.
[3]GB 5749-2006,生活饮用水卫生标准[S]. 北京: 中国标准出版社,2007.
[4]US EPA Method 8032A, Acrylamide by gaschromatography [S]. United States Environmental Protection Agency, 1996.
[5]常风民,王启宝,周岳溪,等. 水样中二甲基乙酰胺不同测定方法比较[J]. 环境工程学报,2012,6(04): 1271-1274.
[6]徐建芬,唐访良,张明,等. 气相色谱法测定水中4种酰胺类化合物含量[J]. 理化检验(化学分册) ,2015,51(08): 1191-1193.
[7]刘云富,谭广辉. 同时测定工作场所空气中二甲基甲酰胺和二甲基乙酰胺的气相色谱质谱联用测定法[J]. 职业与健康,2014,30 (21): 3046-3047+3050.
[8]曹金朋,张娜,等. 紫外分光光度法测定水中N,N - 二甲基乙酰胺[J]. 现代仪器与医疗,2008(3): 63 -64+67.
[9]熊杰,钱蜀,谢永洪,等. 高效液相色谱-串联质谱法同时测定水中丙烯酰胺、苯胺和联苯胺[J]. 分析化学,2014,42(01): 93-98.
[10] 付晓燕,李振国,包艳英,等. 直接进样-超高效液相色谱-串联质谱测地表水中丙烯酰胺[J]. 中国环境监测,2014,30(05): 77-79.
[11] 邹康兵,向彩红,董玉莲. 超高效液相色谱-质谱串联法测定饮用水中的丙烯酰胺[J]. 广州化学,2017,42(03): 47-50.
[12]张明,唐访良,范晓开,等. 固相萃取-亲水相互作用液相色谱法同时测定环境水样中3种酰胺类化合物[J]. 分析化学,2012,40(10): 1555-1560.
[13] US EPA Method 8316, Acrylamide, Acrylonitrile and acrolein by High Performance Liquid Chromatography[S]. United States Environmental Protection Agency, 1994.
[14]譚倩,余涛,陈秀杰. 高效液相色谱法同时测定水中的二甲基甲酰胺和二甲基乙酰胺[J]. 中国卫生检验杂志,2015,25(10): 1513-1515.
[15] 马颖,常希平,张建柱,等. 固相萃取-高效液相色法测定饮用水中的丙烯酰胺[J]. 现代科学仪器,2013(02): 153-156+159.
