锂硫电池的实用化挑战
2020-04-04王维坤王安邦金朝庆
王维坤,王安邦,金朝庆
(军事科学院防化研究院,北京 100191)
锂硫电池以其高比能量、原料廉价、环境友好等特点,被认为是继锂离子电池之后最有可能实用化的二次电池新体系。然而,锂硫电池从发明至今已有60年的时间,集中研发也近10年,尚未实现真正意义上的规模应用,原因何在?众所周知,锂硫电池存在正极活性物导电性差、穿梭效应、体积膨胀及自放电等科学层面的固有问题,这里不作深入讨论。我们在软包装锂硫电池研发方面耕耘多年,积累了一些经验,本文从实用化层面将制约锂硫电池发展的问题进行了梳理、分析,希望能抛砖引玉,引发大家对相关问题的关注、思考和讨论,共同推动锂硫电池的产业化进程。
1 锂硫电池正极面容量低的问题
图1是400W·h/kg锂硫电池各组分的重量分布图,由图可知,活性物质硫在电池中的含量仅占15%。主要原因在于单质硫的密度较小,在电池有限的体积中难以填装大量的硫,加上锂硫电池电解液用量大,使得锂硫电池的实际能量密度远低于理论值,即电池的实现效率低。要实现锂硫电池的高比能量,首先应当提高电池硫的填装量,同时提高硫的比容量,即获得高面容量的正极。
高面容量正极要通过“四高”途径—正极材料高含硫、正极高含硫、正极高载硫及高的活性物质利用率(即硫的比容量)来实现,其中前“三高”是前提条件,在这些前提条件下,要尽可能提高活性物质硫的利用率。如400 W·h/kg的锂硫电池,正极片的面容量需达到5 mA·h/cm2以上。假设硫的比容量达到1250 mA·h/g,那么正极的载硫量要大于4 mg/cm2(单面),一般来说正极含硫量要大于75%,同时满足上述条件,对于锂硫电池来说并非易事。锂硫电池正极存在放电中间溶解-沉积现象,意味着多硫离子浓度梯度和空间分布发生变化,导致扩散路径和反应动力学发生改变。极片含硫和载硫越高,多硫离子浓度梯度和空间分布变化越大,越难以实现硫的高比容量。而提高硫的比容量是提高电池比能量的最直接、有效的途径。以10 A·h锂硫软包装电池为例,硫的比容量每提高100mA·h/g,电池的比能量将提高50~60 W·h/kg。
如何实现正极高含硫、高载硫条件下硫的高比容量?正极材料的设计制备是关键。笔者的正极材料结构设计思路是:①高含硫,材料含硫量大于85%,以保证极片的高含硫;②将硫与经过表面处理的导电碳进行均匀复合,碳材料提供高活性的电化学反应界面;③通过造孔剂的应用,构建具有丰富离子通道的材料微结构,解决放电产物的体积膨胀问题,保证离子扩散的通畅;④利用外壳层的包覆作用适当限制多硫离子的扩散[1-2]。这些措施可以使硫的比容量达到1200 mA·h/g以上,但距离硫的理论容量还有差距,硫的比容量挖掘潜力在何处呢?笔者认为,从Li2S2还原至Li2S还有418mA·h/g的容量提升空间,是硫的比容量提升潜力所在,但由于是固相-固相反应,动力学速率慢,转化效率低,需要借助催化剂的作用。近年来文献中关于催化Li2S的电化学可逆转化物质的报道越来越多,也出现了1600 mA·h/g以上的接近硫的理论比容量的数据[3],说明Li2S2转化至Li2S的过程是可以实现的。我们在正极材料制备时,在外包覆层中引入特殊成分,通过电解液的添加剂与正极材料外包覆层中的特殊成分相互作用,原位生成功能层,来促进Li2S2和Li2S的可逆转化。通过这种原位功能层的作用,所制备的9 A·h电池,极片载硫5.2 mg/cm2,极片含硫78%的情况下,0.05C倍率下放电,硫的比容量可以达到1500mA·h/g,电池比能量达到605W·h/kg,说明在高含硫、高载硫正极中实现硫的高利用率、达到或接近硫的理论容量是可实现的目标,值得进一步探索。
2 锂硫电池电解液用量高的问题
锂硫电池中电解液用量大,约占电池总重的50%左右,是锂硫电池实现效率不高的主要原因之一。锂硫电池电解液用量大的原因如下。①单质硫溶解放电机制所致。硫是电子、离子绝缘的物质,只有边放电、边溶解,才能保证电子、离子通道的畅通,进而保证电化学反应的顺利进行。在锂硫电池体系中,电解液不仅传输锂离子,还需要溶剂化不同放电阶段的中间产物,因此需要大量的电解液溶剂。②电池循环过程中,负极锂的粉化会消耗大量电解液。由于锂表面的SEI膜不稳定,每次循环都经历破坏、重建的过程,而且随着循环的进行,锂的粉化导致比表面积增加,对电解液的消耗也会增加。
减少电解液用量,是提升锂硫电池比能量的直接途径。一般认为以下三种途径可能减少电解液用量。①少电解液体系的开发。锂硫电池通用的电解液是以一定比例的DOL和DME为混合溶剂,采用LiTFSI为电解质盐,加上LiNO3添加剂组成,在软包装电池的通常用量是E/S摩尔比为3~3.5。文献中有关于减少锂硫电池电解液用量的报道,如选用对多硫离子溶剂化程度低的腈类溶剂[4]、对多硫离子溶解度低的氟代醚类溶剂[5]及降低溶剂活性,减少副反应,改变溶解-沉积机制为半固态机制等[6],这些工作虽然在一定程度上可以降低电解液用量,但往往以增加极化、降低材料利用率为代价,目前尚无有效的可取代现有的DOL/DME组合的溶剂。我们从降低黏度角度设计电解液的组成和配比。锂硫电池放电过程有多硫离子溶解进入电解液中,本身可以作为电解质盐承担离子输运作用,这样可以适当降低电解质盐的用量,获得低黏度、低密度的电解液,同时不影响电解液的离子电导。以此思路制备的电解液,在降低E/S值时,也不会因为电解液黏度过大而增加电池极化、降低容量。我们将常用醚类溶剂DOL/DME中电解质盐的浓度降至0.6 mol/L LiTFSI/0.4 mol/L LiNO3,E/S摩尔比为2.5时,电池的比能量可以达到500 W·h/kg以上,E/S摩尔比为2.2时,电池的比能量可以达到550W·h/kg以上。由此可见,锂硫电池中的电解液量是可能减少的。探索在溶解机制的锂硫电池中电解液减量以及减量的极限需要引起更多的关注。②寻找非溶解机制的正极材料。与溶解机制的正极材料相比,非溶解机制的正极材料在减少电解液用量上具有先天优势。硫化聚丙烯腈(SPAN)即是此类材料的典型代表。表1对比了溶解机制和非溶解机制含硫正极材料的各项性能。由表可知,除了容量和放电电压低于溶解机制正极材料外,非溶解机制正极材料在循环稳定性上和减少电解液用量方面具有明显优势,如果能找到提升其容量和电压的技术途径,SPAN完全可以用于构建一类新型的高比能、长寿命锂电池。如何提高SPAN的容量和电压呢?首先要研究清楚其储锂机制。笔者首次采用固体核磁技术,详细研究了SPAN在放电过程中的碳杂化结构的变化,结果表明,SPAN在首次放电过程中,除了硫-硫键断裂外,一部分吡啶环中的C=N和C=C双键打开与锂发生了反应,形成“共轭双键储锂”,因而SPAN的实际放电比容量超过硫的理论比容量;而在首次充电过程中,一部分碳原子和氮原子未发生脱锂反应,进而使一部分锂离子残留在充电产物中,造成较大的首次不可逆容量损失;但是残留在充电产物中的锂离子有利于提高材料的导电性,因此第二次的放电电压高于首次放电电压[7]。这种新机制的发现,突破了以往一味提高硫含量来提高此类材料容量的局限,开辟了优化结构提高性能的新思路,也为开发同类型新材料提供了理论基础。SPAN与锂离子电池通用的碳酸酯类电解液匹配性良好,可以与锂离子电池正极材料相类比。例如,与三元或富锂锰基正极材料相比,SPAN对锂的电位虽然仅是前者的一半,但容量却超过前者的2倍,完全可以构建高比能量电池体系,值得大家关注。③对锂负极进行表面保护,生成稳定的SEI膜,减少对电解液的消耗,该问题在此不做详细讨论。
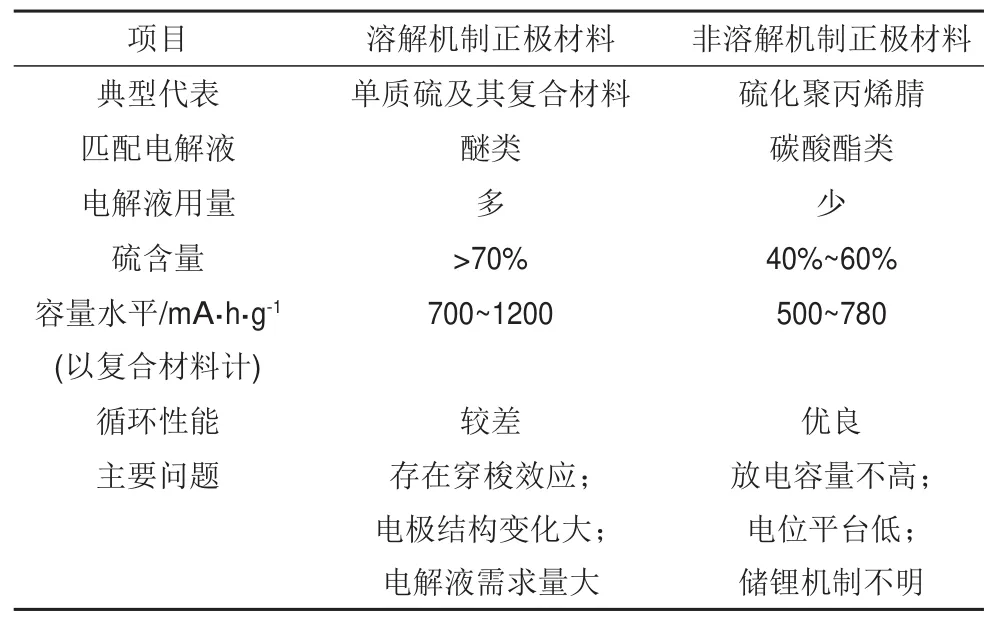
表1 溶解机制和非溶解机制含硫正极材料的各项性能Table 1 Characteristics of two cathode materials with solubilization mechanism and insolubilization mechanism
3 锂硫电池的倍率问题
影响锂硫电池倍率性能的主要因素有两方面,一是电极的导电性,包括电子导电性和离子传导能力;二是活性物反应机制相关的动力学特性。一般认为,单质硫是电绝缘性物质,而且其正极电化学反应过程涉及固-液-固相转化,动力学性能较差,导致锂硫电池的倍率性能不佳。文献中提高锂硫电池的倍率性能有以下几个途径,一是在材料或电极中引入碳纳米管或石墨烯等增加导电性;二是采用金属氧化物、硫化物、氮化物等具有催化作用的物质,加快Li2S的电化学转化速率;三是通过聚离子性的黏合剂增加离子通道[8]。通过这些技术途径,实现了10C以上的高倍率放电。但要注意这些高倍率数据是在正极硫载量不高、电解液用量很大的扣式电池中实现的,在实际软包装电池中,正极硫载量较高、电解液用量少的情况下,效果如何有待验证。
我们提高电池倍率性能的途径依然从正极材料入手:首先在材料中引入点-线-面导电网络,构筑丰富的电化学反应界面,提高电子导电性;掺入元素硒,进一步提高电子导电性;引入催化剂,提高电化学反应动力学性能;材料多孔结构设计有利于电解液的浸润和离子的输运。基于此正极材料的锂硫电池具有良好的倍率性能:我们所制备的2.4A·h电池,极片载硫4.8 mg/cm2,极片含硫78%,E/S摩尔比为3.3、0.2C充电、0.4C放电的制度下,比能量达到390 W·h/kg,可以循环100周;制备的8.5A·h电池,极片载硫5.2 mg/cm2,极片含硫78%,E/S摩尔比为2.2、0.1C充放电,比能量达到575 W·h/kg;制备的5A·h电池,极片载硫5.2 mg/cm2,极片含硫78%,E/S摩尔比为3.5,比能量达到400 W·h/kg,1C放电容量是0.2C放电容量的90%。这些结果说明正极材料电子导电通路、离子通道构筑及催化作用物质的引入可以实现锂硫电池的高倍率放电。目前提高硫的电化学转化速率的各类具有催化作用的物质(金属氧化物、硫化物、氮化物、磷化物、有机物等)研究报道众多,如何评估比较其作用,机制是什么?哪一类最有潜力?是值得深入研究的方向。
4 锂负极的问题
锂负极的界面不稳定性造成枝晶、粉化和体积变化大等问题是锂二次电池面临的共性问题,在锂硫电池体系中,锂负极的问题显得更加突出,严重制约着锂硫电池的发展,主要原因如下。①锂硫电池的电压较低,仅为2.1 V,其高的比能量来自于电池体系高比容量的贡献,这就意味着电极要具有很高的面容量。例如,锂硫电池的比能量要达到400 W·h/kg,其极片单面需提供5 mA·h/cm2以上的面容量,双面达到10 mA·h/cm2,在这样高的面容量下,每次循环,金属锂负极的双面需涉及50 μm锂的溶出和沉积的巨大体积变化,而金属锂是无宿主的负极,自身既做活性物,又做集流体,为了获得高的电池比能量,其容量冗余不超过正极容量的3倍,在没有稳定的骨架支撑情况下,会迅速出现枝晶、粉化、断裂的现象,电池容量衰减严重,并可能出现安全问题。②大容量锂的不均匀沉积导致粉化现象严重,会大量消耗电解液溶剂及其中能够稳定锂负极的物质,使电池的循环效率迅速下降,同时伴随容量保持率迅速下降。
目前,国内外研究人员对于提高金属锂负极的稳定性、抑制其枝晶的生长投入极大的热情,正在尝试从多种途径解决问题,如成膜添加剂的应用,锂表面非原位SEI膜的构建、高盐浓度电解液的应用、三维骨架的引入,或者上述两种或几种方法的综合应用等,虽然这些方法均在一定程度上缓解了枝晶的产生,锂的循环稳定性也有些提高(例如,锂硫电池的寿命停留在100次),但距离彻底解决锂负极的问题尚有很大差距。
我们曾经最先将锂硼合金用作锂硫电池的负极,充放电50次之后负极表面的平整光洁度远优于金属锂和锂铝合金负极,寿命也明显延长;与在金属锂上的沉积相比,锂在锂硼合金上的沉积效率既高且稳定,显示出解决金属锂的上述问题的良好苗头[9-10]。
锂负极的表面处理要非常慎重。笔者以安时级的软包锂硫电池,探索了锂负极表面的原位或非原位多种处理方式,在用处理过的锂负极组装锂硫电池时发现,锂负极表面微小的改变,即可以引起电池容量的较大变化,我们称之为锂硫电池中的“蝴蝶效应”。众所周知,电池的容量是由低容量的电极决定的,在锂硫电池中,锂负极容量大大过量,锂硫电池的容量应该等同于正极的容量,与负极相关性不大。然而实际组装电池时,却经常出现锂负极经处理后,不但使电池的循环性能发生变化,容量也有明显的提高或降低现象,文献中也有类似报道[11]。说明锂硫电池体系的复杂程度超乎想象,还有许多尚未认知的机制或反应过程需要更加深入的研究。
5 结语
目前,锂离子电池在比能量上的进步日新月异,使锂硫电池的发展面临巨大挑战。锂硫电池的研究方兴未艾,实用化进程仍步履蹒跚,其进步需要研究者们基于科学评价体系下认真、踏实的工作。全寿命周期锂硫电池服役和拆解的安全性目前研究的较少,需要后期系统研究。锂硫电池体系复杂,入门容易,进阶困难,这是所有从事锂硫电池研究同仁们的共识。抱着讲好故事、发好文章的心态只会永远停留在锂硫电池研发的初级阶段,触及不到问题实质,也就很难对其实用化起到真正的推动作用。希望本文能为有志于推动锂硫电池实用化的研究者提供一点思路和借鉴。
