临床分离碳青霉烯类耐药肺炎克雷伯菌株的血清荚膜分型及耐药机制
2020-04-03严宏,严华
严 宏,严 华
(武汉市第三医院光谷院区:1.检验科;2急诊科,湖北武汉 430073)
肺炎克雷伯菌(KP)是临床主要的条件致病菌之一,主要引起医院获得性肺炎及血流感染性疾病,尤其在新生儿、老年人、肿瘤患者等免疫力低下人群,或长期使用抗菌药物人群中易感[1-2]。碳青霉烯类抗菌药物因其抗菌谱广,稳定性较好等优点而被用为治疗临床感染的首选药物[3]。但随着该类抗菌药物频繁使用,碳青霉烯类耐药肺炎克雷伯菌(CRKP)逐渐增多。研究发现部分KP可产生荚膜,形成高黏液表型,具有高毒力,高耐药率等特点[4]。荚膜是KP重要的毒力因子,其种类多变,主要由酸性脂多糖组成,与病原菌的毒力有关。薛娟等[5]研究结果显示,感染CRKP患者较其他病原菌感染患者病死率显著增加。因此,对本院分离的CRKP菌株血清荚膜进行分型,研究其具体耐药机制,有利于对CRKP感染患者进行针对性用药,减少患者病死率。
1 材料与方法
1.1菌株来源 收集2016年2月至2018年2月本院各种临床标本(血液、尿液、痰液、腹腔引流液等),排除同一患者同一部位重复标本,共获取KP 316例,其中CRKP 126株,男性患者80例(5例患者从不同部位分离到菌株),女性患者38例(3例患者从不同部位分离到菌株);痰液中分离菌株82株,血液中分离24株,尿液中分离7株,腹腔引流液中分离13株。质控菌包括大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC BAA-1705、肺炎克雷伯菌ATCC BAA-1706。本研究所有菌株均采用Vitek2-Compact全自动微生物鉴定仪进行鉴定。本研究经医院伦理委员会批准。
1.2仪器与试剂 主要包括Vitek-2 Compact全自动微生物鉴定仪及配套药敏卡、细菌浊度仪、凝胶成像系统、PCR仪、ABI-PRISM 3730测序仪、DYC-6C电泳仪。PCR反应试剂盒购自日本TaKaRa公司。
1.3方法
1.3.1菌株鉴定及药敏试验 本研究采用Vitek-2 Compact全自动微生物鉴定仪对分离菌株进行体外药物敏感试验,参照美国临床和实验室标准协会(CLSI)规定标准[6],美国食品药品监督管理局(FDA)标准[7]判读替加环素敏感性,进一步确定CRKP和不耐药的KPN(non-CRKP)。
1.3.2黏液丝试验 将菌种接种于血琼脂平板,35 ℃培养过夜,以接种环轻轻挑起菌落后,黏液丝长度≥5 mm为试验阳性,重复三次以上均阳性者为黏液菌株。
1.3.3碳青霉烯酶表型检测 (1)改良Hodge试验:将配制好的0.5麦氏浊度的大肠埃希菌ATCC 25922菌液稀释,将菌液均匀涂布于MH平板,3~5 min后,在培养基中央放置美罗培南纸片,挑选3~5个待测菌种纯菌落垂直于纸片,自纸片外缘向平板边缘划线接种,以ATCC BAA-1705为阳性对照,ATCC BAA-1706为阴性对照,35 ℃培养孵育16~18 h。评价标准:待测菌株与大肠埃希菌ATCC 25922抑菌圈交界处出现向内增强生长,抑菌圈不规则,表明该待测菌种为碳青霉烯酶菌株。(2)碳青霉烯酶抑制试验(CIM):以ATCC BAA-1705为阳性对照,ATCC BAA-1706为阴性对照,将待测菌种混入1.5 mL无菌双蒸水内,加入亚胺培南纸片(10 μg),35 ℃培养孵育4 h,将配制好的0.5麦氏浊度的大肠埃希菌ATCC 25922菌液稀释,将菌液均匀涂布于MH平板培养基,取出孵育好的纸片贴于MH平板,35 ℃培养过夜,观察结果。结果评价标准:大肠埃希菌ATCC 25922生长不受抑制,为产碳青霉烯酶菌株;大肠埃希菌ATCC 25922生长受抑制,为不产碳青霉烯酶菌株。
1.3.4PCR检测血清荚膜、耐药基因及高毒力基因 利用PCR法检测扩增菌株K1、K2、K5、K20、K54、K57等常见荚膜基因型,常见碳青霉烯酶耐药基因KPC、NDM、VIM、IMP、OXA-48,β-内酰胺酶基因TEM、SHV、CTX-M,膜孔蛋白基因Ompk35、Ompk36,AmpC酶基因DHA,常见毒力基因magA、rmpA、rmpA2、aerobactin、wcaG、mrkD、iroN、allS,引物、反应体系及反应条件参考文献[8],序列见表1。
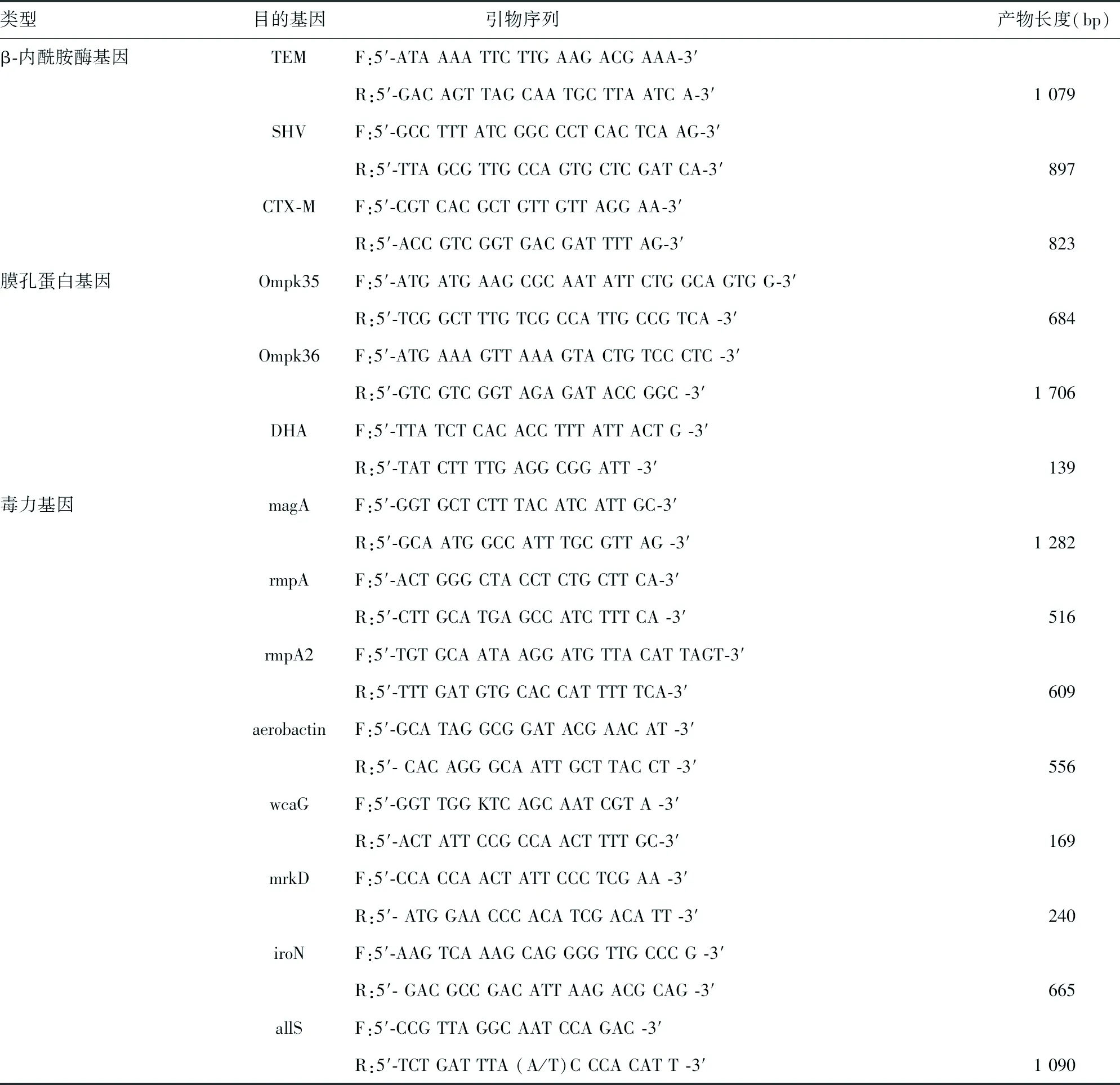
续表1 扩增基因的引物序列
注:F代表上游引物;R代表下游引物。
2 结 果
2.1药敏检测结果 本研究共分离出CRKP 126株,占39.87%。126株CRKP菌株中,对头孢菌素类、酶抑制剂类、碳青霉烯类、单环类药物耐药率最高,显著高于non-CRKP菌株(P<0.05),替加环素类耐药率最低,与non-CRKP菌株差异无统计学意义(P>0.05)。见表2。
2.2碳青霉烯酶表型检测结果 改良Hodge试验阳性106株,阳性率33.54%;CIM试验阳性117株,阳性率37.03%。见图1。
2.3血清荚膜分型及毒力基因 12株CRKP为黏液丝试验阳性,均未检测到K1、K2、K5、K20、K54、K57血清型。所有CRKP中,检测出K1血清型10株,均携带黏液表型调控基因rmpA基因,K2、K5、K20、K54、K57血清型均未检测到,尚未分型116株。126株CRKP均检测到毒力基因fimH基因,比例最高(100%),见表3。
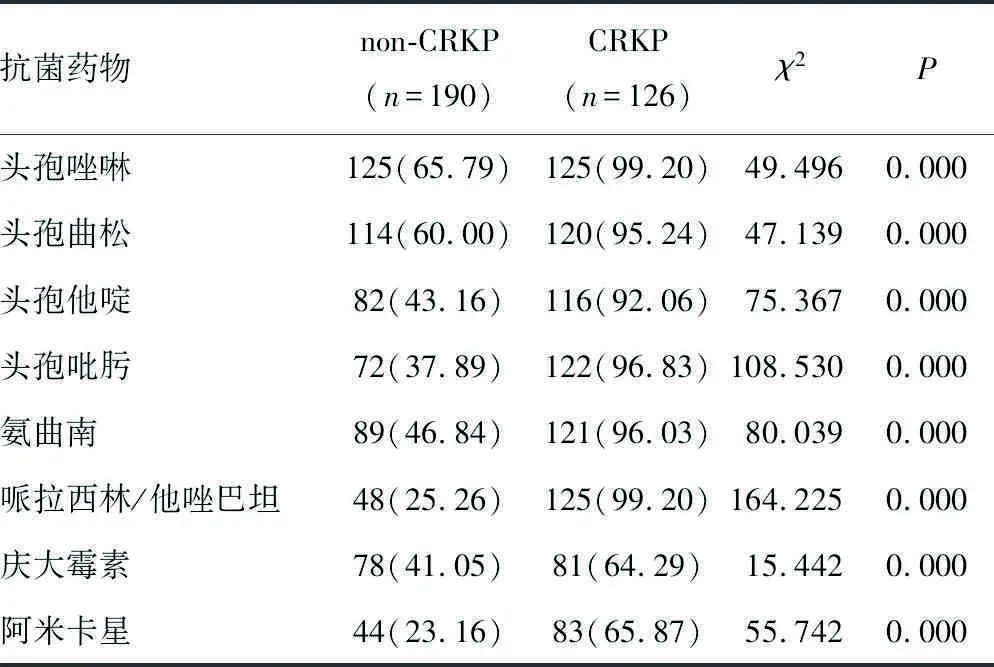
表2 药敏试验结果的比较[n(%)]
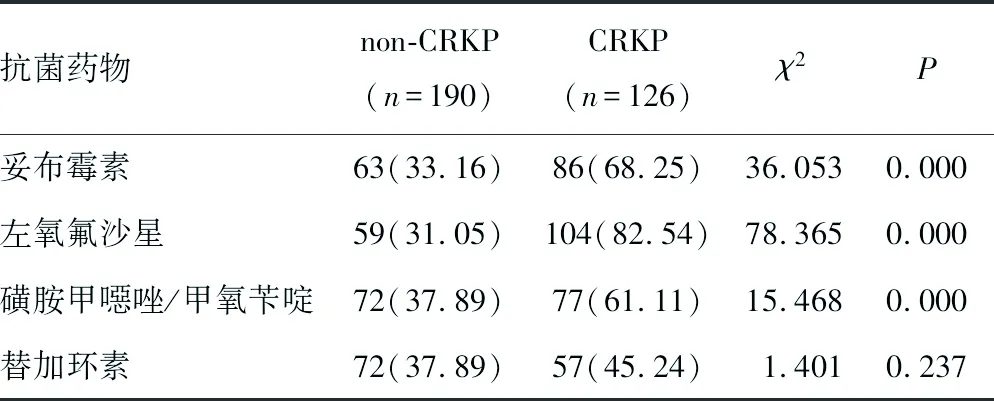
续表2 药敏试验结果的比较[n(%)]
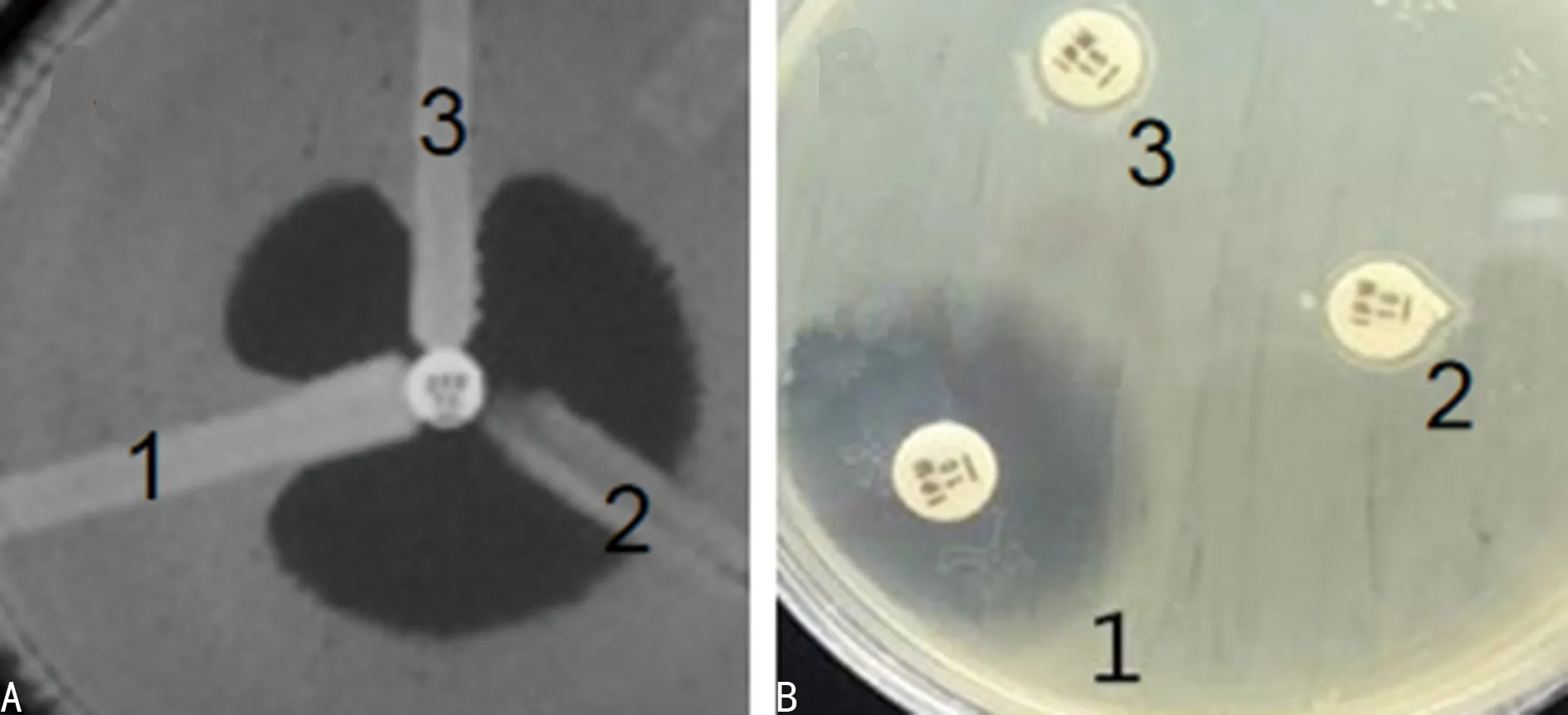
注:A表示改良Hode试验,B表示CIM试阳。图A中,1为ATCC1705,2为ATCC1706,3为阳性菌株;图B中,1为ATCC1706,2为阳性菌株,3为ATCC1705。
图1碳青霉烯酶表型检测
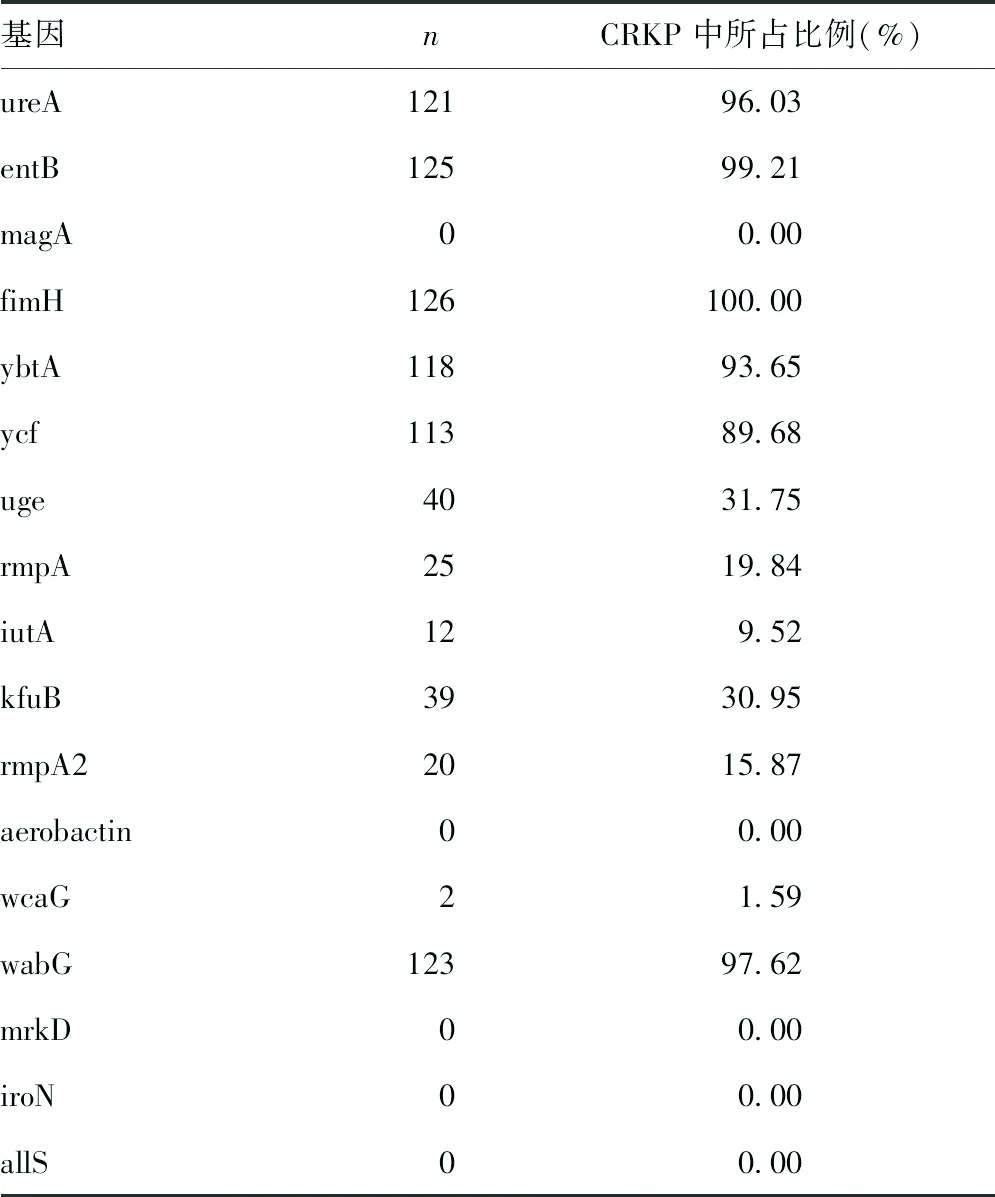
表3 毒力基因的分布
2.4耐药基因及膜孔蛋白检测结果 126株CRKP中,检测出A类碳青霉烯酶KPC基因117株,NDM基因6株,IMP基因3株;β-内酰胺酶基因TEM基因53株,SHV基因100株,CTX-M基因112株,膜孔蛋白Ompk35基因缺失50株,Ompk36基因缺失94株,其中,缺失Ompk35膜孔蛋白基因的菌种均同时缺失Ompk36基因。见表4。
2.5CRKP携带耐药基因情况 CRKP中携带4种不同耐药基因的菌株数目最多,共64株,携带6种及不携带耐药基因的菌株数目最少,仅有1株。见表5。
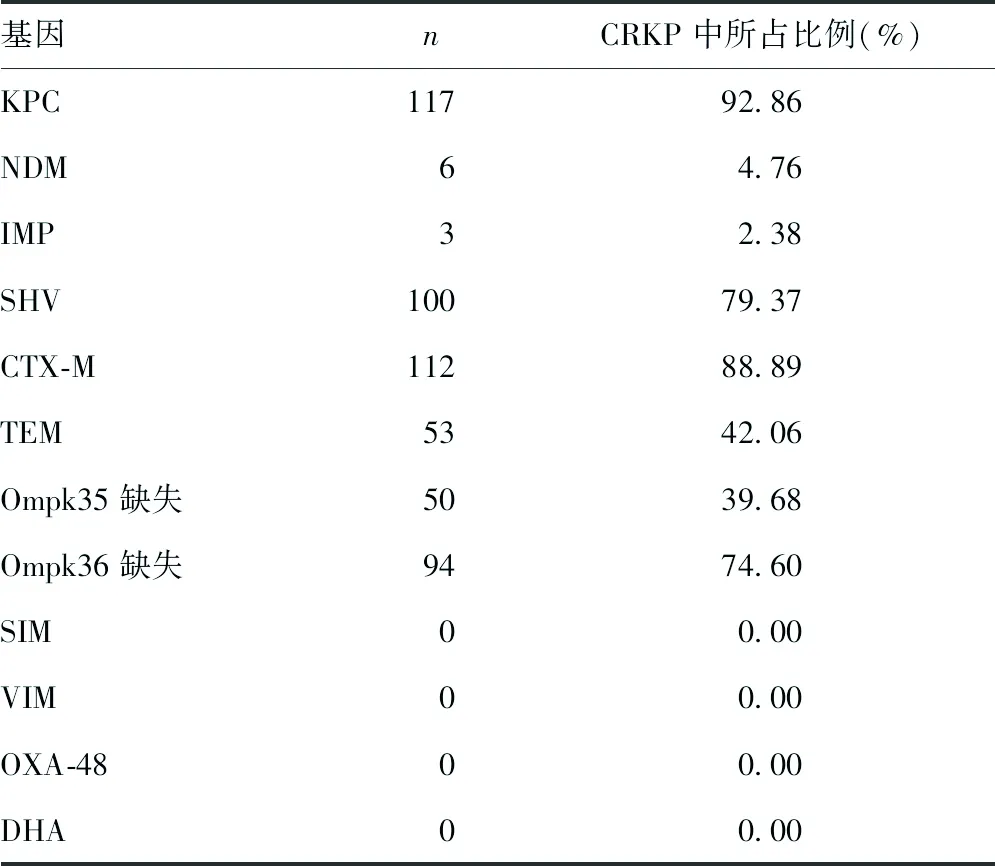
表4 耐药基因及膜孔蛋白检测结果

表5 CRKP携带耐药基因情况
3 讨 论
KP作为临床重要的条件致病菌之一,近年来,研究显示,其对主要的抗菌碳青霉烯类药物耐药率不断上升,CRKP比例不断上升,部分地区有暴发流行趋势。已有研究表明,CRKP感染患者病死率显著增加[5]。CRKP引起患者死亡主要与其多重耐药、毒力表达有关[9]。目前研究结果显示,CRKP主要耐药机制为菌体产生碳青霉烯酶,可水解抗菌药物[10]。此外,还有研究报道,其耐药性可能与AmpC酶合并外膜孔蛋白通透性改变有关[11]。本研究从本院患者临床标本中分离出CRKP 126株,占39.87%,其中对头孢菌素类、酶抑制剂类、碳青霉烯类、单环类药物耐药率最高,显著高于non-CRKP菌株,替加环素类耐药率最低,与non-CRKP菌株差异无统计学意义,表明CRKP对多类抗菌药物耐药,本研究结果提示,临床可对CRKP使用替加环素治疗。
荚膜作为KP重要的毒力因子,主要由酸性脂多糖组成,其中甘露糖与荚膜毒力有关,研究显示,高毒力KP可产生大量荚膜多糖,荚膜呈高黏液表型,是重要的致病因素[12]。本研究通过黏液丝试验表明,分离得到的126株CRKP中,共有12株为高黏液丝菌株。根据K抗原分型,目前荚膜有80多种血清分型,常见的主要是K1、K2、K5、K20、K54、K57。以往研究表明,K抗原在高黏液性毒力KP上检出率高达85%[13],在本研究检出的12株高黏液菌株中,均未检测到K抗原,与冯晓静等[12]研究结果不符,推测原因可能为该12株菌株表达为其他未检测荚膜分型,或是获得耐药性后荚膜基因表达减弱。126株 CRKP中,检测出K1血清型10株,均携带黏液表型调控基因rmpA基因,但均未表现出高黏液表型,目前关于rmpA基因与高黏液表型的关系仍未得到阐明,具体原因有待进一步研究分析。在本研究中,各种毒力基因均有不同程度表达,毒力基因fimH基因比例最高。陈妍妍等[14]报道发现,菌毛黏附在细菌感染中发挥重要作用,fimH基因是介导Ⅰ型菌毛的基因,与王欢欢等[15]报道KP中普遍存在Ⅰ型菌毛一致,提示fimH基因是CRKP中重要的毒力基因。
碳青霉烯酶主要分为A、B、D类,A类酶主要包括KPC、SME、NMC、IMI、GES等基因,B类酶又称为β-内酰胺酶,包括IMP、VIM、NDM、SIM、GIM等基因。KPC作为我国目前流行的A类碳青霉烯酶,可水解大多数青霉素类、头孢素类抗菌药物。本研究采用改良Hodge试验及CIM试验检测菌株碳青霉烯酶表型,结果显示改良Hodge试验阳性106株,CIM试验阳性117株,其中CIM试验检测结果与PCR结果一致,推测可能是由于部分菌株产碳青霉烯酶量较少,致使结果判断出现假阴性。PCR结果表明,检测出A类碳青霉烯酶KPC基因117株,NDM基因6株,IMP基因3株;β-内酰胺酶基因TEM基因53株,SHV基因100株,CTX-M基因112株,膜孔蛋白Ompk35基因缺失50株,Ompk36基因缺失94株,其中,缺失Ompk35膜孔蛋白基因的菌种均同时缺失Ompk36基因,提示本院分离到的126株CRKP中,主要耐药机制为产碳青霉烯酶,同时合并有部分菌株膜孔蛋白通透性改变。本研究统计分析发现,分离获得的126株CRKP中,以携带4种不同耐药基因的菌株数目最多,提示在临床工作中要采用不同方法对菌株的耐药机制进行检测,选择合适药物进行治疗。
4 结 论
本研究分离获得的CRKP主要耐药机制为产碳青霉烯酶,部分菌株合并有膜孔蛋白基因缺失,但关于CRKP荚膜血清分型尚不清楚,将进一步进行探究。
