干旱胁迫对不同耐性花生品种生理特性及产量的影响
2020-04-02董奇琦张艳正张克朝周东英王晓光蒋春姬赵姝丽于海秋赵新华
董奇琦,艾 鑫,张艳正,张克朝,周东英,王晓光,蒋春姬,赵姝丽,钟 超,王 婧,于海秋,赵新华
(沈阳农业大学 农学院,沈阳110161)
花生(Arachis hypogaea L.)是我国和世界重要的油料作物之一,占油料作物栽培面积的1/4,其子仁含油率45%~56%,富含蛋白质、糖类化合物、纤维素等营养物质,是重要的优质食用油来源和营养保健食品。花生是一种耐旱作物,具有扎根较深、开花量大、花期长、水分利用率较高等特点,抗旱性较强。然而,我国花生多种植在干旱半干旱的沙性土壤中, 且大多数种植区都是靠自然降水[1]。因此,干旱是限制花生产量最重要的非生物胁迫因素之一[2-3]。不同耐旱性花生基因型存在显著差异[4],这种差异的基础是不同基因型对干旱胁迫的生理响应不同,包括生长发育[3]、光合速率、叶绿素荧光参数[5-6]、活性氧产生[7]和产量等相关性状的变化。然而,持续干旱胁迫下花生的耐性生理机制还了解甚少。
干旱胁迫影响花生的生长发育、生理代谢,进而使产量和品质也受到影响。干旱胁迫抑制作物光合速率(Pn),降低叶绿素含量[8],光反应活性和Rubisco酶活性[9]。随着干旱的持续,作物叶片净光合速率[10]、气孔导度(Gs)、胞间 CO2浓度(Ci)、最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSII)、光化学猝灭系数(qP)逐渐降低[6]。作物体内的活性氧(Reactive oxygen species,ROS)与清除活性氧的保护酶类处于动态平衡状态在植物适应非生物胁迫过程中起着关键作用。当作物处于干旱胁迫下,该动态平衡状态就会被打破,ROS含量升高,发生膜质过氧化,保护酶类包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性表现为先升后降,随着干旱胁迫时间的延长,SOD、POD和CAT活性因品种不同而出现差异[11-12]。当前对花生抗旱研究多集中在形态结构变化的描述,鲜有涉及光合作用、抗氧化酶、渗透调节等调节机制的研究。因此,阐明耐旱花生品种抗旱性的生理机制将有助于揭示花生抗旱性的遗传基础,对于提高抗旱育种水平,改进抗旱栽培措施具有重要意义。
本试验采用盆栽控水模拟不同程度的土壤水分状况,通过测定干旱胁迫下不同耐性花生品种的光合参数、荧光参数、ROS含量、抗氧化酶含量、渗透调节物质含量及产量相关指标的变化规律,分析探讨了不同耐旱性花生品种对水分缺乏响应的生理机制,为探明花生的耐旱机理、选育耐旱高产的品种提供了科学理论依据。
1 材料与方法
1.1 材料
试验于2017年5~9月在沈阳农业大学农学院试验基地移动性防雨棚内进行。选择本实验室初步筛选出的耐旱花生品种花育22(HY22)和不耐旱品种白沙1016(BS1016)[13]为试验材料。
1.2 方法
1.3 测定指标与方法
1.3.1 光合气体交换参数的测定 净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等用英国Hansatech公司生产的便携式CIRAS-2光合仪,于晴朗天气9∶00~11∶00时测定。叶室气流为100 mL·min-1,外界 CO2浓度为(390±5)μmol·mol-1。 采用内置红白光源,光强为 1500 μmol·m-2·s-1。 瞬时水分利用效率(WUE)=Pn/Tr。
1.3.2 荧光参数的测定 叶绿素荧光参数Fv/Fm(PSⅡ最大光能转换效率),ΦPSⅡ(PSⅡ实际光能转换效率),qP(光化学淬灭系数),NPQ(非光化学淬灭系数)和ETR(电子传递效率)等采用美国PPSystems公司FMS-2便携脉冲调制式荧光仪测定。首先暗适应20min,测定暗适应下初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)和光适应下的可变荧光(Fv′)、ΦPSⅡ、qP、ETR 等荧光参数。 其中 NPQ=1-(Fv′/Fv)。
1.3.3 生理指标的测定 将待测的样本从超低温冰箱中取出并擦拭干净。超氧阴离子(O2-)含量的测定参考TIAN(2003)的方法;过氧化氢(H2O2)含量的测定参考 TSAI(2004)的方法;丙二醛(MDA)含量的测定采用硫代巴比妥酸比色法;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)还原法;过氧化物酶(POD)活性采用愈创木酚氧化法;过氧化氢酶(CAT)活性采用过氧化氢分解反应法;抗坏血酸过氧化物酶(APX)活性采用紫外比色法;脯氨酸(Pro)含量采用酸性水合茚三酮显色法;可溶性蛋白(SP)含量采用考马斯亮蓝G-250染色法。
1.3.4 产量及其相关指标的测定 于花生成熟期每处理取10株样品,以每株荚果重的平均数作为其产量,并测量荚果数、饱果数、饱果重、百果重和百仁重等产量相关指标。
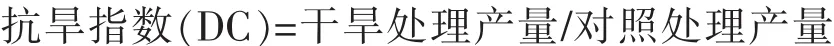
1.4 数据分析
采用SPSS17.0软件进行方差分析,用Duncan's(新复极差法)进行显著性差异比较。利用Excel 2016进行数据的处理及作图。
2 结果与分析
2.1 干旱胁迫及复水对花生光合参数的影响
干旱胁迫下,各花生品种光合参数(Pn、Tr、Gs、Ci)均表现出下降趋势(表1)。处理第7天时,受干旱的影响较小,处理间差异不显著。处理第14天时,干旱对各品种的影响达到最大,且处理与对照间均呈极显著差异。与 CK 相比,HY22 的 Pn、Tr、Gs、Ci分别下降了 92.83%、92.05%、85.99%和 32.27%,BS1016 的 Pn、Tr、Gs、Ci分别下降了96.60%、92.00%、89.33%和20.96%。此时,干旱胁迫对各品种的影响较为严重。复水后,各光合参数值均有所上升,且均高于其对照值,DS与CK间呈显著或极显著的差异。与CK相比,HY22的Pn、Tr、Gs、Ci分别上升了 21.76%、26.10%、27.13%和 19.30%,BS1016 的 Pn、Tr、Gs、Ci分别上升了 8.76%、37.91%、25.76%和7.66%。由此可以看出,HY22处于相对稳定的状态,而BS1016则波动较大,前者的耐旱性强于后者。
干旱胁迫引起了WUE的变化,处理7d时,处理与对照间的WUE相对持平,而在干旱处理14d后,与CK相比,干旱处理的WUE明显下降,差异呈极显著,并在处理21d时,降幅达到最大值,HY22、BS1016分别下降了82.27%、88.85%。可见,在缺水条件下,HY22的WUE略强于BS1016。
1.2.4 ApoM 基因 rs805264、rs707922 和 rs707921 位点的基因型及等位基因 rs805264 基因型为 GG、GA 和 AA,等位基因为 G 和 A;rs707922 基因型为GG、GT 和 TT,等位基因为 G 和 T;rs707921 基因型为 CC、CA 和 AA,等位基因为 C 和 A。
2.2 干旱胁迫及复水对花生荧光参数的影响
由表2可知,干旱胁迫下,各品种荧光参数值(Fv/Fm、ΦPSII、qP、NPQ和ETR)均呈现出规则的变化趋势。Fv/Fm、ΦPSII、qP和ETR在干旱胁迫下均呈现降低趋势,而NPQ则呈现升高趋势。HY22品种在干旱处理7d时,荧光参数值ETR与CK相比存在显著差异,Fv/Fm和qP荧光参数值与CK存在极显著差异,ΦPSII、NPQ与CK相比,ΦPSII降低,NPQ升高,但差异均不显著;干旱处理14d时,荧光参数值ΦPSII、qP、NPQ和ETR与CK相比,均存在极显著差异。与CK相比,Fv/Fm降低,但差异不显著;干旱处理21d时,各荧光参数值与CK相比,均存在极显著差异。BS1016在干旱处理7d时,荧光参数值Fv/Fm和qP显著降低,NPQ显著升高12.7%,ETR极显著降低;干旱处理14d时,Fv/Fm和NPQ与CK存在显著差异,其余荧光参数值与CK存在极显著差异;干旱处理21d时,各荧光参数值均与CK存在极显著差异。复水处理7d时,HY22和BS1016品种的荧光参数值Fv/Fm和NPQ与CK相比均增加,但HY22差异不显著,BS1016与CK存在极显著差异,其余荧光参数值均下降,其中HY22的ETR与CK存在极显著差异,BS1016的ΦPSII与CK存在极显著差异,ETR与CK存在显著差异,其余荧光参数值与CK差异不显著。
由此可见,Fv/Fm受干旱胁迫的影响较小,且HY22的Fv/Fm在受旱下更趋于稳定,降幅较小。复水后,各品种的荧光参数值均有所上升,但2个品种间无明显差异。
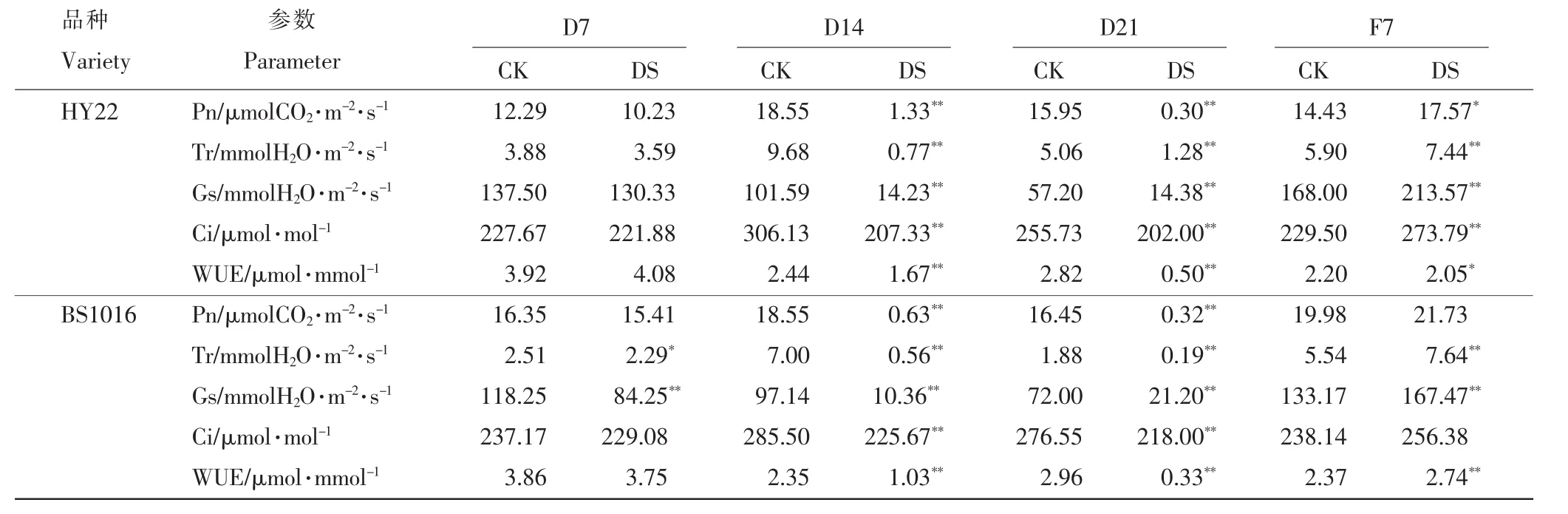
表1 干旱处理后各品种光合特性的差异Table 1 Differences in photosynthetic characteristics of various varieties after drought treatment

表2 干旱处理后各品种荧光特性的差异Table 1 Differences in fluorescence characteristics of various varieties after drought treatment
2.3 干旱胁迫及复水对花生叶片活性氧的影响
2.3.1 干旱胁迫及复水对叶片O2-含量的影响 由图1可知,在不同干旱胁迫下,HY22品种的O2-含量呈先降低后增加的趋势。中度干旱胁迫后,O2-含量呈上升趋势。与CK相比,O2-含量急剧增加且存在极显著差异。复水处理后,O2-含量降低,并且低于CK,存在极显著差异。BS1016的O2-含量随着干旱胁迫历时的延长而增加,在中度干旱胁迫后,O2-含量与CK相比急剧增加,并存在极显著差异。复水处理后,BS1016的O2-含量降低,与CK存在显著差异。BS1016在中度干旱胁迫后O2-含量增幅要高于HY22品种。
2.3.2 干旱胁迫及复水对叶片H2O2含量的影响 由图2可知,干旱处理7d时,2个品种叶片H2O2的含量与CK水平接近,差异不显著,随后随着干旱胁迫程度的增加而显著增加。BS1016叶片H2O2含量则在轻度胁迫后表现为急剧增加,达到显著水平,随后增加幅度放缓,在干旱处理21d时,达到高水平状态,升幅为4.06倍。总体上,胁迫后BS1016叶片H2O2含量及其增幅明显大于HY22。复水后,H2O2含量下降,恢复到与对照相近的水平,处理与对照间差异不显著。
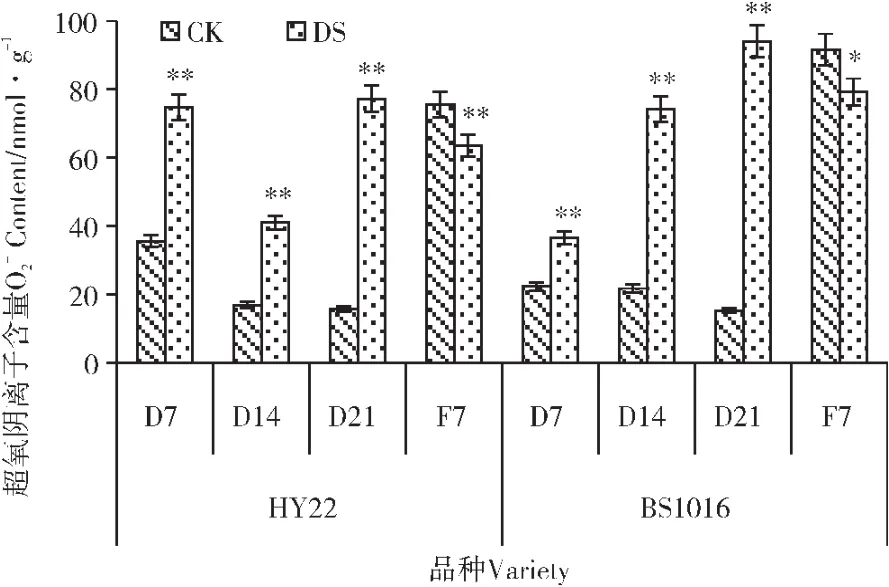
图1 干旱胁迫及复水对叶片O2-含量的影响Figure 1 Effect of drought stress and rewatering on O2-content in leaves

图2 干旱胁迫及复水对叶片H 2O2含量的影响Figure 2 Effect of drought stress and rewatering on leaf H 2O2 content
2.3.3 干旱胁迫及复水对叶片MDA含量的影响 由图3可知,干旱处理7d时,2个花生品种叶片MDA含量略低于CK,随胁迫程度的加剧而不断增加,增加幅度增大。BS1016叶片MDA含量的增幅随胁迫程度的加剧而增大,且高于HY22叶片MDA含量的增幅。在不同程度干旱胁迫处理下,HY22叶片MDA含量要低于BS1016,但差异不显著。复水后,两个花生品种的MDA含量下降,恢复情况大致相同。
2.4 干旱胁迫及复水对花生叶片抗氧化酶的影响
2.4.1 干旱胁迫及复水对叶片SOD活性的影响 由图4可知,2个花生品种的SOD活性随着胁迫程度的加剧而增加,增加幅度也随之增加。其中在轻度和中度干旱胁迫下,增幅较缓,在重度干旱胁迫时,SOD活性急剧上升,达到最高水平,与CK相比分别增加了3.12倍和2.82倍。可见,HY22的增速要高于BS1016。复水后,SOD活性下降,2个品种间无明显差别。
图3 干旱胁迫及复水对叶片MDA含量的影响Figure 3 Effect of drought stress and rewatering on leaf MDA content
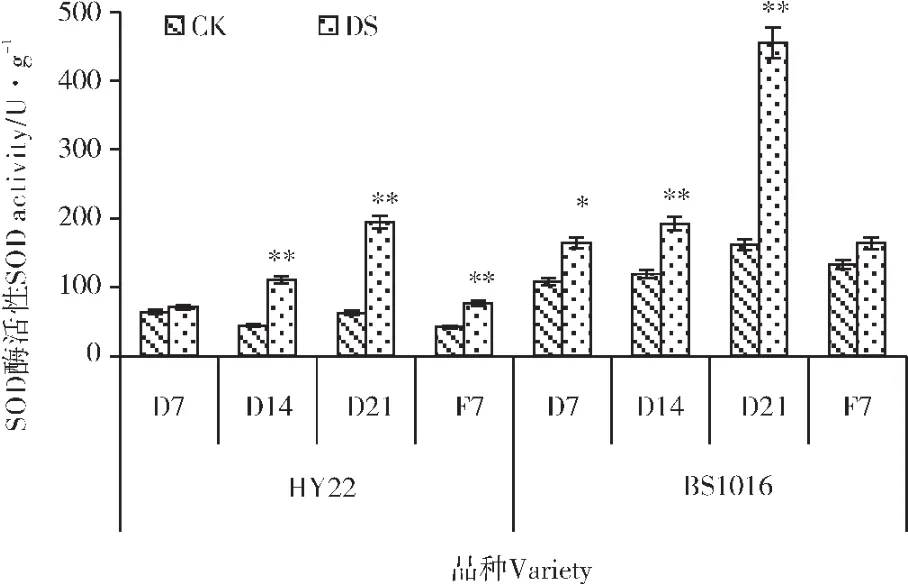
图4 干旱胁迫及复水对叶片SOD活性的影响Figure 4 Effect of drought stress and rewatering on SOD activity in leaves
2.4.2 干旱胁迫及复水对叶片POD活性的影响 由图5可知,2个供试品种叶片POD活性在轻度干旱胁迫下,显著高于CK。叶片POD活性随着胁迫程度的加剧呈现先升后降的趋势。HY22叶片POD活性随着胁迫程度的加剧先升后降,增幅较均匀,且较CK增幅十分明显,而BS1016叶片POD活性在轻度胁迫时表现轻微上升,但在胁迫处理后期,活性急剧下降,与CK差异显著。复水后,升高的幅度进一步缩小,恢复情况与对照间接近。
2.4.3 干旱胁迫及复水对叶片CAT活性的影响 由图6可知,2个品种的CAT活性随着胁迫程度的加剧而不断上升,其中HY22叶片CAT活性在轻度干旱胁迫时,叶片CAT活性较CK显著增加,中度干旱胁迫后急剧上升,增幅十分明显。BS1016叶片CAT活性随胁迫程度的增加表现为不断上升,增幅较缓,与CK存在极显著差异。总体上,HY22叶片CAT活性积累量较高于BS1016。复水后,CAT活性下降,接近对照水平,2个品种间无显著差异。

图5 干旱胁迫及复水对叶片POD活性的影响Figure 5 Effect of drought stress and rewatering on leaf POD activity

图6 干旱胁迫及复水对叶片CAT活性的影响Figure 6 Effect of drought stress and rewatering on CAT activity in leaves
2.4.4 干旱胁迫及复水对叶片APX活性的影响 由图7可知,供试的2个品种叶片APX活性均随干旱胁迫历时的增加而增加,且在干旱处理7d时,与CK无明显差异。其中HY22叶片APX活性随着胁迫程度的加剧,增幅均匀增加,与CK差异显著。BS1016叶片APX活性随着胁迫程度的增加而增加,在干旱胁迫14d时较CK有所增加,但差异不显著,随后急剧增加,在干旱处理21d时,达到较高水平,与CK存在极显著差异。复水后,2个品种的APX活性均下降,处理与对照间的水平相近,无显著差异。
2.5 干旱胁迫及复水对花生叶片渗透调节物质的影响
2.5.1 干旱胁迫及复水对叶片Pro含量的影响 由图8可知,2个供试品种的叶片Pro含量随干旱胁迫程度的增加而增加,呈先大幅急剧增加,后缓慢增加趋势,二者增长幅度相似,无显著差异。在干旱胁迫7d时,较CK有所增加,其中HY22与CK存在极显著差异。复水后,Pro含量下降,处理与对照间水平相近。

图7 干旱胁迫及复水对叶片APX活性的影响Figure 7 Effect of drought stress and rewatering on APX activity in leaves

图8 干旱胁迫及复水对叶片Pro含量的影响Figure 8 Effect of drought stress and rewatering on leaf Pro content
2.5.2 干旱胁迫及复水对叶片SP含量的影响 由图9可知,干旱胁迫后,2个供试品种叶片SP含量随着胁迫程度的增加而呈现先增加后降低的趋势。干旱处理7d时,HY22叶片Pr含量较低于CK,BS1016较高于CK,差异显著。中度干旱胁迫后,SP含量降低。复水后,又恢复到与对照相近的水平,无显著差异。
2.6 干旱胁迫及复水对花生产量及产量相关因素的影响
由表3可知,HY22的荚果数、饱果数、饱果重、百果重、百仁重、单株产量与对照相比,均降低,其中饱果数、饱果重、单株产量与对照间存在极显著差异,且分别下降26.78%、26.92%、23.02%;荚果数与对照间存在显著差异,下降24.24%;百果重、百仁重与对照间无显著差异,分别下降13.69%、8.09%。BS1016的单株产量及其各项构成因素与对照相比均降低,与对照间均存在极显著差异,且单株产量下降率达到38.32%。从抗旱指数也可看出,HY22的抗旱性强于BS1016。
3 讨论与结论
本试验研究结果表明,与不耐旱品种BS1016比,抗旱性品种HY22在干旱胁迫下伤害较轻,胁迫后其叶片气孔关闭,降低光合速率,且叶片H2O2、MDA积累较少。抗旱性品种HY22在中度和重度干旱胁迫下的抗氧化防御系统较不耐旱品种BS1016响应水平高,保护酶SOD、POD、CAT、APX活性显著增强。随着胁迫程度加剧,叶片Pro含量不断上升,但SP含量呈现先增加后降低的趋势。干旱胁迫下,HY22仍然有较高的饱果数与饱果重,减产幅度较小,且抗旱指数高。
植物的生长和代谢受土壤水分胁迫所影响,其中对光合作用的影响表现的尤为明显[14]。干旱胁迫抑制光合作用[5],光合速率下降,气孔关闭[15],使得光合参数值Pn、Tr、Gs和Ci均呈现出降低的趋势。同时,干旱胁迫条件下,作物体内叶绿素含量的变化,Fv/Fm、ΦPSII、qP、NPQ和ETR等叶绿素荧光参数发生改变影响光合作用,且这些指标的变化程度可以作为衡量植物抗旱性的重要指标[16]。有研究表明,Pn的变化主要由气孔因素和非气孔因素决定,当Gs和Ci的变化方向相同时,即两者同时下降,则Pn的降低是由气孔因素引起的,反之,Pn的降低伴随着Ci的升高,则Pn的降低要归因于叶片叶肉细胞羧化能力的下降[17]。Fv/Fm反映的是PSII原初光能转化效率及PSII潜在活性,在正常条件下变化极小,当遭受逆境胁迫时其值会迅速下降[18]。张铭[1]研究发现,在苗期,干旱胁迫下花生的光合参数值和叶绿素荧光参数值均下降,且在复水后恢复到接近正常水平,表现出小幅度超补偿效应。本研究结果表明,干旱胁迫下,2个供试品种的光合参数值(Pn、Tr、Gs、Ci)、叶绿素荧光参数值(Fv/Fm、ΦPSII、qP、NPQ和ETR)均降低,降幅随着干旱历时的延长而增大,且复水后均恢复到与对照接近水平。Fv/Fm受干旱胁迫的影响较小,且HY22的波动小于BS1016。HY22的ETR在处理7d时与CK相比呈现出显著性差异,而BS1016与CK相比则呈现出极显著的差异,说明BS1016在干旱胁迫下受到的影响比HY22敏感。在中度和重度干旱胁迫下,与BS1016相比,HY22具有较高的光能转化效率和电子传递速率用于维持植物的荧光作用,光合参数值和叶绿素荧光参数值相对波动较小。这与前人研究结果一致。可见,在干旱胁迫下,HY22的光合性能可恢复维持在相对稳定水平,受干旱的影响更小,具有更高的抗旱性。

图9 干旱胁迫及复水对叶片SP含量的影响Figure 9 Effect of drought stress and rewatering on the content of SP in leaves

表3 干旱胁迫及复水对产量及相关性状Table 3 Effect of drought stress and rewatering on the yield and related traits
ROS是叶绿体、线粒体和质膜上电子传递的代谢物质。植物体内ROS的产生和清除存在动态平衡,ROS的浓度和寿命取决于抗氧化系统的组成和有效性。植物体为减轻活性氧伤害,通过抗氧化酶和非酶系统来清除活性氧。抗氧化酶包括SOD、POD和CAT等,非酶清除物质包括抗坏血酸(ASA)、谷胱甘肽(GSH)、APX等。ROS产生量增加是植物逆境伤害的主要原因之一。研究表明,植物在干旱胁迫后可产生大量ROS,从而伤害植物细胞和组织,使植物细胞遭受过氧化伤害[19]。过量积累的ROS会氧化膜脂中的多元不饱和脂肪酸,其产物是MDA,MDA与酶蛋白发生链式聚合反应,破坏膜结构的完整性,并对生物膜上的蛋白酶和离子通道等造成伤害,所以MDA的含量可作为判定胁迫下植物受伤害程度的指标之一[20-22]。高荣嵘等[21]研究发现,干旱胁迫下花生受伤害程度较大,MDA含量较高。姜慧芳等[3]研究发现,干旱胁迫初期,花生叶片SOD活性较低,严重干旱胁迫时,SOD活性增加。马玉玲等[23]研究发现,在干旱胁迫下大豆叶片SOD、POD、CAT、APX活性均呈先升高后降低的趋势,且在中度干旱胁迫时活性最大。本研究结果表明,在干旱胁迫下,HY22和BS1016叶片内的O2-、H2O2、MDA含量均随胁迫程度的加剧而显著增加。而SOD、POD、CAT、APX活性在干旱胁迫下均呈现不同程度的上升,部分指标在长时间的干旱胁迫下升高后又出现一定程度的下降,这与前人的研究结果一致[24-27]。可见,在中度和重度干旱胁迫下,花生叶片抗氧化物质积累,抗氧化保护系统启动,保护酶活性升高。但干旱胁迫历时越长,有害物质积累越多,超过保护系统的清除能力,进而有下降的趋势。与BS1016相比,HY22叶片积累的O2-、H2O2、MDA含量较少,而POD、APX活性显著增加,HY22对干旱胁迫的生理响应表现为较轻伤害。而重度干旱胁迫时,BS1016叶片SOD活性略高于HY22,这可能是由于SOD和CAT酶活性较POD敏感,也可能是由于不同品种对干旱胁迫的反应不同所致。
渗透调节是植物抵御逆境胁迫的一种重要的生理机制[28-30]。渗透调节物质主要是通过生理代谢活动增加细胞溶质,降低细胞渗透势,降低水势,维持细胞膨压,使植物体内与膨压有关的生理活动能够正常进行[30],干旱胁迫能够显著增加花生叶片中的渗透调节物质的含量[31]。研究表明,干旱胁迫下植物通过主动积累,调节物质Pro和SP,有助于清除由干旱胁迫引起的ROS,避免了细胞的膜质过氧化[32]。干旱处理初期,花生叶片Pro、SP含量显著升高,但随着干旱延续,含量降低,在不同抗旱性品种之间存在差异[33]。本研究结果表明,干旱胁迫处理显著增加了HY22叶片中Pro和SP的含量,随着胁迫程度加剧,叶片Pro含量不断上升。但是,BS1016在干旱胁迫下Pro含量显著增加,而SP则呈先上升后下降的趋势。这与储凤丽等[34]在甘薯上的研究基本一致,但与孙建等[35]研究芝麻在干旱胁迫下SP含量随胁迫程度加剧而升高不同,这可能与作物种类、胁迫处理的方法、处理的时期、胁迫的时间长短有关。
干旱胁迫降低花生干物质积累,并最终会影响到产量。有研究学者认为,在干旱胁迫下,单个籽仁重量降低并不是花生减产的主要因素,主要原因是干旱胁迫导致了荚果和籽仁数量的降低,从而造成花生的减产[36]。本研究发现,开花期后干旱胁迫影响花生单株产量的主要因素是饱果数和饱果重,这也与前人的研究结果一致[37-39]。干旱胁迫下,HY22仍然拥有较高的饱果数与饱果重,下降幅度较小,而BS1016产量及相关性状均极显著下降,且前者的抗旱指数也高于后者,可见,HY22的抗旱性较强。
综上,干旱胁迫下,花生叶片的生理生化指标测定值均有不同程度的上升,对干旱的生理响应基本一致,但不同品种之间的变化趋势存在一定的差异。耐旱品种的保护酶类和渗透调节物质升高幅度较大,而活性氧的升高幅度较小,不耐旱品种恰好与之相反。而且,耐旱品种膜脂透性受干旱胁迫影响较小,在中度和重度干旱胁迫下仍然能保持较高的光合速率,维持光合作用正常运转,复水后恢复较快,成熟期具有较高的饱果数、饱果重,因此产量较高,而不耐旱品种则相反,产量较低。
