树莓类拟盘多毛孢叶斑病病原菌的鉴定
2020-04-02孟婷婷齐鹰博刘艳茹代汉萍严雪瑞
孟婷婷 ,齐鹰博 ,刘 闯 ,刘艳茹 ,代汉萍 ,严雪瑞
(沈阳农业大学 a.植物保护学院,b.园艺学院,沈阳 110161)
树莓(Rubus idaeus L.)是蔷薇科(Rosaceae)悬钩子属多年生落叶灌木植物[1],已成为我国一个新兴的果树树种,其果实含有多种糖、氨基酸、果胶质、花青素、黄酮和多种对人体有益的微量元素,具有凝血、降压、镇静、抗氧化、抗癌、抗细胞增殖等多种功能[2]。目前我国树莓病害的研究报道不多。傅俊范教授课题组先后在辽宁产区进行了树莓病虫害调查,2010年出版了《小浆果病虫害防治原色图谱》,涉及了托拉米、美22和费尔多德等品种上常见8种病害。其中树莓灰霉病是对产量影响最大的病害,各基地均有发生,由灰葡萄孢(Botrytis cinerea)危害造成,其发生的严重程度与气候条件关系密切,一般损失10%~20%,严重时可以使树莓绝收。常见的叶斑病主要有树莓灰斑病、炭疽病和斑枯病等。树莓灰斑病主要由蔷薇色尾孢霉(Cercospora rosicola)侵染叶片引起,在叶片上形成深褐色不规则病斑;树莓炭疽病病原为炭疽菌属真菌(Colletotrichum sp.),在叶片上形成中心白色边缘褐色病斑;树莓斑枯病病原为壳针孢属真菌(Septoria sp.),在叶片上形成褐色病斑,常汇聚连片引起叶枯。根癌病是危害树莓根部的一种细菌性病害,病原为根癌土壤杆菌(A-grobacterium tumefaciens),地下部发病对地上部植株生长产生较大影响,该病随栽培年限加长呈现逐年加重趋势。树莓锈病由少隔多胞锈菌(Phragmidium pauciloculare)侵染引起,仅在树莓野生资源上发现,目前尚未侵染栽培品种。树莓黏菌病的病原腐生于树莓茎基部及树莓园地落叶、腐草上,在辽宁树莓生产基地时有发生,由白煤绒菌(Fuligo septica)引起该症状。树莓苗期立枯病主要由茄丝核菌(Rhizoctonia solani)为害,在辽宁树莓育苗基地发现,不同的年份发生严重度差异大,做好土壤消毒是控制该病发生的最有效途径。此外,王娜等报道了由病原菌(Coniothyrium fuckelii)引起的树莓叶枯病。戴启东等报道了辽宁地区树莓炭疽病,其病原菌为(Colletotrichum gloeosporiodis)[3-11]。2017年,在辽宁省沈阳树莓产区发现了拟盘叶斑病,病斑近椭圆形,灰白色,大小约为0.5~0.8 cm。为了明确该病害的致病菌,本研究通过组织分离,单孢纯化,致病性测定,形态学鉴定及分子生物学等一系列相关研究鉴定树莓叶斑病病原并考察其生物学特性,为明确病原菌的分类地位,科学的指导病害防治奠定基础。
1 材料与方法
1.1 材料
供试树莓感病叶片采自1a生树莓植株。2017年8月,分离菌回接试验于沈阳农业大学园艺植物病理学实验室进行。
1.2 方法
1.2.1 病原菌分离及致病性测定 通过组织分离[12]和单孢分离的方法,对病原菌进行分离和纯化。用灭菌后的手术刀于病键交界处切取5 mm×5 mm组织块若干,放入PDA平板上,然后置于25℃温箱中培养。待其长出菌落后,挑取菌落边缘的菌丝置PDA上培养,待其产孢后,经单胞分离后获得纯培养菌落。将其接种到PDA斜面上,置于4℃温箱中保存,备用。
选取1a生树莓植株进行致病性测定试验。病原菌在PDA培养生长5 d后打取直径为 5mm的菌饼作为接种体,采用针刺法进行叶片创伤,将菌饼带菌面贴于伤口处作为接种组,以无菌PDA圆饼贴于伤口处作为对照组,设3次重复。处理组和对照组均置于28℃环境下观察,保湿48h后分别撤掉菌饼和PDA圆饼,分别于处理第3天、第5天和第7天记录发病情况。
1.2.2 病原菌形态学鉴定 将病原菌放置在PDA培养基上,25℃下培养,观察其病原菌的菌落颜色,生长速度和产孢情况等。用Olympus BX43显微镜观察其分生孢子的形态,测量孢子大小及顶端附属丝的长度。
1.2.3 病原菌分子系统发育分析鉴定 目前拟盘多毛孢属真菌的分子系统发育研究方法比较完善,骨架树分析已经完成。对该属未知菌的种群分析主要采用ITS、β-tubulin和tef1基因联合建树即可[9]。本研究中系统发育分析首先采用了骨架树比对进行初鉴定,随后扩充近缘种建树,进行种群鉴定的思路。所用模式菌株来源于已发表的相关文献[13-18],所属的ITS、TUB和EF1基因均在Genbank中下载。
采用改良的CTAB法提取致病菌的DNA,分别采用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增 ITS 基因;引物 BT2A(5’-GGTAACCAAATCGGTGCTGCTTTC-3’)和 BT2B(5’-ACCCTCAGTGTAGTGACCCTTGGC-3’)扩增 β-tubulin 基因,EF1-526F(5’-GTCGTYGTY-ATYGGHCAYGT-3’)和 EF1-1567R(5’-ACHGTRCCRATACCACCRATCTT-3’)扩增 tef1 基因。 PCR 反应体系为 25μL,包括 10×PCR buffer 2.5μL,MgCl2(25mmol·L-1)2.5μL,模板 DNA 1μL,dNTP(10mmol·L-1)0.5μL,TaqDNA 聚合酶(5U·μL-1)0.2 μL,引物(20mmol·L-1)各 0.5μL,ddH2O 17.3μL。 扩增产物结果通过 1%琼脂糖凝胶电泳检测后,送至生工生物工程(上海)有限公司进行测序。序列比对采用CLUSTAL X 2.1软件进行分析。系统发育建树采用MEGA 7.0最大似然法(ML)进行分析,Bootstrap检验的重复次数为1000次。
1.2.4 病原菌生物学特性研究 病原菌在PDA培养基培养3d后,用5mm的打孔器在菌落边缘打取菌饼,将5 mm菌饼分别置于不同碳源(葡萄糖,蔗糖,乳糖,麦芽糖,可溶性淀粉)培养基,不同的氮源[NaNO3,(NH4)2SO4,NH4H2PO4,半胱氨酸,甘氨酸]培养基,不同基质(PDA,OA,树莓煎汁,松针,查彼)培养基下培养,每个处理组重复 3次,25℃下恒温培养。置于 6个不同温度(10,15,20,25,28,30℃)下黑暗培养,每个处理重复3次。置于不同光照(完全黑暗,完全光照,12h黑暗12h光照交替)下培养,每个处理重复3次。分别于处理3,5,7d使用十字交叉法对菌落直径进行测量,并使用软件Excel和SPSS17.0对数据进行分析和整理。
2 结果与分析
2.1 病原菌分离与致病性的测定
树莓拟盘叶斑病,病斑灰白色,近椭圆形(图1A)。对树莓叶斑病病样进行分离,对分离菌进行单胞纯化,最终获得了15株菌落表现一致的菌株,选取1株代表菌株,其编号为SNHS12B,它引起的病害症状表现为叶部病斑近椭圆形,灰白色,大小约为0.5~0.8cm代表菌株在接种树莓后置于28℃条件中培养,3d后出现棕色病斑,7d后接种部位出现深棕色病斑,病斑大小发展为1.8 cm,对照组均不发病(图1B和C)。对接种后的发病部位进行病原菌再次分离,均获得与原始菌株一样的病原菌。
2.2 病原菌的形态学鉴定
该菌在PDA培养基置于25℃温箱中培养15 d后,菌落白色,轮纹明显,菌落背面淡黄色(图1D)。子实体为黑色墨汁状,分布密集。分生孢子(图1E和F)为纺锤形,具有5个细胞,4个隔膜,顶端具3~4根附属丝,形态学特征与拟盘多毛孢属真菌吻合。 该菌分生孢子大小为 (39.7~44.9)×(9.1~11.6)μm,平均(40.1×10.5)μm;分生孢子顶端附属丝 2~4 根,长度为(19.3~36.2)μm,平均 32.6μm。 分生孢子特征与 Neopestalotiopsis megna描述相近[11]。
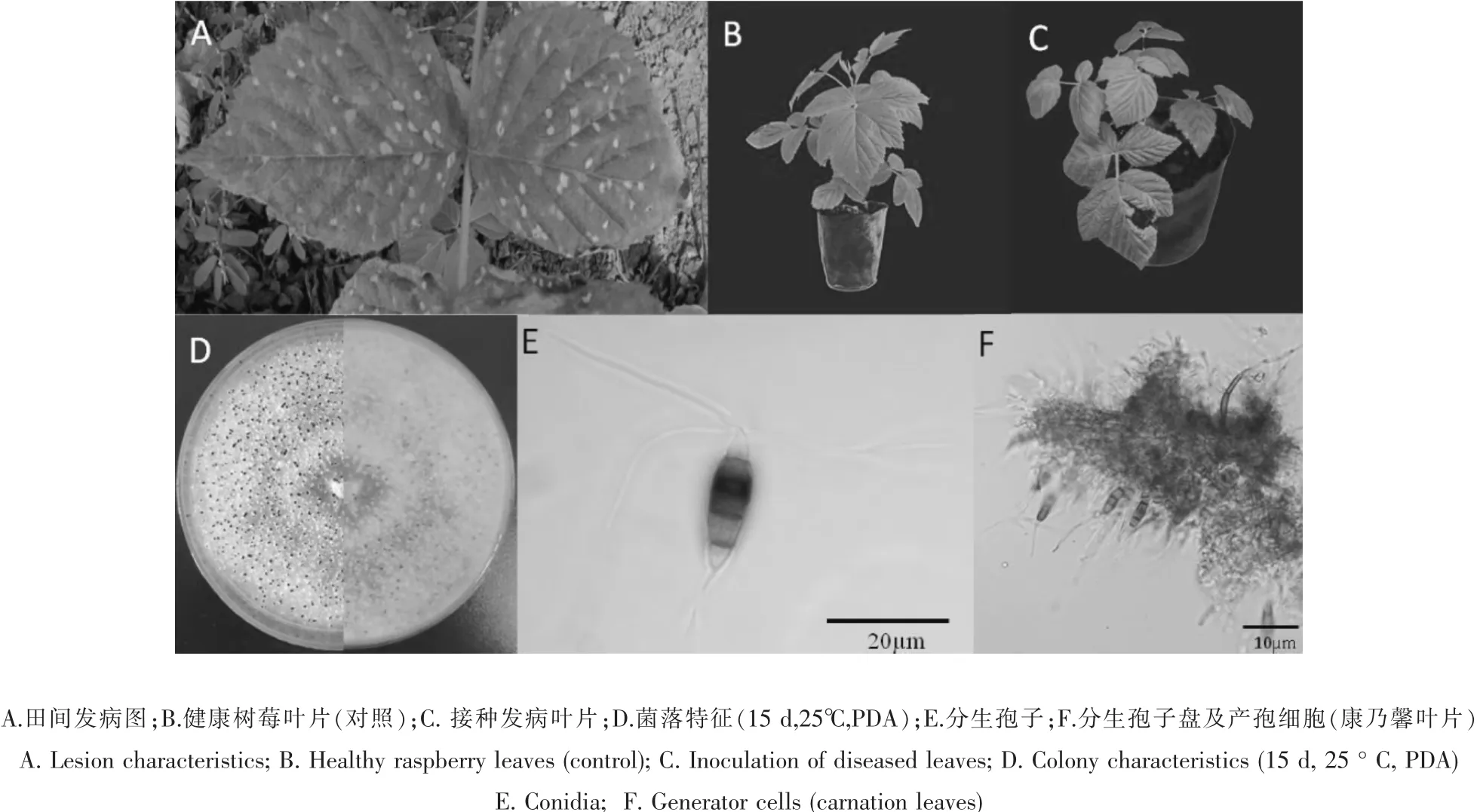
图1 树莓拟盘叶斑病病斑及病菌特征Figure 1 Raspberry leaf spot symptom and its pathogen phenotype
2.3 病原菌分子系统发育分析鉴定
对代表菌株的ITS、β-tublin和tef1进行了PCR扩增,分别得到了521 mbp、446 mbp和1046 mbp片段。将代表菌的ITS序列放入NCBI中比对,结果表明共与N.megna的 ITS序列相似度达100%,再次从属水平上证明该菌属于新拟盘多毛孢属。进一步采用三基因联合建树方法将代表菌与拟盘骨架树上各分支部分代表模式菌株进行比对分析,结果表明该菌与N.aotearoa和N.piceana位于同一分支(结果未在此文提供),该步骤找到了该菌在系统骨架树上所处的具体分支位置,为后续与近缘模式种的收集与比对提供了具体方向,通过文献查阅最终获得 7 个种[N.aotearoa,棒状拟盘多毛孢(N.clavispora),N.magna,N.australis,N.formicarum,N.honoluluana和N.piceana]作为二次建树的模式种 (表1)。近缘种分子系统发育分析结果表明,供试菌株SNHS12B与N.megna代表菌株处于同一分支,并与其他近缘种区分,且自展值支持率达到99%(图2)。根据分子系统发育分析结果表明该病原菌为N.megna。
2.4 病原菌的生物学特性
比较不同碳源(葡萄糖,蔗糖,乳糖,麦芽糖,可溶性淀粉)可知,葡萄糖、麦芽糖为最适碳源,培养7d后菌落直径可达6.37cm。比较不同氮源[NaNO3,(NH4)2SO4,NH4H2PO4,半胱氨酸,甘氨酸]可知,最适氮源为甘氨酸,培养7d后菌落直径可达5.07cm,与其他条件下差异明显。

表1 用于ML系统发育树的相关菌株信息及其基因登录号Table 1 Related strain information and its genetic accession number for ML phylogenetic tree

图2 联合ITS、β-tubulin和tef1基因序列构建的树莓叶斑病菌的ML系统发育树Figure 2 ML phylogenetic tree of raspberry leaf spot disease constructed with ITS,β-tubulin and tef1 gene sequences
比较不同温度(10,15,20,25,28,30℃)下菌落生长情况可知,最适温度为 28℃,培养 7d 后菌落直径可达7.89cm,与其他条件下差异明显。比较不同光照(完全黑暗,完全光照,12h黑暗12h光照交替)下菌落生长情况可知,不同光照条件下菌落生长无明显差异。比较不同培养基(PDA,OA,树莓煎汁,松针培养基,查彼)中菌落的生长情况可知,PDA为该菌落生长的最适培养基,培养7d后菌落直径可达8.09cm,与其他条件下差异明显。
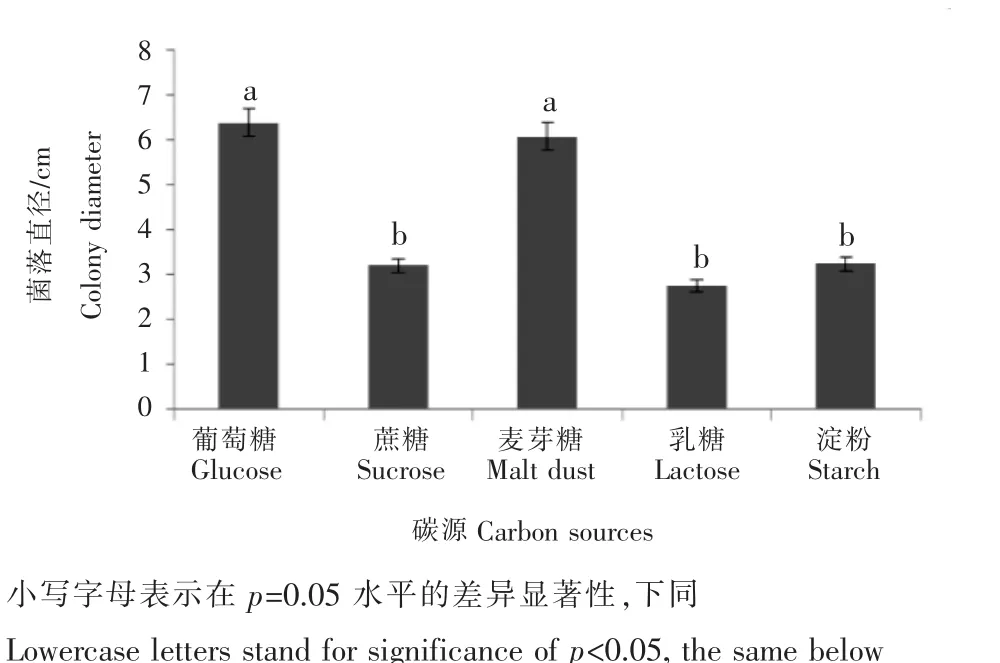
图3 不同碳源对树莓拟盘叶斑病菌的菌落生长影响Figure 3 The effect of carbon source on colony growth of the pathogen caused raspberry leaf spot

图4 不同氮源对树莓拟盘叶斑病病菌的菌落生长影响Figure 4 The effect of nitrogen sourceon on colony growth of the pathogen caused raspberry leaf spot
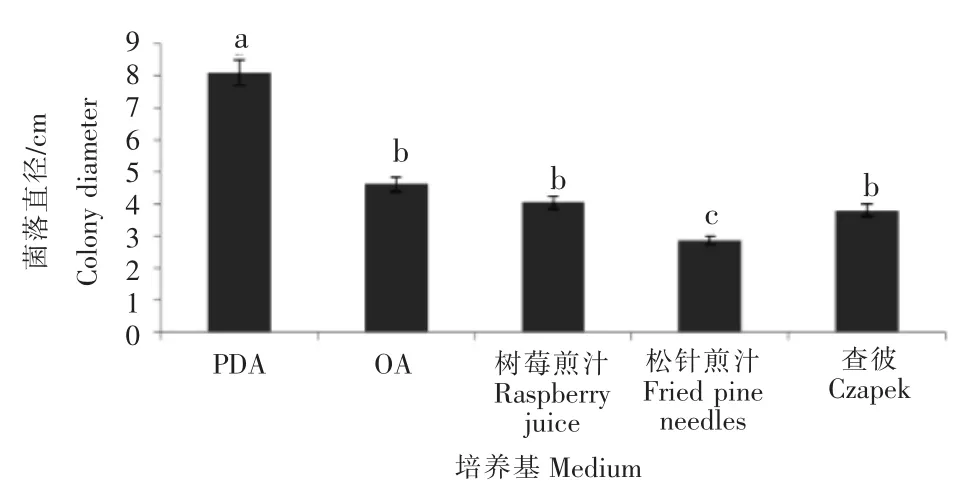
图5 不同培养基对树莓拟盘叶斑病病菌的菌落生长影响Figure 5 The effect of different medium on colony growth of the pathogen caused raspberry leaf spot
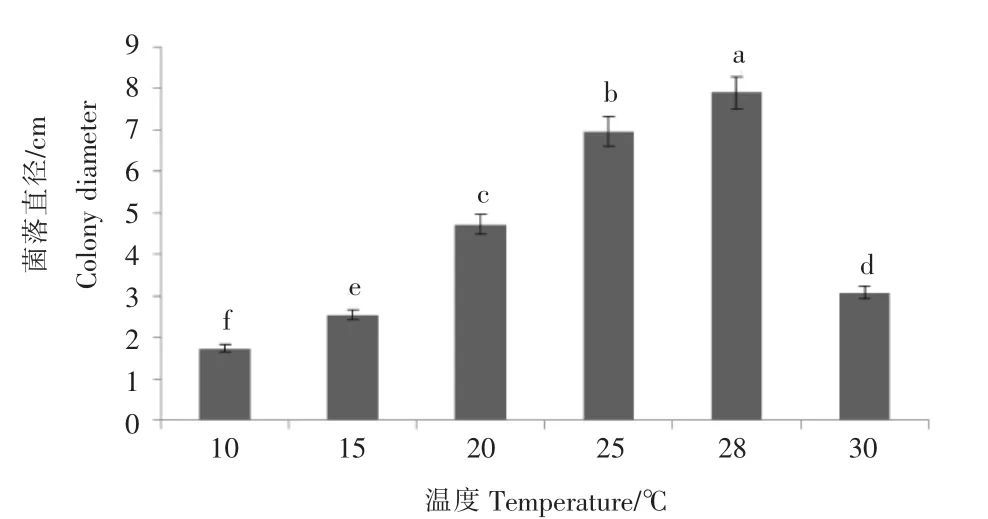
图6 不同温度对树莓拟盘叶斑病病菌的菌落生长影响Figure 6 The effect of different temperature on colony growth of the pathogen caused raspberry leaf spot
3 讨论与结论
本研究发现的拟盘菌叶斑病为树莓种植中新发现的一种病害,田间危害较重。本研究通过组织分离,单孢纯化,致病性测定,形态学和分子系统发育鉴定等一系列研究,发现该病由N.megna危害造成。该菌在PDA培养基上菌落为白色,其上密布许多针状分生孢子器,菌落背面呈淡黄色。分生孢子,具4个隔膜,中间3个细胞深色,顶孢和尾孢无色,顶端附属丝3~4根,尾孢中生柄明显。分生孢子大小平均为40.1×10.5μm; 顶端附属丝长度平均为 32.6μm。 此前 N.megna曾报道在厥类植物上引起危害[15],本研究是N.megna危害树莓的首次报道。

图7 不同光照对树莓拟盘叶斑病病菌的菌落生长的影响Figure 7 The effect of light on colony growth of the pathogen caused raspberry leaf spot
拟盘多毛孢属真菌是一类重要的植物病原菌,可为害多种植物,特别是果树与经济林,造成减产和严重经济损失[16]。该属真菌分布较广,可出现同种作物在不同地区由不同拟盘菌种群危害的现象。如蓝莓上报道的拟盘多毛孢真菌危害就出现上述情况。广西地区报道的蓝莓叶斑病由棕榈拟盘多毛孢(P.trachicarpicola)引起[19];福建长汀蓝莓枝枯病由N.chrysea引起[20];吉林省长春发生的蓝莓叶斑病由石楠拟盘多毛孢(P.photiniae)引起[21];山东蓝莓叶斑病由棒状拟盘多毛孢(N.clavispora)引起[22]。同样的情况也出现在镰孢菌上,在江西产区引起蓝莓叶枯病的病原菌为亚细亚镰孢菌(Fusarium asiaticum)[23],而在浙江地区引起蓝莓根腐病的病原菌为尖孢镰孢菌(Fusarium oxysporum)[24]。由此可见,由于生境的不同,亦存在同一属不同种群危害寄主的情况。此外,本课题组还报道了由P.adusta引起的树莓叶斑病[25],与本文报道的N.megna引起的树莓叶斑病在症状、病菌形态上可明显区分。
目前,拟盘多毛孢属(Pestalotiopsis)真菌鉴定主要采用形态学特征与分子生物学特性相结合的方法[13,18]。2012年,MAHARACHCHIKUMBURA提出了该属分子鉴定标准,即使用ITS、β-tubulin和tef1三段基因进行联合系统发育分析可将现有绝大多数的模式种很好地区分,该方法的出现被视为拟盘菌鉴定的里程碑。2014年,MAHARACHCHIKUMBURA[16]对Pestalotiopsis属进行修订。将该属分为3个属,除Pestalotiopsis之外,还新成立了Neopestalotiopsis和Pseudopestalotiopsis 2个属。本研究使用了国际统一鉴定分类标准对病原菌进行鉴定。
对病原菌生物学特性的研究,可以为该病害的后续防控、科学研究提供病原菌背景信息。该菌的生物学特性结果表明:PDA为该菌落生长的最适培养基,葡萄糖、麦芽糖为最适碳源,半胱氨酸为最适氮源。该菌生长的最适温度为28℃,光照对其菌落生长影响不显著。从这些数据可以推断该菌有可能更适应高温高湿气候,且不需特殊生长因子。
