Fe3O4磁性纳米粒子固定化微泡菌褐藻胶裂解酶AlgL17的研究
2020-04-02,3,4,5,3,4,5,3,4,5,*
,3,4,5,3,4,5,3,4,5,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.厦门医学院药学系,福建厦门 361023;3.福建省食品微生物与酶工程重点实验室,福建厦门 361021;4.厦门市食品生物工程技术研究中心,福建厦门 361021;5.厦门南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建厦门 361021;)
褐藻胶是由α-L-古罗糖醛酸及β-D-甘露糖醛酸聚合而成的线状聚合物多糖,它是褐藻酸亲水衍生物的统称,从巨藻、海带和马尾藻等褐藻中提取而来,是细胞壁主要组成物质[1]。褐藻胶寡糖是经褐藻胶降解的一种低分子聚合物,与多糖相比,生物特性更为突出[2-3]。褐藻胶的降解方法主要有化学法和酶法[4-5]。酶法生产褐藻胶寡糖条件温和、得率高、不污染环境、水解产物生物活性不易被破坏,已经逐渐取代化学法降解。
褐藻胶裂解酶能通过β-1,4糖苷键的方式进行消除反应,催化褐藻胶的非还原末端C4,5间不饱和双键,降解褐藻胶[6]。游离酶在使用过程中存在许多问题,例如热稳定性差、酶无法回收、易失活、生产成本较高等[7-8],这严重阻碍了酶的广泛应用。固定化酶是将酶利用物理或者化学手段定位在限定的空间区域,其保持催化活性,可重复使用,能较好地解决上述问题[9-11]。酶的固定化方法多种多样,主要分为非共价结合法、化学结合法和包埋法。磁性纳米粒子可以通过外界磁场的作用,快速分离产物和底物,提升酶的使用效率,因此磁性纳米粒子广泛应用于固定化酶领域[12-14]。作为酶固定化的载体,磁性纳米粒子具有许多优点,例如生物相容性良好、比表面积大、颗粒直径小、扩散限制较小、载酶量较高并可在溶液中稳定存在。
目前对于褐藻胶裂解酶的研究多数集中在制备、表征和发酵工艺优化[15-17],对其固定化酶活力的研究较少。本文以磁性高分子纳米粒子作为载体对微泡菌褐藻胶裂解酶AlgL17[18]进行固定化研究,并对固定化酶进行鉴定及部分酶学性质表征。
1 材料与方法
1.1 材料与仪器
含微泡菌AlgL17基因的E.coliBL21工程菌株[18]由集美大学食品与生物工程学院实验室保藏;Fe3O4上海阿拉丁;细菌学蛋白胨、技术琼脂粉 广东环凯;四水合酒石酸钾钠、单宁酸 西陇科学;3,5-二硝基水杨酸、海藻酸钠 国药集团;其他试剂均为分析纯产品。
Avanti J-263xp立式高速冷冻离心机 贝克曼库尔特;ZHWY-2102/ZWY-200D双层全温度培养摇床 美国Crystal;HH-4/HH-8数显恒温水浴锅 国华电器;FE20 pH计 梅特勒-托利多;Centrifuge 5810 R冷冻离心机 德国Eppendorf;JY92-ⅡN超声波细胞粉碎机 宁波信仪;Epoch2T微量酶标仪 美国伯腾;BioPhotometer 德国Eppendorf;FreeZone 6Plus 真空冷冻干燥机 Labconco;Nicolet iS10傅立叶红外光谱分析仪 Thermo;KQ-800KDE超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 Fe3O4磁性纳米粒子固定化载体的制备 参照文献[19]的方法,称取1.0551 g Fe3O4加入40 mL蒸馏水,超声(功率400 W,频率40 KHz)15 min后得到均匀分散的纳米粒子,通入氮气,200 r/min、80 ℃搅拌1 h。接着加入2.5%(w/v)单宁酸溶液,混匀,通入氮气、200 r/min、40 ℃反应2 h,将混合物冷却至室温。将制备的单宁酸修饰的Fe3O4纳米粒子(tannic acid-functioned magnetic nanoparticles,TA-MNPs)用磁铁收集,乙醇洗涤,再用去离子水清洗三次,最后将Fe3O4磁性纳米粒子放在干燥烘箱中,70 ℃干燥过夜。
1.2.2 重组褐藻胶裂解酶AlgL17在大肠杆菌中的诱导表达 从LB平板上(含卡那霉素50 μg/mL)挑取含有AlgL17基因的工程菌单菌落,移至5 mL LB液体培养基(含卡那霉素50 μg/mL),37 ℃摇动(180 r/min)培养过夜。将菌液按1%接种量转接到200 mL LB培养基中(含卡那霉素50 μg/mL),在37 ℃、180 r/min条件下培养至OD600达到0.6,然后加入25 μL 0.5 mol/L异丙基-β-D-硫代半乳糖苷(IPTG),在17 ℃、180 r/min的条件下培养20 h。
1.2.3 褐藻胶裂解酶粗酶液的制备 将诱导后的菌液在4 ℃、8000 r/min条件下离心10 min,弃上清;菌体沉淀重悬于20 mL预冷的缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,15 mmol/L咪唑)。在冰浴条件下,细胞利用超声破碎仪破碎,超声功率300 W,时间10 min,4 ℃、6000 r/min离心10 min,取上清,获得粗酶液,取适量样品进行SDS-PAGE分析。
1.2.4 固定化褐藻胶裂解酶AlgL17的制备
1.2.4.1 制备流程 取25 mg Fe3O4磁性纳米粒子置于50 mL磨口具塞锥形瓶中,加入2.7 U褐藻胶裂解酶AlgL17,5 ℃下反应5 h。反应结束后进行磁分离,再将固定化褐藻胶裂解酶AlgL17用去离子水进行清洗,最后进行冷冻干燥,4 ℃贮藏备用。
1.2.4.2 固定化褐藻胶裂解酶AlgL17的条件优化 以固定化酶的活力为指标,研究不同固定时间(3、4、5、6、7 h)、不同含量磁性载体(10、15、20、25、30 mg)、不同活力单位的褐藻胶裂解酶(1.8、2.7、3.6、4.5、5.4 U)对酶固定化的影响。
1.2.4.3 游离酶和固定化褐藻胶裂解酶的活力测定(DNS法) 利用DNS法[20]测定褐藻胶裂解酶的活力。其中,游离酶活力测定具体方法:20 μL褐藻胶裂解酶AlgL17粗酶液加入380 μL 5 mg/mL海藻酸钠底物溶液(底物溶于50 mmol/L Na2HPO4-NaH2PO4缓冲液,pH8.0),混匀,35 ℃反应10 min,加入400 μL DNS,沸水浴10 min,冷却至室温后,在540 nm波长测定OD值。固定化酶活力测定具体方法:用20 mg固定化褐藻胶裂解酶替代20 μL褐藻胶裂解酶粗酶液,其余操作同游离酶。褐藻胶裂解酶的活力定义:在上述条件下,每分钟生成1 μmoL还原糖所需的酶量为一个酶活力单位(U)。
1.2.5 固定化酶的最适反应温度和最适反应pH测定 以5 mg/mL海藻酸钠为底物(底物溶于50 mmol/L Na2HPO4-NaH2PO4缓冲液,pH7.0)在不同温度下(20、25、30、35、40 ℃)测定固定化酶的活力,研究固定化酶的最适反应温度。固定化酶的最适反应pH的测定在35 ℃下进行,在不同pH的缓冲液:50 mmol/L C6H8O7-Na2HPO4缓冲液(pH6.0)、50 mmol/L Na2HPO4-NaH2PO4缓冲液(pH7.0~8.0)、50 mmol/L C2H5NO2-NaOH缓冲液(pH8.5~9.0),研究固定化酶的最适反应pH。以酶活力最高的固定化酶的活力为100%。
1.2.6 固定化褐藻胶裂解酶的傅里叶红外光谱检测 取冻干的固定化褐藻胶裂解酶、载体和游离褐藻胶裂解酶分别与KBr混合,置于研钵中研匀,加入压片模具内,进行压片,取出,然后在4000~500 cm-1的测试范围内进行傅里叶红外光谱检测。每个样品取样5次进行测定,求其平均光谱,再以9点平滑并通过纵坐标归一化处理,获得一维红外光谱图。
1.2.7 固定化褐藻胶裂解酶的扫描电镜检测 将冻干的固定化酶和空载体送往凯美克化工技术股份有限公司进行扫描电镜检测。室温下,将固定化酶与载体分别加入去离子水,利用超声进行分散处理,然后滴到铜网上,室温真空干燥12 h,保存备用,观察形貌,电压200 kV,在不同的放大倍数下进行观察,保存照片。
1.3 数据处理
试验数据采用origin 8.5数据处理系统和Microsoft Excel软件进行处理。
2 结果与分析
2.1 褐藻胶裂解酶AlgL17基因在E. coli中的表达和纯化
pET-28α(+)表达质粒插入目的基因,转入大肠杆菌BL21培养,经IPTG诱导后,与pET-28α(+)的空载和未诱导的含重组质粒的阳性菌相比较,被诱导表达的含有pET-28α-algl17的阳性菌有明显的融合蛋白表达条带(图1,道3),重组褐藻胶裂解酶AlgL17的分子量大小在80 kDa左右。
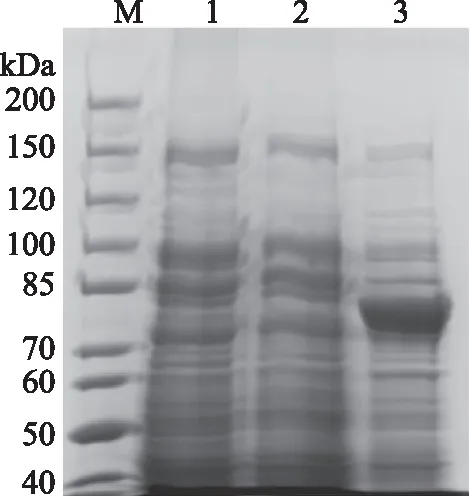
图1 褐藻胶裂解酶AlgL17基因表达产物的SDS-PAGE分析Fig.1 SDS-PAGE of the expressedprotein encoded by the alginate lyase AlgL17 gene 注:M:分子量标准蛋白,1:IPTG诱导的pET-28α(+)空载,2:未诱导的含pET-28α-algl17阳性菌,3:IPTG诱导的含pET-28α-algl17阳性菌。
2.2 固定化褐藻胶裂解酶的活力
以海藻酸钠为底物,利用DNS法测定得到固定化褐藻胶裂解酶的活力为1.8 U/mg。
2.3 单因素对褐藻胶裂解酶固定化的影响
2.3.1 固定时间对固定化褐藻胶裂解酶的影响 考查不同固定时间对褐藻胶裂解酶固定化的影响,结果如图2所示。由图2可见,在3~5 h之间,酶活力呈上升趋势;在5 h达到最高峰;5 h之后酶活力呈下降趋势,可能是因为固定上去的酶较多时产生位阻效应,从而导致固定化酶活力下降,这种现象在其他一些固定化酶研究中也观察到[21-22]。因此,研究褐藻胶裂解酶在Fe3O4磁性载体上最适的固定时间为5 h。
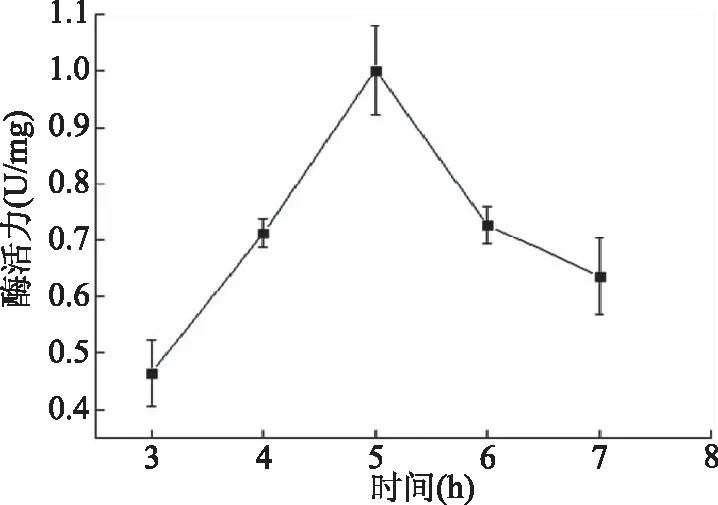
图2 固定化时间对固定化酶活力的影响Fig.2 Effect of immobilization timeon activity of immobilized enzyme
2.3.2 载体量对固定化褐藻胶裂解酶的影响 考查不同载体量对褐藻胶裂解酶固定化的影响,结果如图3所示。由图3可见,载体量在10~25 mg时,酶活力呈上升趋势;25 mg时,酶活力最高;25 mg之后呈下降趋势,可能是载体量过多,减少了酶在载体上的吸附固定,导致酶活力降低。因此,褐藻胶裂解酶在Fe3O4磁性载体上固定的最适载体量为25 mg。
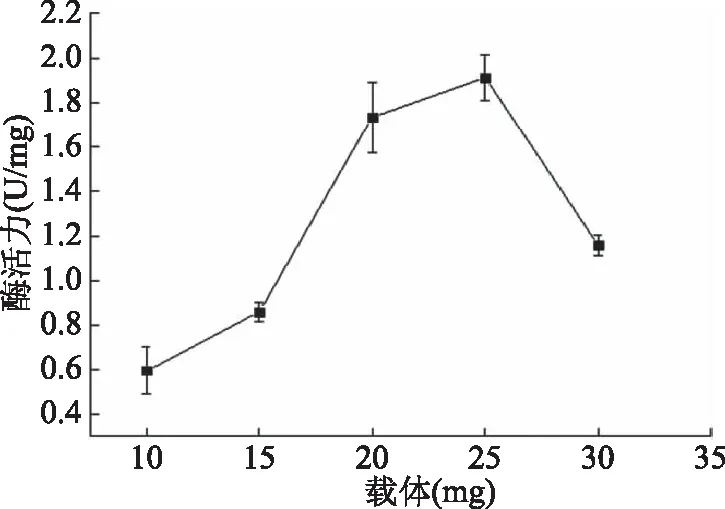
图3 载体量对固定化酶活力的影响Fig.3 Effect of carrier amounton activity of immobilized enzyme
2.3.3 加酶量对固定化褐藻胶裂解酶的影响 考查不同加酶量对褐藻胶裂解酶固定化的影响,结果如图4所示。由图4中可以看出,加酶量为2.7 U时,酶活力最高;2.7 U之后呈现缓慢下降的趋势,可能是因为载体固定的酶量有限,当加酶量浓度较低时,随着酶液浓度的增加,固定到载体上的酶量增加,酶活力也随之提高;但加酶量过高会造成部分酶分子相互聚集使其活性中心互相掩埋,影响酶与底物结合,酶活力反而下降[23]。因此,本研究中褐藻胶裂解酶固定在25 mg Fe3O4磁性载体上最适加酶量为2.7 U。
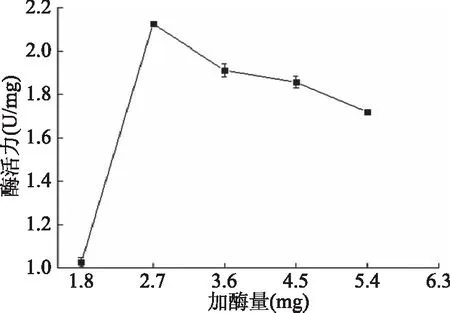
图4 加酶量对固定化酶活力的影响Fig.4 Effect of enzyme additionon activity of immobilized enzyme
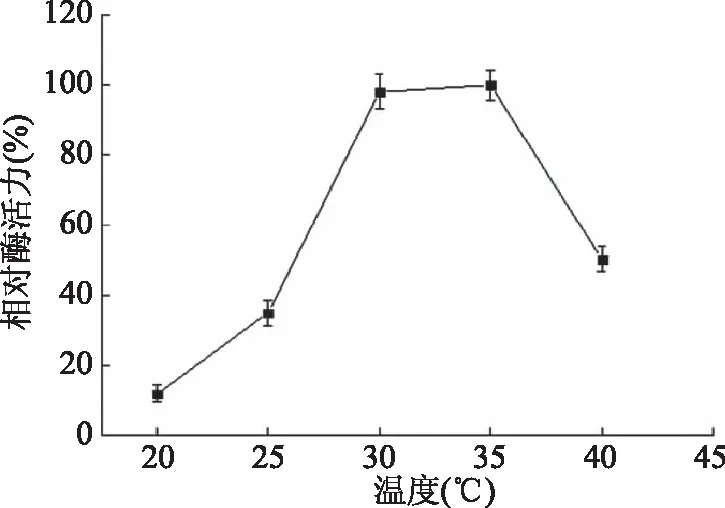
图5 固定化酶的最适反应温度Fig.5 Optimal reaction temperature of immobilized enzyme
2.4 固定化褐藻胶裂解酶的最适反应温度
考查温度对固定化酶活力的影响,结果如图5所示。由图5可以得出,固定化褐藻胶裂解酶AlgL17的最适反应温度为35 ℃,与游离褐藻胶裂解酶AlgL17的最适温度[18]相同,说明固定化不改变其最适温度。
2.5 固定化褐藻胶裂解酶的最适反应pH
从图6中可以看出,随着pH增加,酶活力呈上升趋势;pH为8.5时,酶活力达到最高;pH超过8.5后,酶活力迅速下降。说明固定化酶在微碱的环境下酶活力较高,过酸或过碱都会使酶的活力下降。文献[18]报道游离褐藻胶裂解酶AlgL17的最适反应pH为8.0,本研究中固定化褐藻胶裂解酶最适反应pH为8.5,此时酶解反应最充分,说明固定化改变其最适pH。
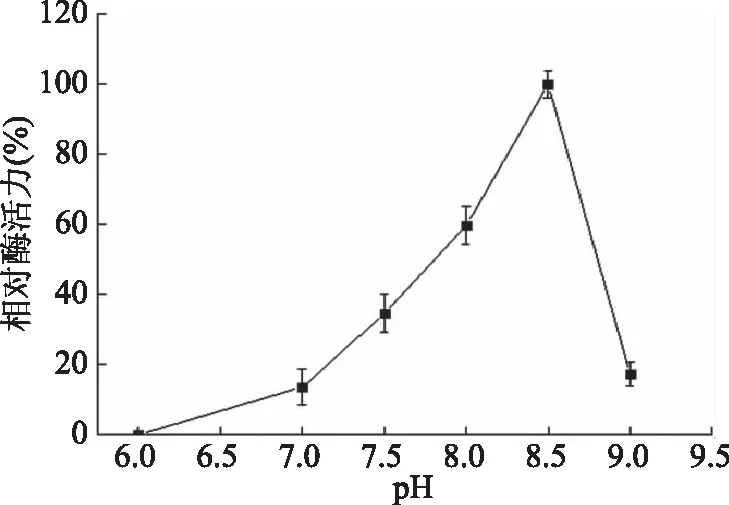
图6 固定化酶的最适反应pHFig.6 Optimal pH of immobilized enzyme
2.6 固定化褐藻胶裂解酶的鉴定
2.6.1 傅里叶红外光谱检测 利用傅立叶红外光谱分析仪对固定化酶和载体进行红外检测,结果如图7所示。579 cm-1处的红外吸收峰与Fe3O4的特征峰相符合,在3320 cm-1有O-H的特征吸收峰,在1740 cm-1处有C=O的特征吸收峰,这证实了锚定单宁酸基团的存在,这说明加入单宁酸成功地对Fe3O4进行了功能化修饰。另外,载体固定上褐藻胶裂解酶之后,除了具有Fe3O4的特征峰外,还出现新的吸收峰,1325 cm-1处为-CH3S伸缩振动吸收峰,1450 cm-1处为-NH2伸缩振动吸收峰,这些结果显示了褐藻胶裂解酶成功地固定在磁性载体上。
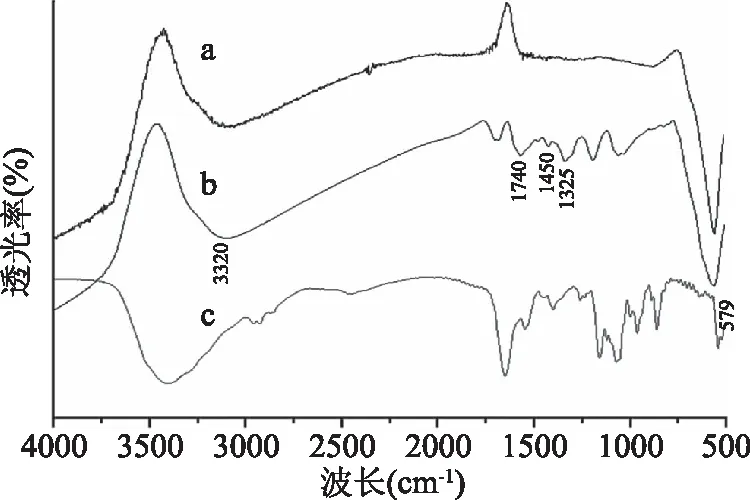
图7 载体(a)、固定化褐藻胶裂解酶(b)和游离褐藻胶裂解酶(c)的傅里叶红外光谱检测Fig.7 Fourier transform infrared spectroscopydetection of carrier(a),immobilized alginatelyase(b)and free alginate lyase(c)
2.6.2 扫描电镜检测 扫描电镜分析显示,单宁酸修饰的载体颗粒分散均匀,粒径在20 nm左右(图8a),固定褐藻胶裂解酶后,颗粒的大小未发生很大改变,但载体表面变得比未固定前更粗糙(图8b),这些结果显示,酶成功固定在载体表面,对颗粒结构没有影响。

图8 载体(a)与固定化酶(b)的扫描电镜检测(5000×)Fig.8 Transmission electron microscope analysis ofcarrier(a)and immobilized enzyme(b)(5000×)
3 结论
目前关于固定化褐藻胶裂解酶的研究报道非常少,本文研究了基于单宁酸修饰的四氧化三铁磁性纳米粒子固定化微泡菌褐藻胶裂解酶AlgL17,对AlgL17进行固定化条件优化,得到最适固定条件为:固定时间5 h,加载体量25 mg,加酶量2.7 U。固定化酶在最适温度35 ℃,最适pH8.5的条件下,显示出最高酶活力。扫描电镜(SEM)结果显示Fe3O4磁性纳米粒子分散性良好,形状呈规则球状。傅里叶变换红外光谱(FTIR)结果显示,褐藻胶裂解酶成功地固定在磁性载体上,且对磁性载体的结构不会产生影响。本固定化方案具有工业应用的潜力。
