枯草芽孢杆菌β甘露聚糖酶的克隆表达及重组酶性质研究
2020-04-02,*
,*
(1.湖北省生物酵素工程技术研究中心(三峡大学),湖北宜昌 443002;2.生物催化宜昌市重点实验室(三峡大学),湖北宜昌 443002;3.三峡大学生物与制药学院,湖北宜昌 443002)
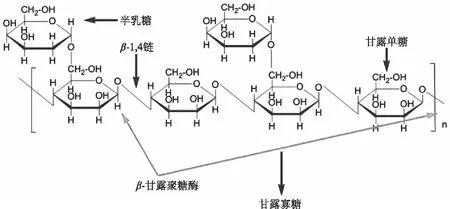
图1 β-甘露聚糖酶作用位点Fig.1 Conceptual diagram of action from β-mannanase
β-甘露聚糖酶(β-mannanase)属于半纤维素酶类,是一类能够切断甘露聚糖(包括线性甘露聚糖、半乳甘露聚糖和葡甘露聚糖等)主链中β-1,4-D-甘露糖苷键(图1)的内切水解酶[1-3],水解产生的甘露低聚糖具有优异的生理活性,能够有效改善肠道环境和功能,增强人体机能,是一种优良的保健品。甘露聚糖酶在食品、饲料、医药、生物能源等的开发领域具有较大的应用价值,同时也是降解植物生物量的重要自然资源[4-5]。
甘露聚糖酶在自然界中普遍存在[6-7],微生物是其最主要的生产来源[8],而细菌产的β-甘露聚糖酶比真菌来源的温度稳定性更好,尤其是以芽孢杆菌来源的甘露聚糖酶[9]。虽然目前有大量不同种类不同来源的β-甘露聚糖酶被发现,但野生型β-甘露聚糖酶[10]尚不能完全满足工业化生产的需求,酶学性质上都存在一定的缺陷[11],如野生型甘露聚糖酶活性较低,部分野生型甘露聚糖酶对于魔芋粉的降解能力较差,无法充分利用我国丰富的魔芋资源。通过异源表达提高β-甘露聚糖酶的酶活和适用范围,获取活性较高的、生产成本较低的甘露聚糖酶,进一步拓宽魔芋的应用范围,开发高附加值的魔芋产品,无疑是甘露聚糖酶进一步扩大应用市场的重要方式。目前已经实现了甘露聚糖酶基因在大肠杆菌、枯草芽孢杆菌、毕赤酵母、黑曲霉和里氏木霉中的成功表达[12-18],马威等[19]将枯草芽孢杆菌MA139中的β-甘露聚糖酶基因进行优化设计并在毕赤酵母X-33中进行表达,10 L发酵罐培养诱导72 h时,可达到最大酶活2100 U/mL,异源表达后甘露聚糖酶酶学性质更优良。但目前对魔芋葡甘聚糖具有高度专一性的β-甘露聚糖酶的克隆表达及性质解析仍有待进一步深入。
本实验室前期以魔芋粉为唯一碳源,从土壤中定向筛选出可高效降解魔芋葡甘聚糖为魔芋低聚糖的细菌BacillussubtilisG1[20]。本文拟将B.subtilisG1中的β-甘露聚糖酶基因BsmanA转入大肠杆菌BL21(DE3)中进行高效表达,利用表达载体中的His-Tag编码序列对重组酶进行分离纯化,并研究重组蛋白的酶学性质,为深入了解其在分子水平上的结构与功能关系及其进一步应用提供支持。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌G1(BacillussubtilisG1)、EscherichiacoilDH5α、E.coilBL21(DE3) 本实验室保存菌株;质粒pACYCDuet-1、Taq DNA polymerase、DL 5000 bp Marker、蛋白质电泳Marker、6×loading Buffer、5×蛋白上样缓冲液 TAKARA有限公司;BamH I和HindIII限制性内切酶 上海生工生物工程有限公司;细菌基因组DNA提取试剂盒、DNA纯化试剂盒、DNA凝胶回收试剂盒 Vazyme生物技术有限公司;魔芋粉 宜昌一致魔芋公司 葡甘聚糖纯度>95%;瓜尔胶 源叶生物 分析纯;刺槐豆胶 SIGMA公司 分析纯;异丙基-β-D-硫代半乳糖苷(IPTG,纯度>99.9%) Calbiochem公司;其它试剂国产或进口分析纯;PCR引物合成及测序 上海生工生物技术有限公司。
C1000 Touch PCR仪、Gel Doc XR+凝胶成像仪 Bio-Rad公司;UV1800紫外可见分光光度计 岛津企业管理有限公司;SX-700蒸汽灭菌器、MX-307落地高速冷冻离心机 日本Tomy公司;NanoDrop One超微量紫外可见分光光度计 Thermo公司;SW-CJ-2FD超净工作台 苏州净化设备有限公司;ZQLY-180S恒温培养摇床 上海知楚仪器有限公司;LRH-250A生化培养箱 泰宏医疗器械有限公司。
1.2 实验方法
1.2.1 表达载体的构建 依据TIANamp Soil DNA Kit试剂盒的方法从B.subtilisG1提取基因组DNA,根据文献报道的β-甘露聚糖酶基因序列及表达载体pACYCDuet-1的多克隆位点设计引物。引物设计如下:上游引物Man-F:5′-CAGCCAGGATCCAGGGGAGTTGCATTTG-3′(下划线处为BamH I酶切位点),下游引物Man-R:5′-GGCCGCAAGCTTTTACTCAACGATTGGCGTTAAAG-3′(下划线处为HindIII酶切位点)。
PCR反应体系:1 μL基因组DNA模板,2 μL Man-F(10 μmol/L),2 μL Man-R(10 μmol/L),25 μL Prime STAR MAX Premix(2X),20 μL ddH2O。PCR扩增反应条件:98 ℃预变性10 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min 30 s,30个循环,最后72 ℃保温5 min。PCR产物用0.8%的琼脂糖凝胶电泳检测,胶回收扩增产物送至上海生工生物技术有限公司测序。
将质粒pACYCDuet-1经BamH I和HindIII双酶切,胶回收目的条带,与经同样双酶切的目的基因PCR产物通过T4连接酶16 ℃过夜连接,将连接产物转化E.coliDH5α感受态细胞,涂布于含100 μg/mL氯霉素的LB平板上,37 ℃避光培养,筛选阳性转化子培养提取质粒,经BamH I和HindIII双酶切验证及送至上海生工生物技术有限公司测序,将验证正确的克隆载体命名为pACYCDuet-1-BsmanA(如图2)。

图2 重组表达载体pACYCDuet-1-BsmanA结构示意图Fig.2 Structural schematic diagram of recombinantexpression vector pACYCDuet-1-BsmanA
1.2.2 重组蛋白的表达与纯化 将重组表达载体pACYCDuet-1-BsmanA转入表达宿主E.coilBL21(DE3)感受态细胞中,涂布于含100 g/mL氯霉素的LB抗性平板上,筛选阳性转化子。将验证正确的含有pACYCDuet-1-BsmanA的E.coliBL21(DE3)单菌落接种于含100 μg/mL氯霉素的LB液体培养基中,37 ℃,200 r/min培养14 h。按OD600为0.1的接种量转接到含100 μg/mL氯霉素的LB液体培养基中,继续培养OD600至0.6。加入诱导剂IPTG使其终浓度为0.8 mmol/L,于20 ℃,160 r/min诱导表达8 h后4 ℃、11000 r/min离心10 min收集菌体。用50 mmol/L、pH6.5的磷酸缓冲液洗涤菌体3次后,按菌体与缓冲液1∶10的比例加0.05 mol/L磷酸缓冲液重悬细胞,超声波破碎后于4 ℃、11000 r/min离心30 min收集上清液。
本实验pACYCDuet-1-BsmanA中含有His-Tag编码序列,采用Ni-NTA柱纯化目标蛋白的方法纯化,将目的蛋白上清液经0.45 μm滤膜过滤后上柱,分别用10 mL含20、40和300 mmol/L咪唑的缓冲液进行洗脱,并按照每流出液1 mL为1毫分收集,收集活性部分保存于-20 ℃备用。
1.2.3 酶活力及蛋白质的分析 酶活力的定义及测定方法参见文献[21],重组蛋白分析采用SDS-PAGE[22],浓缩胶5%,分离胶10%,考马斯亮蓝R-250染色显示蛋白带;蛋白质含量测定采用Bradford法[23]。
1.2.4 重组酶酶学性质研究
1.2.4.1 最适温度及温度稳定性 将纯化后的β-甘露聚糖酶用pH6.5的磷酸氢二钾-柠檬酸缓冲液稀释,分别于30~80 ℃的温度下保温10 min,测定酶活力,研究温度对酶促反应的影响;将酶液置于50~80 ℃下保温90 min,每隔10 min取样测定酶活力,研究酶在不同温度下的稳定性。
1.2.4.2 最适pH及pH稳定性 分别在60 ℃,pH3.0~8.0的条件测定β-甘露聚糖酶的酶活力,研究酶的最适pH;将酶液加入上述不同梯度pH的缓冲液中稀释,置于4 ℃条件下放置1 h后测定其残留酶活力,研究酶在不同pH下的稳定性。
1.2.4.3 酶的反应动力学分析 用pH6.5、50 mmol/L的磷酸氢二钾-柠檬酸缓冲液配制质量浓度为5 g/L的魔芋粉、瓜尔胶、刺槐豆胶,测定β-甘露聚糖酶对不同底物的催化活力。以不同浓度(3~10 g/L)魔芋粉、瓜尔胶、刺槐豆胶(用pH6.5的磷酸氢二钾-柠檬酸缓冲液配制)为底物,在pH6.5,60 ℃的条件下测定酶的催化活力,Km和Vmax值通过Linewear-Burk方法[24]得到。
1.3 数据处理
运用NCBI数据库中的Blast对PCR扩增的基因序列进行在线比对,采用DNA STAR进行蛋白的多序列比对并绘制质粒pACYCDuet-1-BsmanA图谱;采用Excel对重组酶酶学性质数据作图;采用Oridin 9.5软件并进行非线性拟合,计算β-甘露聚糖酶的Km和Vmax值。实验重复3次取平均值为最终结果。
2 结果与分析
2.1 β-甘露聚糖酶(BsmanA)基因的表达与纯化
2.1.1 基因的扩增及序列分析 PCR扩增结果如图3所示,获得一条约为1100 bp的特异性单一亮条带,与预期条带大小一致。

图3 PCR扩增产物电泳图Fig.3 Electrophoretic map of the PCR amplification products注:M为DL 5000 DNA Marker;泳道1、2为BsmanA基因。
将扩增产物经胶回收后送至上海生工生物工程公司进行测序,对测序结果通过在线BLAST程序对GENBANK中登录的基因和蛋白质序列进行比对发现,扩增所获得的基因序列及推断的蛋白质序列与GenBank中已经登录的枯草芽孢杆菌WL-7和枯草芽孢杆菌CICC9011中的β-甘露聚糖酶基因和蛋白质序列具有高度一致性,最高分别达到99%和98%,初步鉴定扩增的基因为β-甘露聚糖酶基因,将其命名为BsmanA基因。
2.1.2 表达载体的构建 将上述PCR扩增所得产物纯化后,与质粒pACYCDuet-1分别用BamH I和HindIII双酶切(如图4),酶切位点位于目的基因两端,经双酶切后目的基因大小变化很小,电泳结果与预期相符,胶回收产物后将分别经酶切的载体pACYCDuet-1与PCR产物通过T4连接酶过夜连接,得到重组表达质粒pACYCDuet-1-BsmanA。
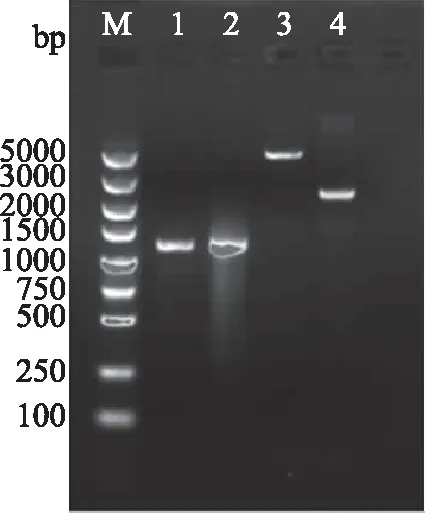
图4 PCR产物与质粒进行双酶切Fig.4 Double digestion of PCR products and plasmids注:M为DL5000 DNA Marker;泳道1为目的基因BsmanA;泳道2为BamH I和Hind III双酶切目的基因BsmanA;泳道3为BamH I和Hind III双酶切质粒pACYCDuet-1;泳道4为质粒pACYCDuet-1。
对筛选到的阳性克隆pACYCDuet-1-BsmanA再次用BamH I和HindIII进行双酶切(图5),1号泳道为BamH I和HindIII双酶切质粒pACYCDuet-1结果,于5000 bp位置附近可见一条清晰地条带,3号泳道为双酶切结果,可以清晰观察到5000和1100 bp附近两条电泳带,条带大小与质粒及目的基因大小相符,可初步验证目的基因BsmanA成功连接至pACYCDuet-1。

图6 重组蛋白氨基酸序列比对Fig.6 Amino acid sequence alignment of recombinant protein
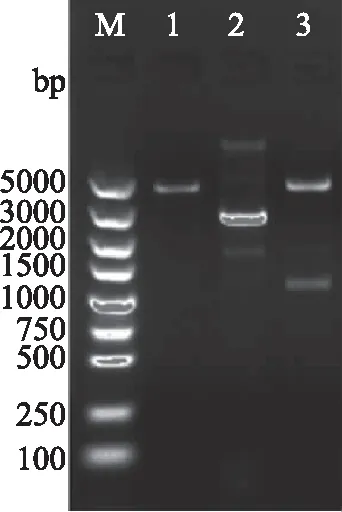
图5 重组表达质粒pACYCDuet-1-BsmanA的酶切电泳图谱Fig.5 Digestion Electrophoresis of Recombinant ExpressionPlasmid pACYCDuet-1-BsmanA注:M为DL5000 DNA Marker;泳道1为BamH I和Hind III双酶切质粒pACYCDuet-1;泳道2为质粒pACYCDuet-1;泳道3为BamH I和Hind III双酶切重组质粒pACYCDuet-1-BsmanA。
2.1.3 序列分析 将酶切验证正确的质粒送至上海生工公司测序,并在NCBI数据库中进行比对,结果显示:该β-甘露聚糖酶基因的序列全长为1098 bp,包含366个氨基酸的编码序列。通过NCBI中的Blast比对β-甘露聚糖酶的氨基酸序列结果如图6所示:该酶的氨基酸序列与芽孢杆菌属来源的MK-2(2016)β-mannanase(man)gene(GenBank登录号:ANG59296.1)和Bacillussubtilissubsp. subtilis str. SC-8(GenBank登录号:EHA29041.1)的序列相似性高达99%。
2.1.4 重组蛋白的异源表达和纯化 将样品组(构建成功的重组菌株E.coliBL21(DE3)-pACYCDuet-1-BsmanA)和空白组(没有整合BsmanA基因的pACYCDuet-1空载体转化到大肠杆菌 BL21(DE3)中进行表达的空白菌株E.coliBL21(DE3)-pACYCDuet-1),分别以IPTG为诱导剂以相同的条件进行重组蛋白的诱导表达,收集的菌体经超声破碎破壁后测定酶活(图7),测得空白组菌株E.coliBL21(DE3)-pACYCDuet-1无明显β-甘露聚糖酶活力,诱导表达的样品组重组菌株E.coliBL21(DE3)-pACYCDuet-1-BsmanA破壁上清的β-甘露聚糖酶活力高达220 U/mg。而没有IPTG诱导作用的重组菌株E.coliBL21(DE3)-pACYCDuet-1-BsmanA培养后也无法测得甘露聚糖酶活性。由此可证明,枯草芽孢杆菌G1中的β-甘露聚糖酶基因BsmanA成功地在大肠杆菌中获得了表达。
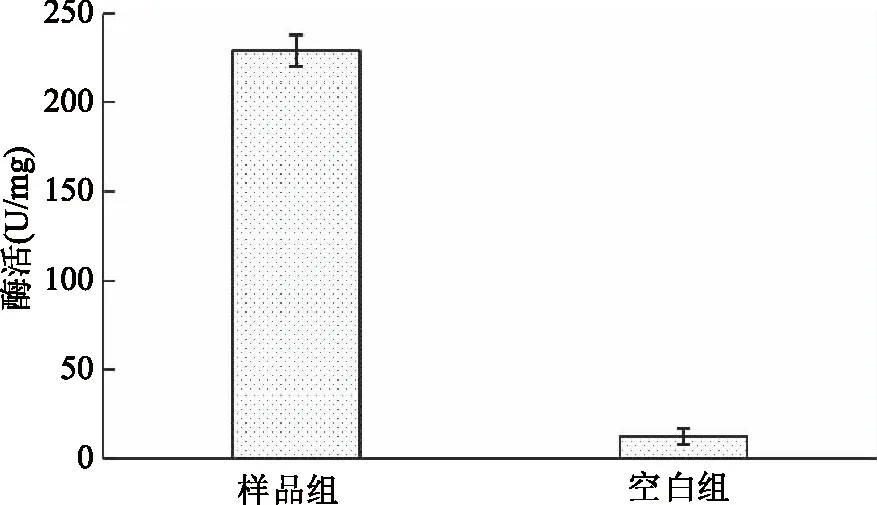
图7 重组菌株与空载菌株酶活检测Fig.7 Enzyme activity detection ofrecombinant and empty strains
重组菌菌体破壁上清液蛋白SDS-PAGE电泳分析如图8所示,重组菌E.coliBL21(DE3)-pACYCDuet-1-BsmanA在IPTG诱导下进行异源表达的β-甘露聚糖酶含有His标签,经镍柱亲和层析纯化后,与重组菌菌体破壁上清液相比,纯化后的目的蛋白条带较单一,目的条带分子量约为38 kD,与预期相符,这与已报道的BacillussubtilisBCC41051[25]中的β-甘露聚糖酶蛋白分子量相近,均为38 kD。
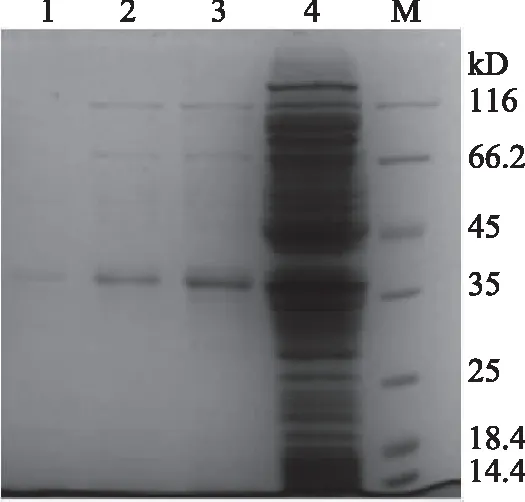
图8 重组蛋白纯化SDS-PAGE电泳Fig.8 Purification of SDS-PAGEelectrophoresis by recombinant protein 注:M为蛋白Marker;泳道1为40 mmol/L咪唑平衡缓冲液第10毫分;泳道2为40 mmol/L咪唑平衡缓冲液第1毫分;泳道3为20 mmol/L咪唑平衡缓冲液第6毫分;泳道4为粗酶液。
2.2 BsmanA的酶学性质
2.2.1 最适反应温度和温度稳定性 温度对重组甘露聚糖酶活力的影响结果如图9所示,酶的最适温度为60 ℃,在45~70 ℃间保持60%以上的酶活,由Srivastava等[26]研究可知,微生物来源的甘露聚糖酶在37~70 ℃的不同温度下具有活性,从各种芽孢杆菌分离出的甘露聚糖酶在50~70 ℃范围内具有活性。一般来说,细菌甘露聚糖酶比真菌甘露聚糖酶更耐热,这是纸浆漂白等工业应用的一个重要特性。将该重组酶置于不同温度下孵育90 min后,测定其剩余酶活力的结果显示,在50~70 ℃保温70 min时,剩余酶活力在70%以上,可以认为具有较好的热稳定性;当处理温度提高至80 ℃以上,酶活显著降低。

图9 重组甘露聚糖酶最适反应温度和温度稳定性Fig.9 Optimum reaction temperature and temperaturestability of recombinant mannanase注:A:重组β-甘露聚糖酶的最适温度;B:重组β-甘露聚糖酶的温度稳定性。

图10 重组甘露聚糖酶最适pH和pH稳定性Fig.10 Optimum pH and pH stability of recombinant mannanase注:A:重组β-甘露聚糖酶的最适pH;B:重组β-甘露聚糖酶的pH稳定性。
2.2.2 最适pH和pH稳定性 不同pH对重组甘露聚糖酶活力的影响结果如图10所示,纯化后的甘露聚糖酶蛋白在pH6.5条件下酶活最高,且在pH5.0~7.0之间表现出显著(P<0.05)活性,保留最高酶活79%以上的活性。酸碱度对酶功能的影响与酶底物复合物的形成有关,催化作用往往依赖于酶和底物上的电荷分布。据报道,细菌来源的甘露聚糖酶在中性至碱性的pH下具有最大活性,例如Srivastava等[27]研究报道的Bacillussp. CFR1601产的一种β-甘露聚糖酶(GH-26)在pH7下具有最佳活性。在pH稳定性方面,许多真菌来源获得的-β-甘露聚糖酶在酸性到中性范围(pH4.0~7.0)内可保持最高酶活的80%活性,细菌甘露聚糖酶在pH6.0~9.0范围内表现出显著的稳定性[26],本实验中,在pH4.5~7.0,重组酶的酶活表现出高度的稳定性,于4 ℃保温1 h,剩余酶活仍达75%以上。
2.2.3β-甘露聚糖酶的反应动力学分析 通过改变底物的浓度,测定纯化后的重组甘露聚糖酶对不同底物的活性,结果显示重组酶对魔芋粉精粉催化活性最高,将其对魔芋粉的催化活性定为100%,该酶对刺槐豆胶和瓜尔胶的催化活性远低于魔芋精粉,相对酶活分别为20.9%和0.08%。重组甘露聚糖酶对魔芋粉的Km和Vmax值分别为4.09 mg/mL和9.86 μmol/(mL·min)。
3 结论
本文从魔芋生长的土壤里分离出一株具有甘露聚糖水解能力的枯草芽孢杆菌G1,研究发现产生的甘露聚糖酶对魔芋粉水解效率较高,能水解魔芋粉中的魔芋葡甘聚糖得到魔芋低聚糖,有效提高魔芋的深加工利用价值。
本研究中成功克隆枯草芽孢杆菌G1中的甘露聚糖酶BsmanA编码基因并在大肠杆菌BL21(DE3)中实现了异源表达,重组β-甘露聚糖酶为胞内酶,对魔芋粉的比活性为220 U/mg,纯化后的酶学性质研究表明,该酶的最适反应温度为60 ℃;在50 ℃处理90 min 后残留酶活性为64%,80 ℃处理30 min后残留酶活性为35%;其最适pH为6.5,在pH4.5~7.0的范围内较稳定;所测酶的最适底物为魔芋粉,其对魔芋粉的Km和Vmax值分别为4.09 mg/mL和9.86 μmol/(mL·min)。本研究描述了BsmanA的克隆和详细的序列分析,这些研究为生物催化制备低聚甘露糖的工业化生产奠定了基础,展示了其在食品和动物饲料技术中的潜在应用价值,也为其它新酶在的基因进一步开发和应用上提供了新的思路和策略。
