骆驼掌胶原蛋白提取工艺优化与性能分析
2020-04-02王英丽吉日木图
宋 乐,王英丽,吉日木图
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010000)
胶原蛋白是动物组织中的一种纤维状蛋白质,是构成细胞外基质的主要成分,占动物体内蛋白质总量的30%左右[1],对机体和脏器起着支持、保护、结合与形成间隔作用,其特征结构是三螺旋结构,使胶原蛋白保持其稳定结构,同时还具有良好的生物相容性、可降解性和低抗原性等[2]。因此,胶原蛋白作为可食性或可降解胶原膜[3]、促进肌肉组织愈合的伤口敷料[4]、保健食品等被广泛应用于皮革、制药、生物医学与食品等行业领域中。目前国内对水产动物等胶原资源关注点较多,但其提取获得的胶原蛋白存在热稳定性与生物力学性能差等问题,在一定程度上限制其应用[5-6]。此外,牛、羊、猪的皮、跟腱等也是胶原蛋白提取的主要来源,而对骆驼资源胶原蛋白的研究则较少。
内蒙古自治区是国内主要的养驼基地之一,据中国统计年鉴显示,2018年我国约有32.3万峰双峰驼,我区约有16.9万峰。骆驼肉、乳、皮、绒与骨均具一定经济价值,其胎盘、乳、脂、瘤胃内容物等部位科研价值极高[7]。相关研究表明,骆驼掌营养价值高,富含胶原蛋白,是丰富的胶原蛋白潜在资源[8]。骆驼掌传统加工的方式主要以烹调为主,为扩大骆驼掌的利用范围,增加骆驼的附加值,本文以骆驼掌为实验原料,选用胃蛋白酶从骆驼掌中提取胶原蛋白,确定其最佳提取工艺参数。经过盐析纯化后,获得骆驼掌胶原蛋白粗品,并与牛蹄胶原蛋白进行性质比较,以期为动物胶原蛋白资源的开发利用提供理论参考。
1 材料与方法
1.1 材料与仪器
新鲜骆驼掌 购于阿拉善盟左旗屠宰场,剔骨洗净在-20 ℃下冷藏备用;羟脯氨酸标准品、牛蹄胶原蛋白 北京索莱宝生物科技有限公司;胃蛋白酶(1∶10000;800~2500 U/mg) 美国Sigma公司;标准蛋白Marker 上海伯乐(Bio-Rad)公司;其他试剂 均为国产分析纯。
JJ-2组织捣碎机 常州赛普实验仪器厂;78-1磁力加热搅拌器 常州迅生仪器有限公司;鼓风干燥箱 上海博迅实业有限公司;SP-723P可见分光光度计 上海光谱仪器有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;2XZ-2型旋片式真空泵 临海市永昊真空设备有限公司;紫外可见分光光度计 日立高新技术公司;BPHJS-060A高低温交变湿热试验箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 胶原蛋白提取工艺 新鲜冷冻骆驼掌→预处理→酶解→离心→盐析→离心→透析→冷冻干燥→胶原蛋白
将解冻后的骆驼掌剪成小块,在10%正丁醇中浸泡脱脂24 h,离心后弃上清,沉淀去除表面的正丁醇。随后浸泡在0.1 mol/L的NaOH溶液中24 h,以除去杂蛋白,碱处理后的骆驼掌用去离子水冲洗至中性备用。取脱脂除杂蛋白后的样品,以一定的料液比(w/v)加入乙酸溶液,再加入一定量的胃蛋白酶酶解反应一定时间,10000 r/min离心20 min,保留上清酶解液,测定其胶原蛋白含量。在离心所得上清酶液中加入NaCl至最终浓度为0.9 mol/L进行盐析,取沉淀用0.5 mol/L乙酸溶解后,依次在0.1 mol/L的乙酸溶液和蒸馏水中透析24 h,每6 h更换一次透析外液,离心后进行冷冻干燥得粗品胶原蛋白,妥善保存[9]。胶原蛋白提取所有操作在低于10 ℃条件下进行。
1.2.2 单因素实验 以骆驼掌胶原蛋白提取率为指标,采用1.2.1的方法,固定提取时间为36 h,加酶量3%,乙酸浓度0.50 mol/L,料液比为1∶15 g/mL进行实验。
设定变量因素的水平依次为提取时间(12、24、36、48、60、72 h)、加酶量(1%、2%、3%、4%、5%、6%)、乙酸浓度(0.25、0.50、0.75、1.00、1.50 mol/L)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25 g/mL)进行单因素实验。
1.2.3 正交试验 在单因素结果的基础上,以提取时间、加酶量、乙酸浓度、料液比为影响因素,各取三个水平,采用L9(34)正交试验设计,以胶原蛋白提取率为指标,确定骆驼掌胶原蛋白的最优提取工艺。骆驼掌胶原蛋白的试验因素及水平见表1。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal experiments
1.2.4 胶原蛋白提取率 采用比色法[10]测定羟脯氨酸标准曲线。羟脯氨酸质量浓度范围0~2 μg/mL,以羟脯氨酸质量浓度为横坐标、吸光度为纵坐标制作标准曲线,得方程Y=0.1935X+0.0318(R2=0.9997)。
按照1.2.1的方法进行提取,移取离心后的上清酶解液1 mL,加入3 mL的6 mol/L盐酸在105 ℃下完全水解5 h[11],用分光光度法测定酶解液中羟脯氨酸含量,通过标准曲线方程结合式(1)与式(2),计算胶原蛋白的含量并计算其提取率。
胶原蛋白含量=羟脯氨酸含量×7.1
式(1)
式(2)
式中:X表示酶解液中胶原蛋白含量,μg/mL;Y表示原料中胶原蛋白的含量,为99.63 μg/mL;7.1为羟脯氨酸换等成胶原蛋白系数。
1.2.5 紫外光谱扫描 取最优条件下制备的粗品胶原蛋白,用0.5 mol/L的乙酸配制0.5 mg/mL的胶原蛋白溶液[12],用紫外分光光度计在波长200~400 nm进行扫描,波长间隔为1 nm,蒸馏水作空白对照。
1.2.6 SDS-PAGE分析 将样品以0.5 mg/mL的浓度溶于0.5 mol/L的乙酸溶液,混合物与上样缓冲液混匀后于100 ℃的水浴加热3~5 min,冷却后以10 μL上样量进行上样。采用8%的分离胶和5%的浓缩胶[13]。直压恒流电源,浓缩胶80 V,进入分离胶后调整为120 V,电泳时间为2~3 h。
1.2.7 吸油性分析 准确量取2 mL食用级花生油,放置于5 mL刻度离心管中,再称取0.3 g样品(骆驼掌胶原蛋白和牛蹄胶原蛋白),加入离心管中,用细棒搅拌1 min,静置30 min,在转速为10000 r/min离心10 min,记下游离油的体积[14],则样品的吸油性为:

式(3)
1.2.8 吸湿性分析 精确称取样品0.5 g(骆驼掌胶原蛋白和牛蹄胶原蛋白),置于干燥的称量瓶中,放入密闭恒温恒湿培养箱,温度为30 ℃,湿度为80%,每隔一段时间精确测定样品的质量,同时用甘油作对照,重复做3组平行试验[15-16],计算样品和甘油的吸湿率,以时间为横坐标,吸湿率为纵坐标作图。吸湿率计算公式如下:
式(4)
式中:X表示吸湿率,%;mt表示t小时后样品或甘油的质量,g;m0表示试验开始时样品或甘油的质量,g。
1.2.9 保湿性分析 精确称取样品0.5 g(骆驼掌胶原蛋白和牛蹄胶原蛋白),置于称量瓶中,同时在称量瓶中加入样品质量的10%蒸馏水,放入含有干燥剂的密闭干燥器中,每隔一段时间精确测定样品的质量,同时用甘油作对照[15-16],重复做3组平行试验,计算样品和甘油的保湿率,以时间为横坐标,保湿率为纵坐标作图。保湿率计算公式如下:
式(5)
式中:Y表示保湿率,%;m0表示试验开始时样品或甘油的质量,g;mt表示t小时后样品或甘油的质量,g。
1.3 数据处理
所有指标均重复3次,采用Excel 2013和Graphpad-Prism 6.01进行作图,用SPSS 19.0进行数据处理。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取时间对骆驼掌胶原蛋白提取率的影响 由图1可知,随着提取时间的延长,骆驼掌胶原蛋白的提取率呈现先升高后下降趋势(P<0.05),在提取时间为48 h时,骆驼掌胶原蛋白提取率达到最高,这表明随着提取时间的延长,骆驼掌中胶原蛋白与胃蛋白酶充分接触,利于骆驼掌中胶原蛋白溶出。当提取时间超过48 h时,提取液中胶原蛋白达到饱和状态,随着提取时间继续延长,胶原蛋白含量显著下降(P<0.05),这可能是因为提取出来的胶原蛋白部分被胃蛋白酶酶解,此测定结果与宋正规等[17]结果一致。由此,试验初步选择骆驼掌胶原蛋白提取时间范围为24~48 h。
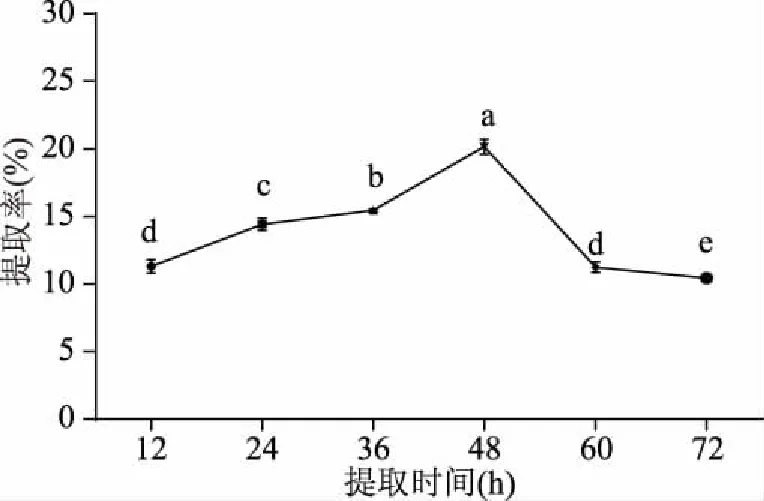
图1 提取时间对骆驼掌胶原蛋白提取率的影响Fig.1 Effect of extraction time on collagen yield of camel palm注:图中不同小写字母表示差异显著(P<0.05),图2~图4同。
2.1.2 加酶量对骆驼掌胶原蛋白提取率的影响 由图2可以看出,随着胃蛋白酶加酶量的增加,骆驼掌胶原蛋白提取率呈先升后降趋势(P<0.05)。胃蛋白酶加酶量从1%增至5%时,胶原蛋白提取率增长速度较快,当超过5%时,可能是由底物不足影响反应的继续进行,增加加酶量,提取率不再增长,而加酶量过高,可能会过度酶解,使小分子的蛋白片段断链为游离的氨基酸,导致胶原蛋白提取率显著下降[18-19],因此,初步选择骆驼掌胶原蛋白提取加酶量的范围为3%~5%。
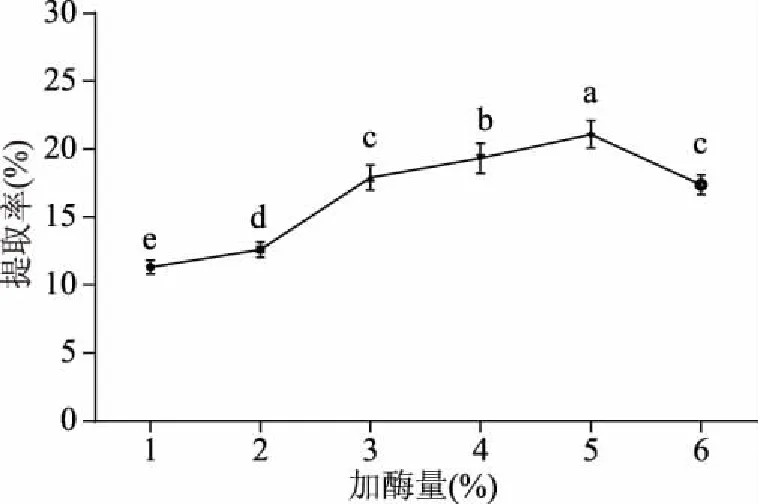
图2 加酶量对骆驼掌胶原蛋白提取率的影响Fig.2 Effect of enzyme concentration on collagen yield of camel palm
2.1.3 乙酸浓度对骆驼掌胶原蛋白提取率的影响 由图3可知,随着乙酸浓度的增加,骆驼掌胶原蛋白的提取率也增加,在浓度超过1.00 mol/L时,提取率开始显著下降(P<0.05),可能因为乙酸浓度过高,骆驼掌蛋白稳定性下降,胶原蛋白肽链极易断链,产生大量的肽链片段[20],导致胶原蛋白的提取率下降,因此,初步选择骆驼掌胶原蛋白提取的乙酸浓度为0.50~1.00 mol/L。
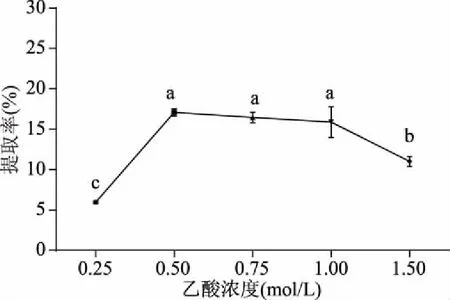
图3 乙酸浓度对骆驼掌胶原蛋白提取率的影响Fig.3 Effect of acetic acid concentration on collagen yield of camel palm
2.1.4 料液比对骆驼掌胶原蛋白提取率的影响 由图4所示,骆驼掌胶原蛋白的提取率受料液比影响较大(P<0.05)。随着料液比的增大,骆驼掌胶原蛋白的提取率呈显著提高的趋势。当料液比达到1∶15 g/mL时,骆驼掌胶原蛋白提取率最高,继续增大料液比,提取率没有显著变化,因此,初步选择骆驼掌胶原蛋白提取的料液比为1∶15~1∶25 g/mL。
2.2 骆驼掌胶原蛋白提取工艺优化结果
结合表2和表3可知,提取时间、加酶量、乙酸浓度、料液比对骆驼掌胶原蛋白的提取率均有极显著影响,其中提取时间影响最大,乙酸浓度影响最小。正交试验优化骆驼掌胶原蛋白的提取工艺有两种组合,即A3B2C1D1(D2),按照两种工艺组合做验证试验,结果表明两种方案的提取率相近,没有显著差异,考虑到试验成本,故选取方案:A3B2C1D1,即提取时间48 h,加酶量4%,乙酸浓度0.50 mol/L,料液比1∶15 g/mL,此条件下提取率为30.33%±0.19%。
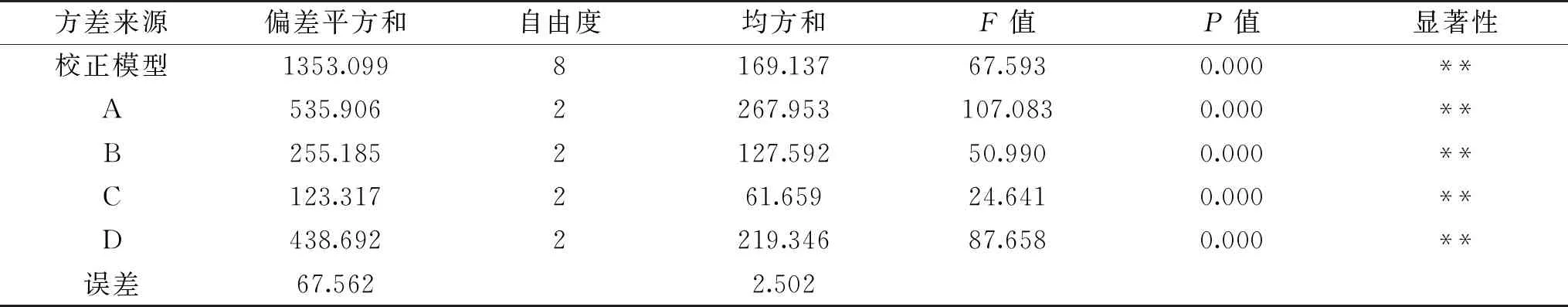
表3 主体间效应的检验Table 3 Test of intersubject effect

图4 料液比对骆驼掌胶原蛋白提取率的影响Fig.4 Effect of solid-to-liquid ratio on collagen yield of camel palm
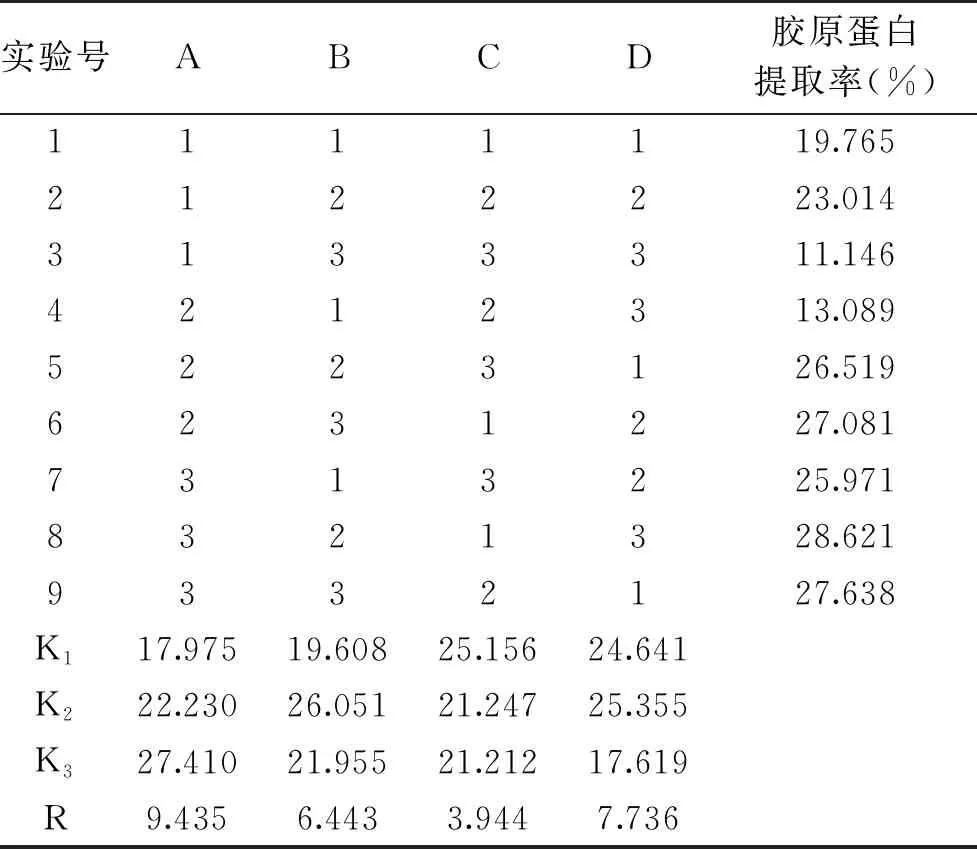
表2 正交试验设计与结果Table 2 Design and results of orthogonal test
2.3 紫外扫描图谱分析
由于胶原蛋白中存在羰基、羧基和酰胺基等发色基团,使其能吸收一定波长的紫外光。一般来说,芳香族氨基酸残基会在250~280 nm波长范围内产生吸收峰;氨基酸残基、氢键或与螺旋等构象相关的次级键会在210~250 nm波长范围内产生吸收峰;蛋白质分子中的肽键及某些与蛋白质构象相关因素会在210 nm波长以下范围内产生吸收峰[21-22]。由图5可知,骆驼掌胶原蛋白的最大吸收峰出现在232 nm处,与相关研究的结果相近[23-24],是胶原蛋白三股螺旋结构的特征吸收峰,可初步判定本试验的提取物为胶原蛋白。
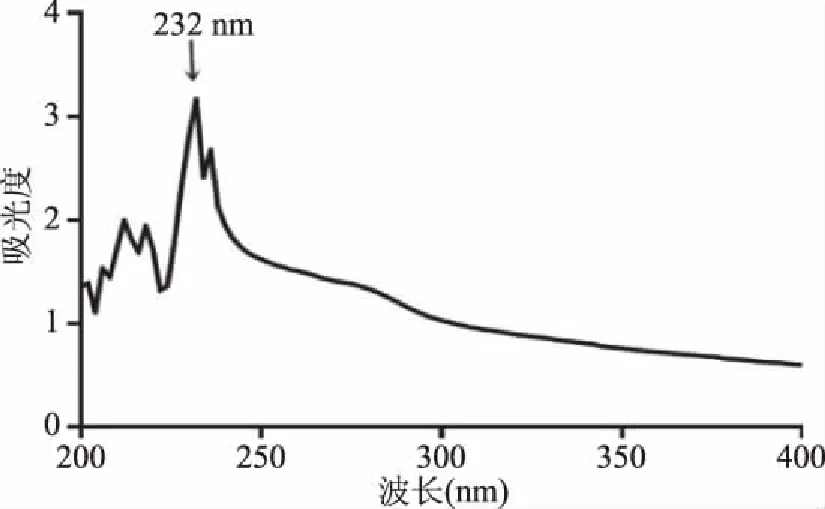
图5 骆驼掌胶原蛋白的紫外扫描图谱Fig.5 Ultraviolet scan of collagen of camel paw
2.4 SDS-PAGE图谱分析
由图6所示,与Marker对比,骆驼掌胶原蛋白中含有1条β链和至少2条α链,在高于250 kDa处的条带是Ⅰ型胶原蛋白α链的三聚体,即γ链;在200 kDa处是α链二聚体,即β链;130 kDa处为α1链;约110 kDa处是α2链,与王晓军等[23]结果一致。因此,判断提取物为结构较为完整的Ⅰ型胶原蛋白。研究表明,高分子质量的γ和β链含量越高,胶原蛋白的凝胶强度就越低[25],骆驼掌胶原蛋白的γ和β链含量较少,表明骆驼掌胶原蛋白的凝胶性较好。骆驼掌胶原蛋白的α1带的强度约为α2带的2倍,表明骆驼掌胶原蛋白分子可能由两条α1链和一条α2链构成,而由于α1-和α3-在单相垂直电泳中无法分离,α1链中可能含有α3链[26],因此骆驼掌胶原蛋白分子也可能由α1链、α2链和α3链各一条构成[27]。
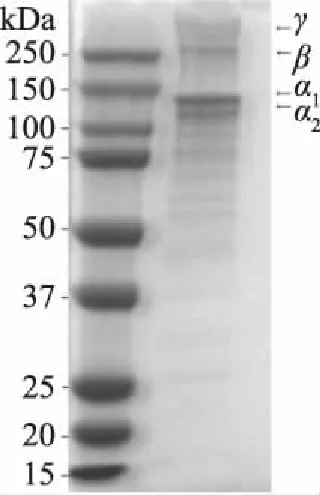
图6 SDS-PAGE凝胶电泳分析图谱Fig.6 SDS-PAGE patterns of collagen
2.5 骆驼掌胶原蛋白、牛蹄胶原蛋白的吸油性对比分析
骆驼掌蛋白质与牛蹄蛋白质含量相近,且市面上的哺乳动物胶原蛋白产品多来源于牛蹄,由此试验选择牛蹄胶原蛋白比较分析骆驼掌胶原蛋白的性能。骆驼掌胶原蛋白吸油性测定结果表明,骆驼掌胶原蛋白的吸油值为(6.22±0.44) mL/g,同时测得牛蹄胶原蛋白的吸油值为(10.68±0.26) mL/g,骆驼掌胶原蛋白的吸油性弱于牛蹄胶原蛋白的吸油性。
2.6 骆驼掌胶原蛋白、牛蹄胶原蛋白的吸湿性和保湿性对比分析
胶原蛋白富含亲水性的甘氨酸、羟脯氨酸、羟赖氨酸等天然保湿因子,性质温和,不刺激皮肤和眼睛,它与皮肤表面的蛋白质结合,可补充人体流失的胶原蛋白、氨基酸,能涵养皮肤水分,使皮肤有良好的亲合性[28]。从图7和图8可看出,随着时间延长,骆驼掌胶原蛋白和牛蹄胶原蛋白的吸湿率和保湿率曲线变化相似。与甘油的吸湿率和保湿率对比,骆驼掌胶原蛋白和牛蹄胶原蛋白明显均弱于甘油,且骆驼掌胶原蛋白的吸湿性和保湿性均比牛蹄胶原蛋白好。当放置达到48 h时骆驼掌胶原蛋白与牛蹄胶原蛋白的吸湿率分别为8.15%和5.79%,其保湿率分别为50.15%和43.17%。胶原蛋白的吸湿率和保湿率与其暴露的亲水基团有关[29],由上述试验结果可推测出骆驼掌胶原蛋白和牛蹄胶原蛋白的亲水基团存在差异。
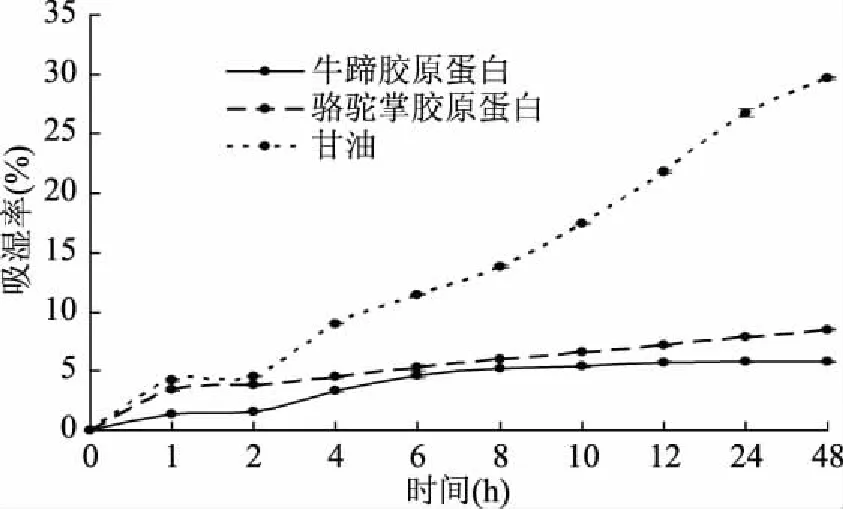
图7 骆驼掌胶原蛋白、牛蹄胶原蛋白和甘油的吸湿性曲线Fig.7 Hygroscopic curve of camel palm collagen,bovine tendon collagen and glycerol
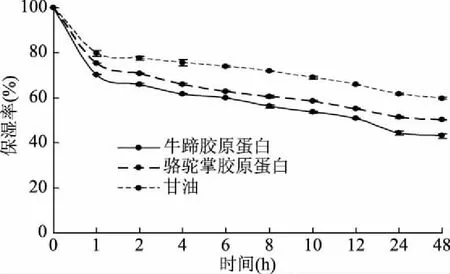
图8 骆驼掌胶原蛋白、牛蹄胶原蛋白和甘油的保湿性曲线Fig.8 Moisture retention curve of camel palm collagen,bovine tendon collagen and glycerol
3 结论
本试验优化骆驼掌胶原蛋白的提取工艺最优组合为提取时间48 h、胃蛋白酶加酶量为4%、乙酸浓度为0.50 mol/L、料液比为1∶15 g/mL,得到骆驼掌胶原蛋白提取率为30.33%±0.19%。通过紫外光谱、垂直电泳分析骆驼掌胶原蛋白的最大吸收峰为232 nm,符合I型胶原蛋白特征,且含有α1、α2、β链,保留了完整的三螺旋结构。与牛蹄胶原蛋白相比,试验结果显示骆驼掌胶原蛋白的吸湿性和保湿性优于牛蹄胶原蛋白,且其吸油性弱于牛蹄胶原蛋白。为骆驼掌胶原蛋白的研究应用提供了一定的实验基础,但如何更高效的提取骆驼掌胶原蛋白,进一步研究其功能特性及应用范围,这些问题的解决将成为未来骆驼掌胶原蛋白研究的重点。
