一株丹参种子内生真菌ZJZD3的分离鉴定及其生物活性
2020-04-02,*
,*
(1.山东第一医科大学(山东省医学科学院)生命科学学院,山东泰安 271016;2.山东大学药学院,山东济南 250012;3.山东第一医科大学(山东省医学科学院)药学院,山东泰安 271016)
丹参(SalviamiltiorrhizaBge.)是双子叶植物唇形科鼠尾草属多年生直立草本植物,分布于中国安徽、河北、四川、江苏等地。除此之外,山西、山东、辽宁、甘肃等地也有分布。丹参主要含有脂溶性的二萜类成分和水溶性的丹酚酸成分,还含有黄酮类,三萜类,甾醇等其他成分[1-2],具有抗菌消炎、抗氧化、抗血栓、抗肿瘤等活性[3-6],是目前治疗心脑血管疾病的核心药物。
近年来,药用植物内生菌作为一类新的微生物资源备受人们关注。内生菌(Endophytes)是指在其生活史的部分阶段或全部阶段中,生活在健康植物各个组织和器官内部或细胞间隙,并且对活体植物组织能够造成不明显或无症状影响,其中包括内生真菌、内生放线菌、内生细菌[7]。内生菌长期生活在植物体内的特殊环境中,与宿主植物协同进化,能产生与宿主相同或相似的化学成分[7],具有抗菌、抗氧化、抗血栓、抗肿瘤[1,4,6]、促进植物生长[8-10],提高宿主植物的抗病能力[11-13]等功能。
因此,本文拟采用纯培养及生物学活性评价等方法,从丹参种子中分离内生菌,筛选具有抗菌、抗氧化和抗凝血活性的内生菌并进行分子鉴定,旨在为天然活性成分开发提供新的资源,并为丹参种子萌发以及丹参中药材的物种保护奠定基础。
1 材料与方法
1.1 材料与仪器
白花丹参(SalviamiltiorrhizaBge.f.alba)和紫花丹参(SalviamiltiorrhizaBge.)两种种子 2017年8月采自山东第一医科大学(山东省医学科学院)药用植物园;丹参病原菌1、病原菌4和病原菌6 由山东第一医科大学(山东省医学科学院)李艳玲老师分离并提供;新西兰大白兔 由山东第一医科大学(山东省医学科学院)实验动物中心提供;马铃薯葡萄糖琼脂培养基(PDA)[14]自行配制,用于分离内生真菌;马铃薯葡萄糖培养基(PD)[14]自行配制,用于真菌的液体发酵;牛肉膏蛋白胨固体培养基[14]自行配制,用于分离内生细菌;牛肉膏蛋白胨液体培养基[14]自行配制,用于细菌的液体发酵;高氏1号培养基[14]自行配制,用于分离放线菌;DPPH(1,1-二苯基-2-三硝基苯肼) Sigma公司;凝血酶原时间(PT)测定试剂盒、活化部分凝血酶时间(APTT)测定试剂盒、凝血酶时间(TT)测定试剂盒 南京建成生物工程研究所;柠檬酸钠 天津市巴斯夫化工有限公司;肝素 Solarbio公司。
OLYMPUS CX31光学显微镜 日本东京奥林巴斯;SW-CJ-2F型超净工作台 苏州安泰空气技术有限公司;YX280A 手提式数字高压灭菌锅 上海三申医疗器械有限公司;BS-2F数显振荡培养箱 上海梅香仪器有限公司;ICYCLER PCR仪 美国伯乐。
1.2 实验方法
1.2.1 丹参种子内生菌的分离纯化 随机挑选无霉变、饱满和无虫咬的白花丹参种子和紫花丹参种子各150粒,先将其在蒸馏水中浸泡过夜,清洗后晾干。按照下列方法[15]进行表面消毒:用75%的酒精浸泡两种种子30 s,再在3%的次氯酸钠溶液中浸泡5 min左右,后在75%酒精中浸泡1 min,用无菌水冲洗3~5次,每次3 min左右,用滤纸将种子表面液体吸干。用灭菌的解剖刀将两种丹参种子切开,分别接于PDA培养基、牛肉膏蛋白胨培养基、高氏1号培养基上,每种培养基设置10个平板(白花种子和紫花种子各设置5个平板)且每个平板均放置10粒处理过的种子,分别置于28、37、28 ℃的培养箱中黑暗培养。培养5~7 d之后,用接种针挑取种子周围长势较好的菌接至新的固体培养基上,待新接种的内生菌长成菌落后,再挑取其边缘的内生菌进行培养,如此反复3~4次后得到纯化的菌株,保存备用。将得到的纯化菌株进行编号并4 ℃冰箱保藏。
1.2.2 内生菌的形态学鉴定 通过直接观察菌落大小、颜色、质地、边缘、渗出物等对菌落形态进行描述。用牙签挑取少量菌落置于中央滴有清水的载玻片上,盖上盖玻片,置于显微镜下观察真菌孢子结构。
1.2.3 内生菌菌株的液体培养及发酵液处理
1.2.3.1 真菌的液体发酵 用打孔器从PDA培养基上取直径为0.6 cm的内生真菌菌块,接种于灭菌后的75 mL液体培养基中,28 ℃摇床振荡培养5~7 d。发酵液以8000 r/min离心5 min,取上清液,备用。
1.2.3.2 细菌的液体发酵 用接种环挑取细菌单菌落于牛肉膏蛋白胨液体培养基中,37 ℃摇床200 r/min振荡培养24 h。发酵液以8000 r/min离心5 min,取上清液,备用。
1.2.4 内生菌对丹参病原菌的抑菌活性测定
1.2.4.1 内生真菌对丹参病原菌的抑菌活性测定 平板对峙法测定内生真菌的抗丹参病原菌活性[15-16]。用打孔器分别取直径0.6 cm的三种病原菌以及内生真菌菌块,置于灭菌的PDA培养基距培养皿边缘距离2 cm处,以只接病原真菌的平板作为对照,处理和对照均设3次重复,置于25 ℃下恒温培养5~7 d。然后,测量对峙拮抗带宽度的直径大小,以拮抗带宽度直径大小衡量分离内生真菌抑菌效果的强弱。
十字交叉法测定内生真菌发酵液对丹参病原菌的抑菌活性[17]。将发酵液抽滤,8000 r/min、4 ℃离心5 min后,取上清液与培养基按体积比1∶2的比例混合均匀,倒入无菌的平板中,配制成带毒培养基[18]。待培养基凝固后在平板的中央接一块丹参枯萎病病原菌菌饼,并设置对照组,在不带毒的PDA培养基平板中央同样接一块病原菌,每个处理3个重复,28 ℃恒温培养4 d。观察病原菌的生长状态,并测量出实验组和对照组病原菌菌落直径,通过十字交叉法[17]计算抑菌率,评估丹参内生真菌发酵液对丹参病原菌的抑制效果。
抑菌率(%)=(对照组菌落直径-实验组菌落直径)/对照组菌落直径×100
1.2.4.2 内生细菌对丹参病原菌的抑菌活性测定 采用滤纸片法[19],选择具有抑菌活性的菌株,进一步研究其次级代谢产物的抑菌活性。将内生菌发酵液的上清液置于灭菌的离心管中,然后放入直径为0.6 cm的滤灭菌纸片浸泡30 min;用打孔器打孔,取直径为0.6 cm的三种病原菌分别置于灭菌的PDA培养基中,使其距离平板边缘2 cm,将浸泡过的滤纸片同样距离平板边缘2 cm放置于带有病原菌的PDA培养基中,重复3次。以只接病原真菌的平板作为对照,处理和对照均设3次重复,置于25 ℃下恒温培养5~7 d,测定对照病原菌和处理病原菌的直径,计算抑菌率。
1.2.5 内生菌的抗氧化活性测定 采用DPPH法[15]测定丹参内生菌的抗氧化活性。用无水乙醇配制0.1 mmol/L的DPPH溶液,避光保存。内生菌滤液用旋转蒸发仪,真空度1.35×107Pa,温度-45 ℃减压蒸发浓缩至膏状,加入3倍体积的95%乙醇振荡提取2次,真空干燥得粗提物,用无水乙醇配成0.5 mg/mL的溶液。VC为阳性对照,也配成相同的浓度。将1 mL内生菌粗提液及3 mL DPPH溶液加入同一离心管中,摇匀,室温下静置30 min,测定吸光度为As。将3 mL DPPH溶液与1 mL蒸馏水加入同一试管中,摇匀,室温下静置30 min,测定吸光度为Ac。将1 mL内生菌粗提液与3 mL无水乙醇加入同一离心管中,摇匀,室温下静置30 min,测定吸光度为Ab。每个测试样品重复三次,计算每个测试样品的清除率。清除率计算公式如下:

1.2.6 内生菌的抗凝血活性测定
1.2.6.1 兔耳缘静脉取血 将兔放入仅露出头部及两耳的固定盒中,选择耳静脉清晰的耳朵,将耳静脉部位的毛拔去,用75%酒精局部消毒,待干。然后用手指轻轻摩擦兔耳,使其静脉扩张,耳缘静脉取血,取血完毕用棉球压迫止血。
1.2.6.2 抗凝血活性测定 将内生菌发酵液上清冷冻干燥,用0.9%生理盐水∶甲醇(7∶3)作为溶剂,制备10 mg/mL的溶液。按照本实验室建立的抗凝血活性测定方法[20]。每组准备四支试管,分别编号甲、乙、丙、丁,甲试管加入(0.9%生理盐水)1 mL为空白对照;乙试管加入0.2%肝素钠1 mL;丙、丁各加入1 mL内生菌提取液。从家兔耳缘静脉或兔耳中央动脉采血4 mL,自血液进入注射器开始计时,三支试管各加1 mL血样,充分振摇后,将这些试管放入37 ℃的水浴锅中。每隔30 s倾斜试管一次,观察三支试管的血液凝固情况,直至将试管倒置血液不流动为止,取平均值。以0.9%的氯化钠溶液为空白对照,以0.2%肝素为阳性对照,重复操作三次,测定内生菌对兔凝血时间(CT)的影响。并按照方法[20]测定内生菌发酵液对兔凝血酶时间(TT)、凝血酶原时间(PT)以及活性部分凝血酶时间(APTT)的影响。
1.2.7 抗菌、抗氧化、抗凝血内生真菌的分子鉴定 筛选具有抗菌、抗氧化、抗凝血作用的菌株,采用改良SDS法提取基因组DNA,通过通用引物对ITS1/ITS4进行PCR扩增:ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′)和ITS4(5′-TCC TCCGCT TAT TGA TAT GC-3′)[15,21]。反应结束后取5 μL PCR产物,通过1.5%琼脂糖凝胶电泳检测。将PCR反应产物纯化后,送到上海铂尚生物科技有限公司测序后,将其序列与GenBank数据库中已登陆的序列进行Blast比对,搜索同源序列。采用MEGA 4.0软件Clustal X 1.81方法构建系统发育树。
1.3 数据处理
用SPSS 19.0软件进行数据分析,所有实验均重复3次,结果采用平均值±标准差表示。
2 结果与分析
2.1 丹参种子内生菌分离纯化及培养特征观察
从50粒紫花种子中分离出9株真菌、9株细菌;从50粒白花种子中分离出11株真菌、2株细菌(表1)。分离的内生真菌和内生细菌种类较少,主要是分离方法、消毒方法和培养基影响了分离结果[22-23],可考虑优化培养基种类和消毒时间提高分离率。

表1 两种丹参种子内生菌的分离率Table 1 Isolation rate of endophytes from two species of Salvia miltiorrhiza seeds
将丹参种子内生菌转接于固体培养基上,继续纯化培养,内生真菌和内生细菌的菌落形态描述,见表2和表3。根据显微镜下对菌落形态、颜色的观察,可初步对纯化的内生真菌和内生细菌进行种属的划分。

表2 丹参种子内生真菌的菌落特征Table 2 Colony characteristics of endophytic fungi from two species of Salvia miltiorrhiza seeds
2.2 内生菌对丹参病原菌的抑菌活性测定
2.2.1 平板对峙法测定内生真菌对丹参病原菌的抑菌作用 采用平板对峙法进行初步筛选,每天观察抑菌情况,发现只有一株内生真菌ZJZD-3对病原菌4和6有较好抑菌效果。将产生抑菌活性的内生真菌ZJZD-3重新与丹参病原菌进行平板对峙,通过测量对照病原菌和处理病原菌的直径,计算内生真菌ZJZD-3的抑菌率。从图1,表4可看出,内生真菌ZJZD-3对两种病原菌均有抑菌效果,其中对病原菌4的抑菌作用较强,抑菌率为41.36%±0.34%,对病原菌6的抑菌作用较弱,抑菌率为34.13%±0.19%,原因主要是两种病原菌产生的毒性物质不同导致抑菌效果有所差异。

图1 内生真菌ZJZD-3对丹参病原菌的抑菌Fig.1 Antimicrobial effects of endophytic fungus ZJZD-3 on pathogenic fungi

表4 内生真菌ZJZD-3对病原菌的抑菌作用(n=3)Table 4 Antimicrobial effects of endophytic fungus ZJZD-3 on pathogenic fungi(n=3)
2.2.2 十字交叉法测定内生真菌对丹参病原菌的抑菌作用 采用十字交叉法测定内生真菌对丹参病原菌的抑菌活性,结果表明,测试的20株内生真菌,同样只有内生真菌ZJZD-3对病原菌4和6具有明显抑菌能力。由图2可知,与对照组相比,丹参病原菌4和6在一定程度上均被抑制,经计算抑制率分别为70.1%和59.6%,抑制率较菌-菌对峙实验提高,暗示着内生真菌ZJZD-3发酵液中含有能抑制病原菌生长的代谢产物,可大大提高丹参病原菌的抑菌效果。

图2 内生真菌ZJZD-3发酵液对丹参病原菌的抑制Fig.2 Antimicrobial effects of endophytic fungus ZJZD-3 fermentation liquid on pathogenic fungi注:a.病原菌4;b.病原菌6;c. ZJZD-3-病原菌4;d. ZJZD-3-病原菌6。
2.2.3 内生细菌对丹参病原菌的抑菌作用 采用滤纸片法,测定分离的11株内生细菌对丹参病原菌的抑菌作用,结果表明,分离的内生细菌对三种病原菌基本无抑菌作用,原因可能是分离的内生细菌不能产生抑制病原菌生长的代谢产物。
2.3 内生菌的抗氧化活性测定
内生菌乙醇粗提液(0.5 mg/mL)的抗氧化能力结果,如表5所示。结果表明,阳性对照VC对DPPH的清除率为96.33%±1.68%;内生真菌中,内生真菌ZJZD-3对DPPH的清除率最高,为91.44%±3.13%,可能含有与宿主相同或相似的抗氧化活性物质;其次是ZJZD-1、ZJZD-5抗氧化能力较强,而ZJBD-1的清除率最低,抗氧化能力最弱。内生细菌中,菌株XJBD-2的清除率最高为86.72%±3.64%;其次为XJBD-1,清除率为85.21%±2.34%。

表5 丹参种子内生菌对DPPH·的清除率Table 5 DPPH· clearance rates of endophytes from Salvia miltiorrhiza seeds
2.4 内生菌的抗凝血活性测定
2.4.1 内生菌对家兔的抗凝血作用 经检测,加入内生细菌发酵液上清的试管血液全部凝集,没有抗凝血能力。内生真菌中,只有内生真菌ZJZD-3具有较强的抗凝血能力。因此,接下来对内生真菌ZJZD-3对家兔凝血时间(CT)、凝血酶时间(TT)、凝血酶原时间(PT)以及活性部分凝血酶时间(APTT)的影响进行深入研究。
2.4.2 内生真菌ZJZD-3对家兔凝血时间(CT)的影响 实验结果发现,没有添加任何抗凝剂的空白对照在357.5 s左右即凝固;阳性对照组样品不凝;内生真菌ZJZD-3发酵液不凝,与阳性对照组效果相同。
2.4.3 内生真菌ZJZD-3对家兔凝血酶时间(TT)的影响 内生真菌ZJZD-3对家兔TT的影响结果见表6。从表中可以看出,空白对照在27.58 s时出现纤维蛋白丝,加入肝素钠的阳性对照样品不凝;加入内生真菌ZJZD-3发酵液对家兔TT有极显著延长作用(P<0.01)。

表6 内生真菌ZJZD-3对家兔TT的影响Table 6 Effect of endophytic fungus ZJZD-3 on thrombin time
2.4.4 内生真菌ZJZD-3对家兔凝血酶原时间(PT)的影响 内生真菌ZJZD-3对家兔PT的影响结果见表7。从表中可以看出,阴性对照在21 s时出现纤维蛋白丝,加入肝素钠的阳性对照样品不凝,加入内生真菌ZJZD-3发酵液对家兔PT没有显著延长作用(P>0.05)。

表7 内生真菌ZJZD-3对家兔PT的影响Table 7 Effect of endophytic fungus ZJZD-3 on prothrombin time
2.4.5 内生真菌ZJZD-3对家兔活性部分凝血酶时间(APTT)的影响 内生真菌ZJZD-3对家兔APTT的影响结果见表8。从表8中可以看出,阴性对照在140.9 s时出现纤维蛋白丝,加入肝素钠的阳性对照样品不凝;加入内生真菌ZJZD-3发酵液可极显著延长家兔APTT(P<0.01)。
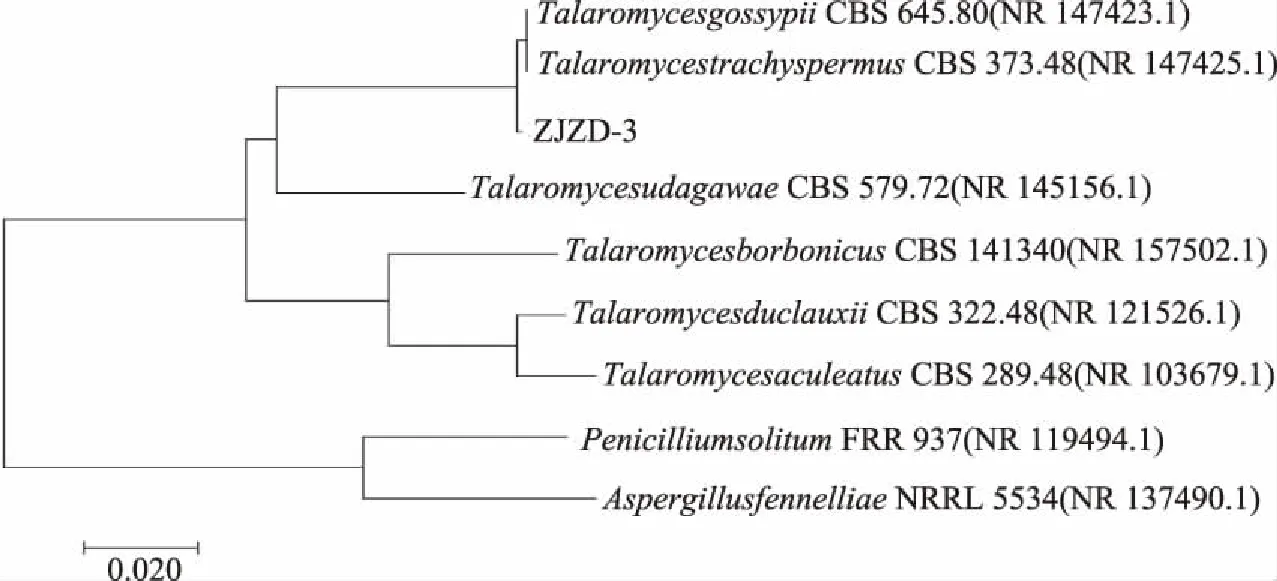
图3 根据rDNA-ITS 序列分析构建的系统发育树Fig.3 Phylogenetic tree of endophytic fungus ZJZD-3 strain

表8 内生真菌ZJZD-3对家兔APTT的影响Table 8 Effect of endophytic fungus ZJZD-3 on activated partial thromboplastin time
2.5 内生真菌ZJZD-3的分子鉴定
将测序的内生真菌ZJZD-3的ITS序列在GenBank数据库中进行Blast比对,选择相似度>97%的序列进行分子系统发育关系分析(图3)。结果发现,内生真菌ZJZD-3与来自GenBank中的Talaromycesgossypii(NR_147423.1)和T.trachyspermus(NR_147425.1)聚在一起形成了一个分支。经过分子鉴定结果并结合形态学鉴定,内生真菌ZJZD-3被确定为篮状菌属。
3 结论与讨论
内生真菌在植物体内普遍存在,但从不同植物体内分离到的内生真菌种类和数量具有很大的差异,主要与取样策略、培养条件以及气候环境等有关[23]。本研究从丹参种子中分离出20株内生真菌和11株内生细菌,分离出的内生真菌和细菌种类较少,今后需进一步改进分离方法提高内生菌的分离率。
本实验从丹参种子中分离出一株具有抗菌、抗氧化、抗凝血活性的内生真菌ZJZD-3,具有与宿主丹参相似的功能,推测ZJZD-3在代谢过程中能产生与宿主相同或相似的成分,这部分工作课题组正在进一步研究。ZJZD-3的抗菌抗氧化检测结果与李艳玲等[15,21]研究结果一致,抗凝血活性与文献[21]研究结果相似。该内生真菌ZJZD-3菌株可以有效地抑制丹参病原菌的生长,利用这一性质,可以对丹参种子的萌发做进一步研究。近年来,微生物对种子萌发的影响已有许多研究报道,何铁柱等[24]研究发现,根际微生物有利于提高白菜种子的发芽率及发芽势;高小宽等[25]研究发现,根际微生物可明显促进种子的萌发,提高种子发芽率和发芽势;李绍锋[26]研究发现豚草种带内生真菌可以促进种子发芽和幼苗生长。因此,课题组今后将进一步研究内生菌对丹参种子萌发的影响以及抗病促生机制,为丹参的优质高产栽培奠定基础。
