羟自由基氧化对鲢鱼肌原纤维蛋白结构的影响
2020-04-02,*
,*
(1.华中农业大学食品科技学院,武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),武汉 430070)
鱼糜制品是我国近几年消费需求增长较快的水产加工品之一,2018年全国鱼糜加工制品总产量达到145.55万吨[1]。一般认为鳕鱼等海水鱼类是生产鱼糜的优良原料,但由于海洋鱼类资源日益匮乏,海水鱼糜的供应逐年减少,淡水鱼糜作为替代品逐渐受到企业的关注。鲢鱼具有养殖量大、生产繁殖快、价格低、凝胶性能较好等特点,目前已成为淡水鱼糜生产的主要原料。
在鱼糜冷冻贮藏过程中,鱼糜中的脂肪易发生氧化反应,产生多种活性氧自由基(例如羟自由基等),这些产物可引起鱼肉蛋白发生氧化[2-3]。一般认为,活性氧自由基可攻击蛋白质的氨基酸侧链和肽链骨架,导致蛋白质分子发生裂解或者交联[4]。蛋白质中的半胱氨酸、酪氨酸、苯丙氨酸等氨基酸残基对活性氧自由基敏感[5-6],蛋白质氧化后其结构发生改变,进而影响蛋白的溶解性、乳化性、保水性和凝胶形成能力等功能特性[6-7]。目前已有学者对鲤鱼、草鱼、银鲳、海鲈鱼等鱼类肌原纤维蛋白的活性氧自由基氧化所引起的结构变化开展了研究[8-11]。鱼类肌原纤维蛋白的性质受鱼种的影响较大,而目前缺乏对活性氧自由基氧化条件下鲢鱼肌原纤维蛋白结构变化规律的认识。为此,本文以鲢鱼肌原纤维蛋白为研究对象,利用芬顿体系产生不同浓度的羟自由基对蛋白进行模拟氧化,研究羟自由基氧化对肌原纤维蛋白结构的影响,以期为鲢鱼糜品质变化提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
鲜活鲢鱼(Hypophthalmichthysmolitrix) 于春季购于华中农业大学农贸市场,体重1.5~2 kg;氯化钠、氯化铁、过氧化氢、磷酸氢二钠、磷酸二氢钠、盐酸、乙二胺四乙酸(EDTA)、2,6-二叔丁基-4-甲基苯酚(BHT)、2,4-二硝基苯肼(DNPH)、三羟甲基氨基甲烷(Tris)、尿素、十二烷基磺酸钠(SDS)、溴酚蓝、考马斯亮蓝R-250、β-巯基乙醇、丙烯酰胺、N,N′-甲叉双丙烯酰胺、过硫酸铵(APS)等 均为分析纯,购于国药集团化学试剂有限公司。
AUY220分析天平、RF-5301荧光分光光度计 日本岛津公司;722型分光光度计 上海舜宇恒平精密科学仪器有限公司;AVANTI J-26高速冷冻离心机 美国贝克曼公司;ZEN3600马尔文激光粒度仪 英国马尔文仪器有限公司;Bio-Rad电泳仪 美国伯乐公司;Nicolet iS10 FTIR傅立叶变换红外光谱仪 Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 参考Lu等[12]方法,并做修改。从新鲜宰杀的白鲢背部采集鱼肉,加入4倍体积的低盐缓冲液(0.05 mol/L NaCl、3.38 mmol/L NaH2PO4、15.5 mmol/L Na2PO4、pH=7.5)混合,在高速均质机中于9000 r/min下均质2 min。在4 ℃下4000 r/min离心10 min,得到沉淀加入4倍体积的低盐缓冲液,重复两次。得到的沉淀加入4倍体积的高盐缓冲液(0.45 mol/L NaCl、3.38 mmol/L NaH2PO4、15.5 mmol/L Na2PO4、pH=7.5),于4 ℃下静置22 h,在4 ℃下12000 r/min离心10 min,将得到的上清液用10倍体积的蒸馏水沉淀30 min,将沉淀后的溶液用冷冻离心机在4 ℃下10000 r/min离心10 min,得到的沉淀即为肌原纤维蛋白,蛋白浓度用福林-酚比色法测定[13]。
1.2.2 羟自由基模拟氧化肌原纤维蛋白 用20 mmol/L的Tris-HCl(含0.6 mol/L NaCl,pH=7.2)将肌原蛋白稀释为10 mg/mL,再用羟自由基产生体系(芬顿体系)(其中FeCl3、抗坏血酸的浓度均为0.1 mmol/L,H2O2浓度为:0、0.1、1、5、10和50 mmol/L)使肌原纤维蛋白氧化。4 ℃下反应24 h,空白对照组不加入H2O2。反应结束后加入0.02%的BHT终止氧化。
1.2.3 肌原纤维蛋白羰基含量的测定 参考Mesquita等[14]的方法,稍作变动。取4 mL肌原纤维蛋白溶液于试管中,向管中加入4 mL 10 mmol/L的DNPH,充分混合,室温下静置10 min,再加入2 mL浓度为6 mol/L的NaOH,于室温环境下静置10 min后,在450 nm波长条件下测定吸光值。以Tris-HCl缓冲溶液作空白对照,用朗伯比尔定律A=Kbc计算羰基含量,其中,消光系数K采用22308 mol-1·L·cm-1,b为吸收层厚度,即比色皿宽度1 cm,c为羰基含量浓度,单位表示为nmol/mg蛋白。
1.2.4 肌原纤维蛋白表面疏水性的测定 根据Chelh等[15]的方法,并加以修改。取5 mL肌原纤维蛋白溶液于离心管中,向其中加入1 mL的溴酚蓝(BPB,1 mg/mL),振荡10 min以充分混合均匀。离心20 min(4000 r/min)后取上清液1 mL,向其中加入9 mL的20 mmol/L Tris-HCl缓冲溶液(包括0.6 mol/L NaCl,pH7.2),混匀后使用可见光分光光度计在595 nm的条件下测定吸光值。空白为未加肌原纤维蛋白溶液的Tris-HCl缓冲溶液。用肌原纤维蛋白与溴酚蓝的结合量来表示表面疏水性指数。计算公式如下:
式中:A空白为空白对照组的吸光值;A样品为样品组的吸光值。
1.2.5 肌原纤维蛋白二聚酪氨酸含量的测定 参考Davies等[16]的方法,采用荧光分光光度计进行检测,参数设定为:发射波长设为420 nm,激发波长设为325 nm,灵敏度为2,狭缝宽度均为5 nm,二聚酪氨酸的含量用相对荧光值(单位A.U)来表示,相对荧光值的计算公式如下:相对荧光值=吸光值/蛋白浓度。
1.2.6 肌原纤维蛋白巯基含量的测定 参考Ellman的方法[17],并做修改。活性巯基含量测定:将肌原纤维蛋白溶液调整为1 mg/mL,向其加入Ellman 试剂(0.1% DTNB,0.02 mol/L Tris-HCl,pH=6.8),肌原纤维蛋白溶液∶Ellman试剂=50∶1(v/v),混合均匀后将其放置于4 ℃下反应1 h,在412 nm波长下的吸光值为活性巯基的吸光度。总巯基含量测定:用0.02 mol/L的Tris-HCl(包括8 mol/L尿素、2% SDS、10 mmol/L EDTA,pH=6.8)将肌原纤维蛋白溶液(2.5 mg/mL)稀释10倍,向其中加入1 mL Ellman试剂,40 ℃反应25 min,于412 nm处测定吸光值。巯基含量均采用朗伯比尔定律A=Kbc来计算。消光系数K为13600 mol-1·L·cm-1,b为吸收层厚度,即比色皿宽度为1 cm,c为巯基含量浓度,单位为nmol/mg蛋白。
1.2.7 肌原纤维蛋白内源荧光的测定 使用荧光分光光度计进行测定,得到发射光谱(310~450 nm)。参数设置为:激发波长280 nm,灵敏度2,狭缝宽度均为2.5 nm[10]。
1.2.8 肌原纤维蛋白粒径分布的测定 参考Shimada等[18]的方法。将1 mg/mL的肌原纤维蛋白溶液通过0.45 μm的醋酸纤维素微孔滤膜除去不溶性的颗粒。所得的溶液采用马尔文激光粒度仪测定其粒径分布。
1.2.9 肌原纤维蛋白SDS-PAGE图谱 参考Yin等[19]的方法,稍作修改。蛋白溶液分别和非还原性(不含β-巯基乙醇)及还原性(含β-巯基乙醇)上样缓冲液体积比为1∶1混合,进样体积为10 μL,浓缩胶浓度为5%,分离胶浓度为12%。
1.2.10 肌原纤维蛋白二级结构的测定 参考Byler等[20]的方法,并做修改,用傅里叶红外光谱测定。扫描参数:光谱范围4000~400 cm-1,分辨率为4 cm-1,扫描累加64次,重复3次。利用OMNIC 8.2数据处理软件对不同氧化程度的肌原纤维蛋白酰胺Ⅰ带进行自动平滑、基线校正、傅里叶自去卷积,再用高斯进行拟合,得到各个峰的峰面积,算出蛋白质的二级结构。
1.2.11 肌原纤维蛋白氨基酸组成分析 参考《食品安全国家标准GB 5009.124-2016 食品中氨基酸的检测》的方法[21]。
1.3 数据处理
除SDS-PAGE外,其他指标均设置三个重复,数据采用“平均值±标准差”表示,采用SAS 9.2分析软件中的ANOVA程序进行显著性分析,差异显著性水平为P<0.05,数据绘图采用Origin 8.5软件。
2 结果与分析
2.1 羟自由基氧化对肌原纤维蛋白羰基含量的影响
蛋白质中的羰基含量一般是反映蛋白质氧化程度重要指标之一。不同浓度的羟自由基对鲢鱼肌原纤维蛋白羰基含量的影响如图1所示。由图1可知,当H2O2浓度在0~10 mmol/L时,随着H2O2浓度的升高,蛋白质羰基含量显著增加(P<0.05),当H2O2浓度达到10 mmol/L时,羰基含量相对于对照组增加了38.6%,这可能是由于羟自由基氧化氨基酸侧链形成羰基,其中当氨基酸侧链含有NH-或NH2-时更易被氧化成羰基[22]。当H2O2浓度达到10 mmol/L时,浓度继续增加,羰基含量增加不显著(P>0.05),可能是由于敏感性氨基酸侧链基本都已被羟自由基氧化暴露。
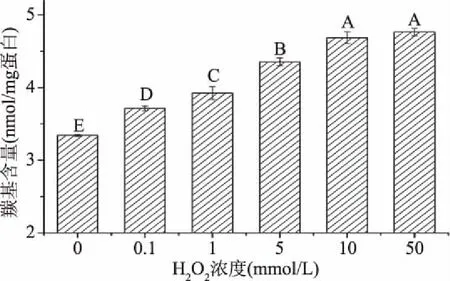
图1 羟自由基氧化对肌原纤维蛋白羰基含量的影响Fig.1 Effect of hydroxyl radical oxidation on carbonyl content of myofibrillar protein注:不同字母表示同一指标组间差异显著(P<0.05)。图2~图4同。
2.2 羟自由基氧化对肌原纤维蛋白表面疏水性的影响
蛋白质的表面疏水性能够反映蛋白表面疏水性氨基酸含量的相对含量,其变化能够间接反映蛋白质的空间结构变化[23]。由图2可知,肌原纤维蛋白表面疏水性随着H2O2浓度的增加而逐渐增加,其中在H2O2浓度在0~1 mmol/L时显著上升(P<0.05),当H2O2浓度为1 mol/L时,蛋白表面疏水性指数从空白对照组的47.66增加至91.28,增加了91.5%。这可能是由于蛋白氧化后,蛋白质分子发生伸展和去折叠,使蛋白质分子内部的芳香族氨基酸等疏水性基团暴露,造成蛋白质表面疏水性增加[24]。当H2O2浓度在1~50 mmol/L时,随着H2O2浓度的增加,相邻两组间表面疏水性指数变化不显著(P>0.05),这可能是由于暴露的疏水性基团进一步被氧化形成亲水性基团,从而使表面疏水性指数降低,另外氨基酸之间的疏水相互作用和氧化所引起的蛋白质分子间的交联可促使蛋白质发生聚集,从而屏蔽去折叠的效应[8,24],进而导致在高浓度H2O2时肌原纤维蛋白表面疏水性指数变化不显著。
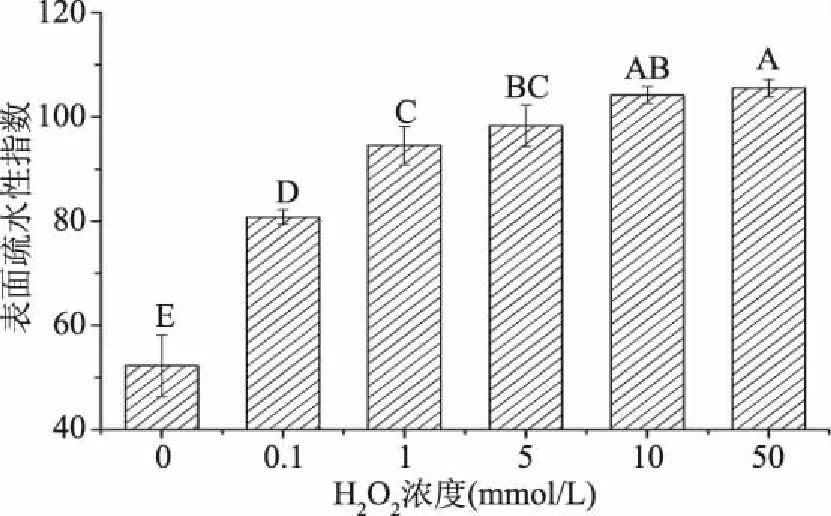
图2 羟自由基氧化对肌原纤维蛋白表面疏水性的影响Fig.2 Effect of hydroxyl radical oxidation on surface hydrophobicity of myofibrillar protein
2.3 羟自由基氧化对肌原纤维蛋白二聚酪氨酸含量的影响
二聚酪氨酸是蛋白质的酪氨酸残基被氧化,通过共价键和非共价键作用形成的蛋白质聚集体,蛋白质中的二聚酪氨酸含量一定程度上能够反映蛋白质的氧化程度[2,4]。由图3可知,H2O2浓度低于10 mmol/L时,随着H2O2浓度的增加,二聚酪氨酸的含量显著增加(P<0.05),说明酪氨酸残基对羟自由基较敏感。陈霞霞等[9]在研究羟自由基模拟氧化银鲳肌原纤维蛋白也有类似结果。当H2O2浓度达到50 mmol/L的时,二聚酪氨酸含量反而显著下降(P<0.05),这可能是因为一方面酪氨酸残基基本被羟自由基氧化完全,另一方面高浓度H2O2可使蛋白质分子发生交联和聚集,导致被埋在蛋白质分子内部的二聚酪氨酸无法被检测出来[4]。

图3 羟自由基氧化对肌原纤维蛋白二聚酪氨酸含量的影响Fig.3 Effect of hydroxyl radical oxidation on di-tyrosine content of myofibrillar protein
2.4 羟自由基氧化对肌原纤维蛋白巯基含量的影响
由于半胱氨酸的巯基基团易被氧化形成二硫键,故巯基含量能够在一定程度反应蛋白氧化程度[4,10]。不同氧化程度的鲢鱼肌原纤维蛋白巯基含量的变化如图4所示。由图4可知,当H2O2浓度达到1 mmol/L时,随着H2O2浓度的继续增加,总巯基含量开始显著下降(P<0.05),当H2O2浓度达到50 mmol/L时总巯基含量由对照组的45.76 nmol/mg下降至35.49 nmol/mg,活性巯基含量整体来说也呈下降趋势,这可能是由于羟自由基氧化半胱氨酸等含硫氨基酸残基,使蛋白质分子内或分子间形成二硫键,另外羟自由基含量过高能够将其进一步氧化成磺酸类或其他产物[25]。在H2O2浓度由0.1 mmol/L增加到1 mmol/L时,活性巯基含量有略微上升,这可能是由于氧化使蛋白质分子展开时,一些内部的巯基基团暴露出来,使得活性巯基增加[26-27],这与前文所述的羟自由基氧化对肌原纤维蛋白表面疏水性的影响(见图2)相一致。
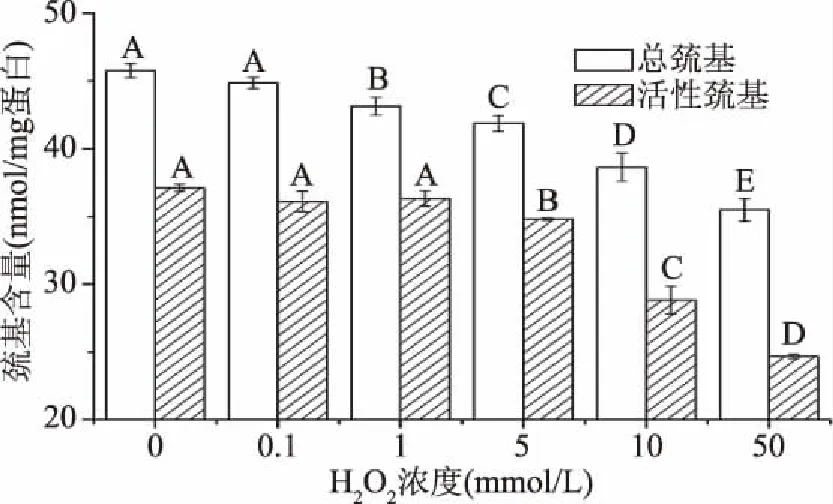
图4 羟自由基氧化对肌原纤维蛋白巯基含量的影响Fig.4 Effects of hydroxyl radical oxidation on sulfhydryl groups content of myofibrillar protein
2.5 羟自由基氧化对肌原纤维蛋白内源荧光的影响
蛋白质中一些生色氨基酸如色氨酸、酪氨酸对羟自由基氧化较为敏感,测定蛋白质的内源荧光强度,可反映出蛋白质分子中色氨酸等荧光基团的氧化程度及其所处环境的情况,进一步评价蛋白质结构和构象的变化[2,4,10]。羟自由基氧化对肌原纤维蛋白内源荧光的影响如图5所示,荧光强度随着H2O2浓度的增大而逐渐降低;其中内源荧光在H2O2浓度0~1 mmol/L和10~50 mmol/L显著下降(P<0.05)。内源荧光在H2O2浓度0~1 mmol/L显著下降(P<0.05),这可能是由于色氨酸等荧光基团对羟自由基敏感,被氧化形成的基团没有或具有较弱的荧光特性。内源荧光在H2O2浓度10~50 mmol/L显著下降(P<0.05),可能是蛋白质氧化聚集导致色氨酸等生色氨基酸残基被包埋[28],另外羟自由基浓度过高会对生色氨基酸产生猝灭作用[29]。
2.6 羟自由基氧化对肌原纤维蛋白粒径分布的影响
粒径分布情况在一定程度上可以反映处肌原纤维蛋白的聚集程度,不同氧化程度的肌原纤维蛋白的粒径分布如图6所示。由图6可知,对照组到达峰顶的粒径为231.3 nm,随着H2O2浓度的增加,肌原纤维蛋白的粒径分布向粒度大方向偏移,且浓度越大,偏移程度越大,当H2O2浓度增至50 mmol/L时,到达峰顶的粒径达到382.3 nm,与对照组相比增加了65.28%。这可能由于氧化导致肌原纤维蛋白发生聚集,使肌原纤维蛋白平均粒径变大。Wang等[25]和Wu等[28]研究发现,羟自由基也能够使蛋清粉和大豆蛋白发生聚集,平均粒径增大,与本文结果一致。

图6 不同氧化程度肌原纤维蛋白的粒径分布Fig.6 Particle size distribution of myofibrillar protein oxidized by hydroxyl radical
2.7 羟自由基氧化对肌原纤维蛋白SDS-PAGE的影响

表1 羟自由基氧化对肌原纤维蛋白二级结构的影响(%)Table 1 Effects of hydroxyl radical oxidation on myofibrillar protein secondary structure(%)
SDS-PAGE电泳图能够反映蛋白质之间的交联、聚集及其降解情况。β-巯基乙醇是一种还原剂,在SDS-PAGE电泳中能够打断二硫键。由图7(a)与图7(b)肌球蛋白重链条带强度差异明显可知,氧化导致蛋白质分子间形成了二硫键,同时图4中总巯基含量比活性巯基下降少也说明氧化形成了二硫键。在非还原性电泳图(图7a)中,当H2O2浓度为5 mmol/L时,肌球蛋白重链条带变浅。这可能是由于羟自由基氧化肌原纤维蛋白并不是首先氧化巯基使分子间形成二硫键,而是氧化蛋白其他基团或者氧化巯基形成分子内二硫键[30]。在加入β-巯基乙醇后(图7b),分离胶顶端聚合物条带和进样孔处电泳条带减弱,而肌球蛋白重链、肌动蛋白、原肌动蛋白条带明显加重,说明氧化使肌原纤维蛋白分子之间交联或聚集,形成了分子量较大且不可溶的聚集体,同时也说明了二硫键是主要的交联的方式。在还原性电泳图中(图7b),分离胶顶端也有少量聚集体,说明还有某些蛋白聚集体的交联方式是其他方式,像Tyr-Tyr、羰基和氨基的共价交联也能形成蛋白聚集体等[31],同时图3中二聚酪氨酸含量的增加也表明了Tyr-Tyr共价交联形成的蛋白聚集体的存在。

图7 不同氧化程度肌原纤维蛋白SDS-PAGE电泳图谱Fig.7 SDS-PAGE patterns of myofibrillar protein oxidized by hydroxyl radical
2.8 羟自由基氧化对肌原纤维蛋白二级结构的影响
蛋白质的二级结构主要是通过骨架上的羰基和酰胺基团之间形成的氢键维持的,氢键是稳定二级结构的主要作用力,其主要由四种构象组成:α-螺旋、β-折叠、β-转角和无规卷曲。通过对蛋白质在红外光谱的吸收变化可以反映出蛋白质的二级结构变化,其中酰胺Ⅰ带(1600~1700 cm-1)是研究蛋白质二级结构最有价值的。在这个波段内,1600~1640 cm-1为β-折叠的吸收波段,1640~1650 cm-1为无规卷曲的吸收波段,1650~1658 cm-1为α-螺旋的吸收波段,1660~1695 cm-1为β-转角的吸收波段[12,32]。
表1是羟自由基氧化对肌原纤维蛋白二级结构的影响,由表1可知,随着H2O2浓度的增加,α-螺旋的相对百分含量先呈下降趋势,当H2O2浓度达到1 mmol/L后变化不再显著(P>0.05);β-折叠的相对百分含量呈先上升后下降的趋势,当H2O2浓度为1 mmol/L时达到最大值;与对照组(H2O2浓度为0 mmol/L)相比,H2O2浓度对β-转角相对百分含量变化的影响不显著(P>0.05);浓度0~10 mmol/L的H2O2对无规卷曲的相对百分含量影响不显著(P>0.05),但与对照组相比,浓度为50 mmol/L的H2O2可使无规卷曲的相对百分含量显著增加(P<0.05)。在低浓度的H2O2(0~1 mmol/L)下,α-螺旋相对百分含量的降低、β-折叠相对百分含量的增加一方面可能是由于氧化导致蛋白分子的伸展、折叠,破坏了α-螺旋的稳定结构,并且形成了β-折叠结构[33]。在H2O2浓度大于1 mmol/L时,β-折叠相对百分含量的降低和无规卷曲相对百分含量的增加,可能是由于高浓度的羟自由基导致肌原纤维蛋白的肽链发生裂解,蛋白结构发生改变,导致稳定的β-折叠向不稳定的无规卷曲转化[32]。
2.9 羟自由基氧化对肌原纤维蛋白氨基酸组成的影响
不同氧化程度的肌原纤维蛋白氨基酸组成如表2所示。H2O2浓度为0、0.1、1、5、10和50 mmol/L时,肌原纤维蛋白氨基酸总含量分别为735.73±11.57、715.26±14.57、707.12±8.96、659.82±3.92、647.68±0.48和644.82±3.37 mg/100 g。随着氧化程度升高,氨基酸总含量呈下降的趋势,其中当H2O2浓度1 mol/L增加至5 mmol/L时,氨基酸总含量发生显著下降(P<0.05);当H2O2浓度高于5 mmol/L,氨基酸总含量下降不显著(P>0.05)。

表2 羟自由基氧化肌原纤维蛋白氨基酸组成的比较Table 2 Comparison of amino acid composition among myofibrillar protein oxidized by hydroxyl radical
由表2可知,从氨基酸组成来看,随着氧化程度的增加,检测出的18种氨基酸含量都出现不同程度的降低,说明氧化过程基本所有氨基酸都会参与反应。精氨酸(Arg)、赖氨酸(Lys)含量会随着氧化程度的提高而降低,Arg和Lys因含有NH2基团易被氧化形成羰基,故Arg和Lys含量的降低与蛋白羰基含量升高相一致(见图1);半胱氨酸(Cys)是一种含有巯基的氨基酸,其含量降低与蛋白巯基含量下降相一致(见图4);酪氨酸(Tyr)含量的降低与二聚酪氨酸含量增加相一致(见图3);色氨酸(Trp)和酪氨酸(Tyr)含量的降低与蛋白内源荧光下降相一致(见图5)。H2O2浓度为50 mmol/L时的丙氨酸(Ala)、半胱氨酸(Cys)、赖氨酸(Lys)和酪氨酸(Tyr)相对于空白对组的减少量为16.96%、20.98%、14.78%和14.01%,用此来表示氨基酸对羟自由基的敏感程度,则敏感程度为Cys>Ala>Lys>Tyr。
3 结论
鲢鱼肌原纤维蛋白经羟自由基氧化后,其结构发生明显改变,并存在明显的量效关系。随着H2O2浓度的增加,蛋白质羰基含量、表面疏水性和蛋白质粒径增加,二聚酪氨酸含量先增加后减少,总巯基含量、活性巯基含量和内源荧光强度下降。SDS-PAGE电泳图谱显示,羟自由基氧化可使蛋白发生交联和聚集,主要以二硫键形式形成高分子量聚集体。氧化可使肌原纤维蛋白二级结构也会发生改变,低浓度氧化剂可促进α-螺旋向β-折叠转化,而高浓度氧化剂则促进β-折叠向无规卷曲转化。羟自由基能够氧化肌原纤维蛋白的绝大部分氨基酸,敏感程度为Cys>Ala>Lys>Tyr。鲢鱼肌原纤维蛋白结构的改变会影响其功能特性,因此在鲢鱼加工和贮藏过程中应采取措施防止肌原纤维蛋白发生氧化,尽量减少由于氧化引起的鱼肉加工性能和营养品质的劣变。
