不同醇沉竹荪多糖组分对青春双歧杆菌体外增殖作用的影响
2020-04-02,*
,*
(1.福建农林大学食品科学学院,福建福州 350002;2.福建林业职业技术学院,福建南平 353000;3.福建省特种淀粉品质科学与加工技术重点实验室,福建福州 350002;4.中爱国际合作食品物质学与结构设计研究中心,福建福州 350002)
竹荪(Dictyophoraindusiata(Vent.Pers.)Fisch.)是一种产于亚洲热带地区的珍稀食、药两用菌,在古代被列为“宫廷贡品”[1]。其含有人体所必需的8种氨基酸,同时富含多糖、蛋白质、脂肪等多种营养成分;其所含的多糖是具有高活性的大分子物质,在抗肿瘤[2]、抗凝血[3]以及免疫调节[4]等方面都有一定的疗效。且竹荪多糖(DPs)是竹荪中的主要活性成分之一,具有很高的开发及利用价值。竹荪中大部分的多糖位于细胞内,因此为将其从含有其他物质的细胞内提取出来,通常需要采用破壁、脱脂、溶剂提取这三个过程。有研究表明,乙醇溶液可分离几乎所有的多糖,其中乙醇浓度对分离产生着重要的影响,浓度过低(沉淀不完全)或者过高(易产生浆状,不易操作)都不利于多糖分级纯化的进行[5]。
益生元通常是由非消化性的食物成分组成,通过选择性地刺激机体内的益生菌生长进而对宿主产生益生作用[6-7]。Bindels等[8]在2015年对益生元的定义进行了修正并最终定义为:非消化性成分,通过肠道微生物代谢调节肠道微生物组成或活力,从而对宿主产生有益的生理影响。根据最新的定义,在明确已有益生元种类的基础上,提出了将抗性淀粉、阿拉伯木聚糖、膳食纤维以及其他非消化性的碳水化合物作为益生元的候选者,进一步扩大了益生元的研究范畴,丰富了益生元的内涵和范畴[9-10]。与此同时,自然界中广泛存在非淀粉类多糖,是植物和真菌细胞壁的主要成分,近年来,有关非淀粉类天然多糖的生物学活性已经被广泛研究和临床应用[11]。然而,有关非淀粉类多糖的益生元功效的报道仍然较少。竹荪多糖是竹荪子实体的结构性物质,其中多糖含量丰富,竹荪多糖由β-葡聚糖、β-半乳葡甘聚糖等组分组成[12-17],目前还未见有关其益生元活性的相关报道。
有研究表明,纤维素、淀粉等大分子量的碳水化物在不同乙醇浓度下的沉淀物具有不同的理化性质[18-21],主要表现在分子量、特定单糖组分含量、表观粘度等方面。耿安静等[22]以香菇精多糖为原料,发现醇沉体积分数和方式对香菇多糖得率和分子质量分布均有较大影响。Xue等[18]以半纤维素进行分级醇沉,结果显示低乙醇浓度的沉淀组分的平均分子量较高,高浓度乙醇沉淀的多为小分子多糖和低聚糖;表明醇沉产物的分子量与乙醇浓度存在相关性。双歧杆菌是能够广泛存在于人和动物肠道内的专性厌氧性细菌,它与宿主的健康状况密切相关[23-24]。随着微生态学的崛起和快速发展,双歧杆菌的各种生物学功能已经被发现并且应用于各个领域。双歧杆菌对营养的要求较高并且生长缓慢[25],如何有效地促进该菌的增殖一直是研究的热点性问题。因此,本文在竹荪多糖分级醇沉的基础上,通过青春双歧杆菌体外增殖试验,评价竹荪多糖及其分级醇沉组分的益生元功效,为丰富益生元的种类提供理论依据。
1 材料与方法
1.1 材料与仪器
长裙竹荪 南平胜利市场采购;竹荪分级醇沉多糖 自行制备;菊粉 比利时Cosucra公司;厌氧培养盒、厌氧产气袋 日本三菱公司;α-淀粉酶、L-半胱氨酸、酵母粉、胰蛋白胨 Sigma有限公司;正丁醇、三氯甲烷、磷酸氢二钠、磷酸二氢钠、无水乙醇、葡萄糖、大豆蛋白胨 国药集团化学试剂有限公司;MgSO4·7H2O、NaOH、NaCl、KOH、NaHCO3、CaCl2、K2HPO4上海化学试剂厂。
XH-300B型超声波-微波组合反应系统 北京祥鹄科技发展有限公司;KQ-300E超声波清洗机 昆山市超声仪器有限公司;FZ102植物粉碎机 天津市泰斯特仪器有限公司;L530型低速离心机 长沙高新技术产业湘仪离心机仪器有限公司;LG-1.0型真空冷冻干燥机 新阳速冻设备制造有限公司;AL104型精密分析天平 梅特勒-托利多仪器(上海)有限公司;RE-5299型旋转蒸发器 上海亚荣生化仪器厂;MC-SHZ113型美的电磁炉 广东美的生活电器制造有限公司;HQ-60型漩涡混匀器 北方同正生物技术发展有限公司;PHS-3C型精密pH计 上海精密科学仪器有限公司;UV-2000型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司;HPX-9000型数显电热培养箱 上海博迅实业有限公司医疗设备厂;手提式SYQ-DSX-280B型压力蒸汽灭菌器 上海申安医疗器械厂。
1.2 实验方法
1.2.1 培养基的配制 活化培养基、无机盐溶液、基础培养基和试验培养基配制参照Lu等[26]的方法进行。
活化培养基:大豆蛋白胨0.5 g,葡萄糖1.0 g,胰蛋白陈0.5 g,酵母粉1.0 g,吐温-80 0.1 mL,L-半胱氨酸盐酸盐0.05 g,无机盐溶液4.0 mL(每1 L包含CaCl20.2 g,K2HPO41.0 g,KH2PO41.0 g,MgSO4·7H2O 0.48 g,NaHCO310.0 g,NaCl 2.0 g)。配制时,混合CaCl2和MgSO4在300 mL去离子水中直到溶解,边搅拌边缓慢加入其它盐类,直到所有盐全部溶解,用去离子水定容至1000 mL,混匀后保存于4 ℃备用),去离子水100 mL,pH=7.0。
基础培养基(强化梭菌培养基):肉汁1.0 g,酵母粉0.3 g,可溶性淀粉0.1 g,NaAc 0.3 g,多粘菌素B 0.002 g,葡萄糖0.5 g,蛋白胨0.5 g,NaCl 0.5 g,L-半胱氨酸盐酸盐0.05 g,去离子水100 mL;pH=6.8±0.2;
试验培养基:以竹荪多糖、菊粉取代基础培养基中的葡萄糖作为碳源配制而成,其他营养成分同基础培养基。
1.2.2 竹荪多糖的提取 干燥过的竹荪子实体用高速粉碎机使其充分粉碎,将其过60目筛后备用。取适量过筛后的竹荪粉末放入250 mL的异型三角瓶内,按照料液比45 mL/g,在微波功率150 W,超声波功率550 W条件下进行提取。提取完毕的料液冷却至室温后,在4000×g转速下离心8 min,分离上清液,沉淀按照相同的条件重复提取2次,合并上清液。真空旋转蒸发(50 ℃)至合并后体积的1/4,浓缩液加入4倍体积的无水乙醇,4 ℃静置12 h后,离心(4500×g,8 min)。分离出沉淀物,经无水乙醇洗涤后,冻干,得到未分级的竹荪多糖样品。
1.2.3 竹荪分级醇沉多糖制备 准确的称取1 g竹荪多糖样品,加入1000 mL去离子水,充分搅拌使其完全溶解后平均分成5等分(每份200 mL),将乙醇体积分数分别调节至20%、40%、50%、60%和80%,振荡混匀,4 ℃条件下静置24 h,分离醇沉产物,通过冷冻干燥得到分级醇沉竹荪多糖,平行重复测定3次,取其平均值。
1.2.4 竹荪多糖抗α-淀粉酶水解测试 10 mg竹荪多糖溶于10 mL 20 mmol/L磷酸盐缓冲(PBS)溶液(pH=7),加入2 U/mLα-淀粉酶,37 ℃下孵育6 h,分别于0、1、2、4、6 h测定还原糖及总糖含量;以抗消化能力较强(含有β(1→2)糖苷键)的益生元菊粉[27]作为阳性对照组,考察竹荪多糖与菊粉的抗水解能力差异。
1.2.5 竹荪多糖抗人工胃液水解能力测试 人工胃液配制[28]:CaCl2·2H2O 0.1 g、Na2HPO48.25 g、MgCl2·6H2O 0.18 g、NaH2PO414.35 g、KCl 0.2 g、NaCl 8 g溶解于1000 mL去离子水中。1 mol/L盐酸调节 pH=2;准确称取10 mg竹荪多糖,加入10 mL人工胃液,37 ℃下孵育6 h,分别于0、1、2、4、6 h测定还原糖及总糖含量,还原糖含量以 DNS法测定,总糖以苯酚-硫酸法[29]测定。还原糖标准曲线:Y=0.7548-0.0015(R2=0.9941),总糖标准曲线:Y=0.0072X-0.0033(R2=0.9984)。

还原糖释放量=(特定时间点测定的还原糖含量-初始还原糖含量)
1.2.6 菌体浓度测定 用离心机以3000×g的转速将培养后的双歧杆菌培养基离心15 min以去除上清液,沉淀的菌体使用去离子水洗涤2次后转移至具塞螺纹试管,往管中加入30 mL去离子水,用螺旋振荡器漩涡振荡液体制成菌体悬液。在两个干燥离心管(m0)分别准确移取10 mL菌悬液,以3000×g离心10 min后除上清液,将于45 ℃烘箱中干燥其中一离心管至恒重(m),空白对照用无菌去离子水于600 nm波长下测定吸光度值。根据测得的菌体浓度和菌悬液吸光度值间相关性绘制菌体标准曲线,菌体标准曲线为Y=0.3431X-0.0014(R2=0.9997)。吸光度值与其菌体浓度之间有良好的线性关系(菌体浓度0~0.30 g/L范围内)。
试验培养基菌体浓度测定:按照上述步骤操作以青春双歧杆菌液体培养基为基础制备菌悬液后于600 nm波长下测定吸光度,通过标准曲线并在标准曲线线性范围内计算菌悬液的菌体浓度。
1.2.7 不同浓度竹荪多糖对青春双歧杆菌增殖的影响 将不加葡萄糖(Glc)的基础培养基分别调整具有抗酸解与酶解的竹荪多糖(DIP)浓度为0.10、0.25、0.50、1.00、2.00、4.00 mg/mL,115 ℃湿热灭菌20 min,取菌种母液以16%的接菌量接种培养基,以菊粉取代Glc作为阳性对照,37 ℃厌氧培养48 h,测定各培养基双歧杆菌 pH和菌悬液浓度,每个处理重复3次操作。
1.2.8 竹荪分级醇沉多糖对青春双歧杆菌增殖的影响 分别以相同浓度(0.5 mg/mL)的竹荪分级醇沉多糖、菊粉取代基础中的(Glc),115 ℃湿热条件下灭菌20 min,取灭菌后的菌种母液以16%的接菌量接种活化培养基,37 ℃厌氧条件下培养20 h后,测定各培养基的双歧杆菌pH和菌悬液浓度,每个处理重复3次操作。
1.2.9 竹荪分级醇沉多糖对青春双歧杆菌生长曲线的影响 以0.5 mg/mL浓度的竹荪多糖取代基础培养基中的Glc作为试验培养基,按照上述条件灭菌后接种于基础培养基和试验培养基。37 ℃厌氧培养60 h,分别于不同时间内取样测定菌体浓度和pH,每个处理重复3次操作。以横坐标作为培养时间,纵坐标作为菌体浓度,绘制菌体生长曲线。
1.3 数据处理
试验数据以DPS 10.0软件进行统计分析,采用OriginPro 9.0绘图。
2 结果与分析
2.1 α-淀粉酶对竹荪分级醇沉多糖水解度的影响
抗α-淀粉酶水解是益生元筛选的先决条件,由图1可得,随着水解时间的延长,竹荪多糖的水解程度在前2 h迅速增加,随后逐渐趋于平缓,20%、40%、50%、60%竹荪多糖分级醇沉组分在2 h后增长速度减缓,80%、未分级醇沉组分和菊粉对照组水解基本达到平衡。在α-淀粉酶溶液中水解竹荪多糖4 h后,20%、40%、50%、60%、80%、未分级醇沉组分水解度分别为9.10%、8.02%、8.88%、11.67%、12.56%、13.91%,对照组菊粉的水解度为13.15%。结果表明20%、40%、50%、60%分级醇沉得竹荪多糖在α-淀粉酶中水解度与对照组菊粉相比差异显著(P<0.05);80%、未分级醇沉所得的竹荪多糖在α-淀粉酶中水解度与对照组菊粉相比无显著差异(P>0.05),说明在抵抗α-淀粉酶的水解时,低浓度乙醇分级醇沉效果好,具有不被消化酶消化且被肠道菌群利用的潜力。人体消化酶包括唾液淀粉酶、胰淀粉酶、α-淀粉酶等对碳水化合物的水解主要在于α-糖苷键。人体上消化道较难消化吸收β-糖苷键连接的碳水化合物,可以到达大肠发挥益生元的功效。菊粉中存在β-1,2糖苷键,有着较好的抗α-淀粉酶水解的效果。本实验结果表明,所有醇沉和非醇沉的竹荪多糖与菊粉一样均能够较好地抵抗α-淀粉酶的水解,因此推断竹荪多糖具有抗消化性的益生元功能。竹荪多糖的部分组分与薄荷多糖类似都由半乳糖、葡萄糖、甘露糖的半乳葡甘聚糖组成[12-13],含有β-半乳糖苷结合位点,进而使含有β-半乳糖苷酶的双歧杆菌能够有效利用[15]。

图1 α-淀粉酶对竹荪多糖分级醇沉组分水解度的影响Fig.1 Effects of α-amylase on hydrolysis of DPs by graded ethanol precipitation
2.2 人工胃液对竹荪分级醇沉多糖水解度的影响
益生元需要在保证不被人体上消化道消化吸收的情况下,同时能抵抗消化酶和胃酸的水解,进而被肠道有益菌所代谢,因此益生元又被称为“结肠食物”[30]。本实验使用模拟胃液考察不同分级醇沉组分竹荪多糖的水解度,进而对竹荪多糖的抗胃酸消化性进行评价,以判断竹荪多糖的益生元潜力。
从图2可知,竹荪多糖在模拟胃液中水解6 h后,20%、40%、50%、60%、80%、未分级醇沉组分水解度分别为17.30%、14.52%、9.61%、8.06%、6.82%和7.90%,对照组菊粉的水解度为5.72%。20%、40%、50%分级醇沉所得的竹荪多糖与对照组菊粉差异显著(P<0.05),60%、80%、未分级组分与对照组相比无显著差异(P>0.05),此外竹荪多糖水解度随着水解时间的延长而增加。在模拟胃液中,竹荪高浓度分级醇沉多糖有较低的水解度,说明在pH=2的酸性条件下竹荪多糖分级醇沉组分稳定性好于菊粉,采用低浓度醇沉出的多糖分子量较高[31],表明高浓度醇沉的较低分子量的竹荪多糖在酸性条件下较难被水解成为单糖和二糖,但未分级的竹荪多糖也较难水解,与80%醇沉多糖具有相似的抗酸水解效果,说明分子量较大的0~20%醇沉组分的抗酸解效果极佳。竹荪多糖的单糖组成、异头物构象、环状结构和连接方式等会对竹荪多糖在酸性条件下的稳定性产生影响,因此上述两者水解能力的差异可能由于结构差别造成[32]。一般食物通过人体的胃部需要4 h,实验结果表明低浓度乙醇分级醇沉及未分级的竹荪多糖经过胃部后依然能够较好保持原结构,随后被肠道益生菌利用。

图2 人工胃液对竹荪多糖醇沉组分水解度的影响Fig.2 Effects of artificial human gastric juice on hydrolysis of DPs by graded ethanol precipitation
2.3 不同浓度竹荪多糖对青春双歧杆菌增殖的影响
由图3可知,随着未分级的DPs添加量的增加,青春双歧杆菌的菌体浓度呈现先增大而后不断减小的趋势;当DPs添加浓度达到0.25 mg/mL后,菌体浓度开始下降,DPs添加浓度达到2.0 mg/mL后,菌体浓度呈直线下降。菊粉对青春双歧杆菌的生长的影响表现为低浓度快速增长,0.5 mg/mL以后缓慢增长,浓度在2.5 mg/mL以上时,DPs对青春双歧杆菌的抑制效果优于菊粉。结果表明当DPs浓度低于0.25 mg/mL时,DPs作为碳源被青春双歧杆菌利用促进菌体生长;当DPs浓度达到0.25 mg/mL后,青春双歧杆菌的菌体浓度虽不再上升,但仍呈较高浓度,此时青春双歧杆菌的增殖情况并未受到抑制;当DPs浓度达到1 mg/mL时,能较好的抑制对青春双歧杆菌的增殖,这可能是由于细菌在高渗透压DPs中产生的脱水作用抑制了菌体的繁殖。
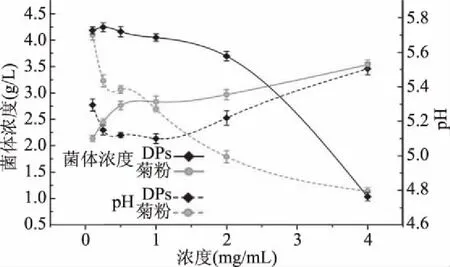
图3 竹荪多糖浓度对青春双歧杆菌生长量及产酸量的影响Fig.3 Effects of DPs concentrations on the growth and acidifying activity of Bifidobacterium adolescentis
图3表明,竹荪多糖浓度对青春双歧杆菌产酸量存在影响,当DPs浓度低于0.25 mg/mL时,pH从5.3降至5.1,说明这一阶段产生大量的有机酸,浓度1.0 mg/mL之前产酸量趋于平稳略微下降而后随DPs浓度增加产酸量减少、pH增加,而菊粉浓度对产酸量的影响是先迅速减少而后趋于缓慢减少。结果表明竹荪多糖乙醇醇沉组分在浓度达到2 mg/mL时,对青春双歧杆菌的增殖效果与产酸量的影响与菊粉相似。竹荪多糖与竹笋多糖都有类似的益生元效应,能够促进青春双歧杆菌增殖。竹荪中的可溶性多糖主要由葡萄糖、半乳糖、木糖等组成,在低酸度环境下青春双歧杆菌的增殖受到抑制[33]。
2.4 竹荪多糖分级醇沉组分对青春双歧杆菌增殖的影响
由图4可知,不同的分级醇沉多糖对菌体增殖效果不同,分级醇沉浓度为20%~60%时,菌体浓度在2.1~2.5 g/L,基本保持平稳,差异性不大;分级醇沉浓度为80%时,菌体浓度为3.4 g/L,之后随分级醇沉浓度增加菌体浓度也增加。分级醇沉浓度达到80%时,青春双歧杆菌体外增殖作用明显,效果优于菊粉;分级醇沉浓度低于80%时,青春双歧杆菌体外增殖效果不明显,增殖效果不如菊粉。不同的分级醇沉片段对pH亦产生直接影响,pH数值范围集中于4.7~5.3之间,醇沉浓度为20%时,培养基pH为5.20;醇沉浓度为40%时,pH为5.10;醇沉浓度为50%,pH为5.25;醇沉浓度为60%,pH为5.11;醇沉浓度为80%,pH为5.11;未分级组pH为4.77;菊粉组pH为4.97。在分级醇沉浓度低于80%,产酸量受到限制,pH保持基本稳定,灵芝多糖也主要由葡萄糖、半乳糖和甘露糖等单糖以β-糖苷键组成,并且在体内、外实验中多糖分子量降低的过程中可促进乙酸、丙酸、异丁酸、戊酸和异戊酸等短链脂肪酸产生,并在此过程并没有游离单糖释放[34]。

图4 竹荪多糖分级醇沉组分对青春双歧杆菌体外增殖的影响Fig.4 Effects of DPs fractions by graded ethanol precipitation on the growth of Bifidobacterium adolescentis注:不同小写字母表示不同碳源下培养基的青春双歧杆菌体浓度或pH差异显著(P<0.05)。
2.5 竹荪多糖分级醇沉片段对青春双歧杆菌生长曲线的影响
由图5可知,高乙醇浓度分级醇沉组分(相同多糖浓度下)更有利于青春双歧杆菌的增殖。青春双歧杆菌经培养6 h后菌体进入对数生长期。培养12 h后,青春双歧杆菌生长达到第一个稳定期,培养18 h后,青春双歧杆菌的生长再次步入生长期,快速增殖。24 h后20%、40%、50%三个分级醇沉组分的青春双歧杆菌生长进入衰退期,48 h后进入第二个稳定期;而60%、80%、未分级、菊粉四个分级醇沉组分24 h后,青春双歧杆菌生长进入稳定期。不同的竹荪多糖分级醇沉组分,青春双歧杆菌生长曲线均为典型的微生物生长曲线,都产生两个生长期和稳定期,充分表明竹荪多糖分级醇沉组分对青春双歧杆菌生长影响的复杂性,分子量较大的竹荪多糖对青春双歧杆菌的增殖作用较快,其中80%醇沉与未分级的多糖组分与菊粉益生元效果相似。

图5 竹荪多糖分级醇沉组分对青春双歧杆菌生长曲线的影响Fig.5 Effects of DPs fractions by graded ethanol precipitation on the growth curve of Bifidobacterium adolescentis
图6显示,随着培养时间的延长,青春双歧杆菌产酸量逐渐增加,pH逐渐降低。不同的竹荪多糖分级醇沉组分对青春双歧杆菌产酸量存在差异,20%、40%、50%三个分级醇沉组分与60%、80%、未分级、菊粉四个分级醇沉组分相比较,pH下降更缓慢,产酸量更少。20%、40%、50%三个分级醇沉组分pH由6.8降至5.5左右,60%、80%、未分级、菊粉四个分级醇沉组分pH由6.8降至4.5。由图7可知,pH随青春双歧杆菌菌体浓度的提高而不断降低,与菌体浓度呈负相关。其原因可能是因为多糖被作为碳源物质被益生菌利用,并促进其产酸,导致pH下降[35]。与本实验结果相似,竹荪多糖多级醇沉可能导致多糖被溶解从而导致更多短链脂肪酸产出,80%醇沉与未分级多糖组分的pH接近菊粉培养基,表明80%醇沉、未分级的多糖组分、菊粉都能促进双歧杆菌生成活性脂肪酸。

图6 竹荪多糖分级醇沉组分对青春双歧杆菌产酸量的影响Fig.6 Effects of DPs fractions by graded ethanol precipitation on acidifying activity of Bifidobacterium adolescentis
3 结论
不同竹荪多糖乙醇醇沉组分对青春双歧杆菌的增殖效果有所不同;分级醇沉浓度达到80%时,青春双歧杆菌体外增殖作用显著,乙醇分级醇沉浓度低于80%,产酸量受到限制,pH保持基本稳定。不同竹荪多糖醇沉组分的增殖效果和抗水解能力随乙醇浓度的增加而不断增强,显示竹荪多糖对青春双歧杆菌有较好的增殖效果。研究不同竹荪多糖乙醇醇沉组分的益生元潜力,为下一步研究多糖的构效关系提供了一定的理论依据,也为简单制备相应不同功效的多糖组分提供了支持,为提高竹荪的产业化价值,具有重要的研究意义。
