益生菌对免疫细胞的影响及其在自身免疫性疾病中的应用
2020-04-01史佳鹭李慧臻闫芬芬关嘉琦焦雯姝霍贵成
史佳鹭,李慧臻,闫芬芬,关嘉琦,焦雯姝,赵 莉,霍贵成
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
益生菌是一类能够定殖宿主肠道并对机体产生有益作用的活性微生物的总称,通过与宿主细胞相互作用,影响肠道菌群组成与结构完整性,从而影响其代谢和免疫[1]。近年来,有很多关于DC细胞、单核细胞(monocytes)、巨噬细胞(macrophages)以及T细胞干预自身免疫性疾病发生和发展的报道,特别是T细胞,但其具体作用机制还不明确[2]。而本文结合最近国内外的研究状况,综述益生菌对免疫细胞的调节作用,以及应用于自身免疫性疾病的进展,旨在为自身免疫性疾病的治疗提供参考。
1 益生菌与免疫细胞
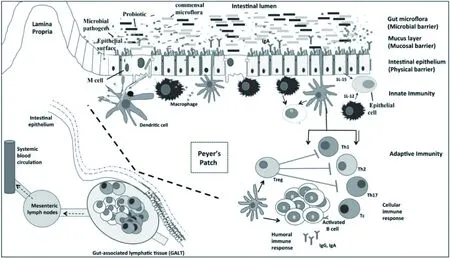
图1 肠道相关淋巴组织与益生菌和肠道微生物群的相互作用Fig.1 Gut associated lymphoid tissue(GALT)and its interaction with probiotics and gut microbiota
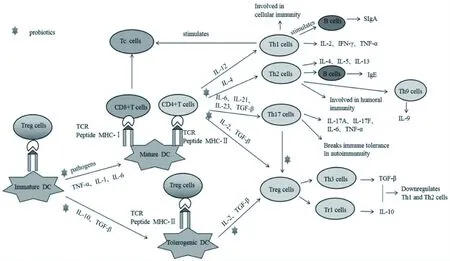
图2 益生菌刺激Th1、Th2、Th17或Treg细胞的免疫调节作用Fig.2 Immunomodulatory effects of probiotics stimulating Th1,Th2,Th17 cells or Treg cells
世界卫生组织(World Health Organization,WHO)将益生菌定义为“一类活的微生物,当有足够量的活菌体到达宿主肠道、定殖从而改变宿主肠道菌落平衡,进而对宿主起着健康效应”[3]。益生菌和肠道微生物共同与肠相关淋巴组织(gut-associated lymphatic tissue,GALT)互作,增强免疫调节能力(图1)[4]。益生菌在人体或小鼠体内刺激先天性免疫系统产生,诱导抗原呈递细胞(antigen-presenting cells,APC)和自然杀伤细胞(natural killer cell,NK)生成。获得性免疫也会由益生菌引起,如双歧杆菌可以诱导免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(immunoglobulin A,IgA)分泌[5]。此外,益生菌还诱导巨噬细胞、CD8+T细胞、调节性T细胞(regulatory cells,Treg)及细胞因子的生成[6]。因此,益生菌可以通过控制免疫反应的“开/关”,在黏膜水平上调节宿主免疫系统,维持机体健康。如果缺乏足够的益生菌刺激免疫系统,会使免疫调节不充分或不适当,从而导致一系列免疫疾病的发生,如炎症性肠病、癌症和自身免疫性疾病。可见,在多种免疫相关疾病中,益生菌可以作为诱导免疫耐受的免疫调节剂。因此,需要进一步了解免疫细胞的免疫学特性以及益生菌对这些免疫细胞的调节作用。
1.1 益生菌与树突细胞
树突细胞(dendritic cells,DC)在适应性免疫应答的起始和调节中起重要作用,是机体内功能最强的APC,其与T细胞相互作用启动机体免疫应答。活化的DC细胞在决定T细胞亚群的激活和分化中起重要作用,通过表达多种炎性细胞因子,趋化因子,共刺激分子和MHC分子,将抗原呈递给T细胞,启动T细胞向Th1或Th2分化(图2)[4,7]。益生菌对DC细胞的表型、细胞因子的释放、分化和成熟以及其抗原提呈能力均有影响,使T细胞不能产生强有效的免疫应答,特别是能够激活肠道中致耐受性DC细胞,从而诱导Treg细胞分化(图2),且益生菌的出现伴随着IL-10水平的升高,共刺激分子(CD80、CD83、CD86)、白介素-12(IL-12)和NF-κB表达的降低[8]。此外,DC细胞还可内吞益生菌,向T细胞呈现抗原多肽,刺激Th1、Th2、Th17和Treg细胞分化(图2)。研究发现,益生菌婴儿双歧杆菌35624和婴儿双歧杆菌14518可以刺激DC细胞成熟和GALT中CD103+DCs的积累,从而诱导CD4+细胞向Treg细胞分化,上调白介素-4(IL-4)、IL-10和TGF-β等抗炎因子表达,改善免疫性疾病相关症状[9-10]。此外,鼠李糖乳杆菌JB-1可以通过DC-SIGN和TLR-2模式识别受体(PRRs)通路的机制,调节DC细胞,降低共刺激分子表达,减少Th1细胞分泌IL-2、TNF-α等促炎因子,抑制炎症反应[11]。
1.2 益生菌与单核细胞
单核细胞是一种血液中体积庞大且来自于骨髓中的造血干细胞的血细胞,其可在外周血中分化为组织巨噬细胞和髓系树突状细胞,并在人体免疫方面发挥重要作用。肠道菌群和摄入的益生菌可参与单核细胞的分化并与巨噬细胞相互作用,从而有利于免疫作用的发挥[12]。CD4+T细胞和NK细胞通过巨噬细胞所分泌的IL-12刺激完成分泌干扰素-γ(interferon-γ,IFN-γ),进而生成促炎Th1细胞,而IFN-γ以反馈调节的方式促进IL-12的分泌。这种循环对人体的免疫作用方面产生的负面影响是很大的,因为它可能导致细胞因子的表达失去控制。近些年,学者们发现益生菌在IFN-γ和IL-12反馈调节通路方面发挥着重要的作用。Donkor等[13]发现,将人外周血单核细胞(PBMCs)与益生菌(嗜酸乳杆菌LAVRI-A1、鼠李糖乳杆菌和双歧杆菌)共培养可提高抗炎细胞因子IL-4、IL-10和TGF-β水平,抑制IL-12和IFN-γ等促炎细胞因子产生,从而提高人体的自身免疫,避免过敏反应的发生。此外,乳源的益生菌如格氏乳杆菌DSM20243 T可以诱导单核细胞产生干扰素-α(interferon-α,IFN-α),并促进NK细胞、巨噬细胞和T细胞的活化[14]。商用益生菌如副干酪乳杆菌DG能够通过促进人单核细胞系THP-1的TNF-α、IL-6、IL-8和CCL20分泌提升人体的免疫刺激特性。而这种作用可能与核因子κB(nuclear factor kappa-B,NF-κB)信号通路表达得下调有关[15]。最新研究显示,嗜热链球菌也可以诱导人单核细胞系U937分泌各种细胞因子,如IL-4和IL-10、TNF-a和IL-6、趋化因子CXCL8和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等。因此,益生菌的使用有利于单核细胞的活化和免疫特性的改善,从而在抑制由于过量致病菌诱导产生的促炎反应方面发挥积极作用。
1.3 益生菌与调节性T细胞
Treg细胞是一类控制体内自身免疫反应性的T细胞亚群,其特征标志为其高表达叉头样转录因子(forkhead box P3,Foxp3),与自身免疫性疾病的发生关系密切。研究证明,婴儿双歧杆菌可以增加PBMCs中IL-10和FoxP3表达[16],且在小鼠试验也发现婴儿双歧杆菌施用导致CD4+CD25+FoxP3+淋巴细胞增加[17]。Giacinto等[18]发现,混合益生菌制剂VSL#3(由8种不同的益生菌组成:嗜酸乳杆菌、德氏乳杆菌、干酪乳杆菌、植物乳杆菌、长双歧杆菌、婴儿长双歧杆菌、短双歧杆菌和嗜热乳链球菌)可以改善结肠炎小鼠病理损伤,提高血清及结肠中IL-10、TGF-β分泌及mRNA表达,进一步揭示益生菌可以通过控制Treg细胞分泌相关因子,导致疾病发生。另一方面,肠道微生物发酵膳食纤维产生的短链脂肪酸(SCFAs),尤其是丁酸盐,具有促进肠道Treg细胞分化的特性,抑制炎症反应[19-20]。Özdemir等[21]发现,结肠炎小鼠补充含有复合益生菌的乳制品(由干酪乳杆菌、乳酸乳球菌、嗜酸乳杆菌、双歧杆菌和乳酸乳球菌组成)后,与安慰剂相比较,实验组小鼠脾细胞中CD4+和CD8+T细胞数量明显降低,而Treg细胞数量增加,其缓解疼痛效果也优于安慰剂组,这种效应被证实是由SCFAs(包括醋酸盐、丙酸盐和丁酸盐)引起。另外也有研究显示丁酸盐诱导转录因子T-bet表达,导致T细胞分泌IFN-γ,而不是刺激Treg细胞分化。因此,丁酸盐可能对黏膜免疫系统产生有益或有害的影响,需要进一步的研究确定丁酸盐的剂量及其诱导Treg细胞的机制。
1.4 益生菌与辅助性Th17细胞
West等[22-23]发现的辅助性Th17细胞,是一种主要分泌细胞因子IL-17的新型CD4+T细胞亚群,它能够分泌产生IL-17、IL-6、IL-22以及TNF-α等促炎因子,其中最重要的效应因子IL-17A具有强大的致炎作用。在炎症性自身免疫病患者和动物模型中均发现IL-17的异常高表达,与其炎症性病理机制密切相关[24]。有研究表明系统性红斑狼疮(SLE)患者外周血单个核细胞在加入IL-17后,分泌IgG和IL-6的水平明显增加,表明SLE患者中IL-17可促进自身反应性B细胞的活化[25]。在益生菌治疗炎症性肠病的研究中发现,婴儿双歧杆菌、短双歧杆菌、长双歧杆菌、嗜酸乳杆菌、加氏乳杆菌A5和嗜热链球菌ST28均可明显减少结肠炎小鼠模型血清中IL-23和TNF-α的分泌,而IL-23对Th17细胞增殖和分化有重要的影响,因此推测益生菌是通过减少IL-23的分泌进而抑制IL-17的产生,抑制炎症。另一方面,研究发现给去卵巢小鼠喂食6周嗜酸乳杆菌能够使Th17细胞趋向Treg细胞表型分化,通过提高Treg细胞数量并抑制Th17细胞的活性维持Treg/Th17平衡,进而减轻炎症反应[26-27]。Th17可被视为一个潜在的抗炎靶点,通过益生菌降低Th17细胞IL-17的表达,以及维持IL-23/IL-17和Treg/Th17平衡,抑制炎症反应。
2 益生菌在自身免疫性疾病的应用
自身免疫性疾病(autoimmune disease,AID)是一类因机体免疫耐受功能受损而致使免疫细胞及其成分对自身组织结构和功能破坏的疾病,包括Ⅰ型糖尿病(type 1 diabetes,T1D)、类风湿性关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、多发性硬化(multiple sclerosis,MS)和溃疡性结肠炎(ulcerative colitis,UC)等[28]。免疫系统的紊乱和失衡是引起自身免疫病发生和发展的主要原因。传统的糖皮质激素和免疫抑制剂虽能够抑制病情,提高患者存活率,但长期使用会造成一系列不良后果[29]。目前大量临床试验、动物模型和体外研究发现,益生菌可以通过多种免疫途径有效治疗自身免疫性疾病[30]。但由于AID发病机制复杂,加上益生菌个体差异、种类和治疗剂量不同甚至益生菌自身生长状态的不同导致益生菌免疫调节能力有所差异。
2.1 Ⅰ型糖尿病
Ⅰ型糖尿病是由胰岛中分泌胰岛素的胰岛β细胞进展性破坏为特点的自身免疫性疾病,是由遗传和环境两者之间复杂的相互作用引起的[31]。根据国际糖尿病联合会统计,全世界每年有79100名15岁以下儿童会患上T1D[32]。目前已经明确,T1D的发生主要以免疫介导为主,多种免疫细胞及其细胞因子参与胰岛β细胞破坏。动物实验表明,Th1/Th2失衡在T1D的发生和发展过程起到关键作用。Th1细胞亚群分泌的细胞因子,如IL-2、IFN-γ、TNF-α、IL-12和GM-CSF等,能够增强炎症反应,介导胰岛细胞损坏,从而导致T1D的发生。而Th2细胞亚群分泌的细胞因子,如IL-4、IL-10等,能够抑制炎症反应,对T1D的发展起到一定的缓解作用[33]。此外,有研究发现T1D患者外周血中可以分泌IL-17的CD4+和CD8+细胞比例增加,且CD4+CD25+Treg细胞数量较对照组明显降低[34]。目前,很多实验已经证明益生菌可以通过调节免疫细胞及其细胞因子,抑制炎症反应,提高抗生素敏感性,进而防止T1D的发生。早在1997年,Matsuzaki等[35]研究发现干酪乳杆菌YIT 9018具有降低血糖水平的功效,能明显改善非肥胖糖尿病(NOD)小鼠相关症状,另外补充干酪乳杆菌YIT 9018能明显降低脾脏CD8+T细胞和全身性炎症性标志物,说明益生菌可能通过降低炎症反应,降低血糖水平,进而阻止T1D的发展。此外,在一项研究中根据乳酸菌促进STC-1细胞分泌胰高血糖素样肽-1(GLP-1)的能力,筛选马乳酒样乳杆菌M和开菲尔乳杆菌K。将两株乳酸菌喂给链脲佐菌素诱导的Ⅰ型糖尿病小鼠,发现糖尿病相关症状得到改善,可能机制包括益生菌刺激GLP-1分泌,抑制促炎因子和炎性细胞因子产生,提高IL-10的产生,改变肠道菌群[36]。NOD小鼠口服乳杆菌后,有效缓解T1D的发展,其机制是益生菌抑制IL-1β表达及降低吲哚胺2,3-双加氧酶的释放,且促进肠道中CD103+致耐受性树突细胞的分化[37]。再次揭示了益生菌具有治疗Ⅰ型糖尿病的潜在功能,但具体机制仍需更深入的试验验证。
2.2 类风湿性关节炎
类风湿性关节炎是一种以关节病变为主的慢性全身自身免疫性疾病,其中自身抗体主要以类风湿因子和抗环瓜氨酸肽抗体(anticitrullinated protein antibody,ACPA)为代表[38]。其特征是关节肿胀疼痛,继而畸形残疾[39],且伴随内脏损伤,如肺、心脏和肾脏等。根据WHO统计,RA患病率为0.3%和1%,是最常见的自身免疫性疾病之一[40]。目前研究均认为,RA是由遗传因素和环境因素共同作用而致病。环境因素中,免疫细胞失衡导致的免疫异常已被证实参与RA的发生与发展[41],其中包括T、B淋巴细胞、巨噬细胞、中性粒细胞等[42],且Th1、Th2和Th17细胞的比例失衡及细胞因子IL-1、IL-2、IL-17、IFN-γ和TNF-a等产生的免疫损害,是导致RA慢性炎症的关键因素。此外,核因子-κB(nuclear factor of kappa B,NF-κB)与RA致病及关节损害等也密切相关[43]。大量研究发现,益生菌作为一种外界环境因素,可以降低炎性应答的趋势,表明益生菌可能对缓解RA具有一定的作用。Hatakka等[44]发现给RA患者服用鼠李糖乳杆菌(LGG)后,关节触痛和肿胀均数由8.3降至4.6,疾病评分减少了71%,风湿病发作率降低,使受试者产生主观幸福感。Vaghefmehrabany等[45]研究发现,与安慰剂组相比较,服用8周瑞士乳杆菌的RA患者疾病活动度下降,超敏C-反应蛋白(high-sensitivity C-reactive protein,hs-CRP)水平降低,且血清中TNF-a、IL-6和IL-12等促炎因子水平明显降低,调节性细胞因子IL-10明显升高,益生菌组未发现任何副作用。进一步表明益生菌通过控制免疫细胞平衡,调节细胞因子分泌,抑制炎症反应,进而干预RA的发展。在动物试验中也发现,口服凝结芽孢杆菌具有抗炎作用,明显降低了RA大鼠模型中血清淀粉样蛋白A(serum amyloid A protein,SAA)、TNF-a和纤维蛋白原的产生,从而改善RA大鼠关节炎病情水平[46]。但在一些评估益生菌治疗RA效果的研究中并未得到显著功效。在一项双盲安慰剂对照临床试验中,27名RA患者服用鼠李糖乳杆菌和罗伊氏乳杆菌3个月,结果表明,治疗组与对照组在关节炎病情缓解指数ACR20评分方面的差异无显著意义[47]。
2.3 系统性红斑狼疮
系统性红斑狼疮是一种累及多系统、多器官并有多种自身抗体出现的自身免疫性疾病,由于体内有大量致病性自身抗体和免疫复合物而造成组织损伤[48]。SLE的发病机制非常复杂,尚不清楚,但大量研究证实,SLE患者循环中T淋巴细胞失调,是SLE的特征之一,其严重程度与疾病活动性相关[49]。进一步的研究发现T细胞失调是由APC功能缺陷所致,而DC是机体内功能最强的APC,所以DC的功能缺陷是导致T细胞功能缺陷的主要原因[50]。此外,SLE患者中细胞因子IL-1、IL-6、TNF-α、IFN-γ、IL-4和IL-10等的异常表达,进一步揭示了免疫细胞及细胞因子介导SLE发生[51]。Esmaeili等[52]在一项体外研究中发现鼠李糖乳杆菌和德氏乳杆菌可以调节SLE患者中DC细胞产生,后者诱导Treg细胞增殖分化,分泌IL-10、TGF-β等细胞因子,参与免疫调节,从而降低炎症反应。Hsu等[53]评估了副干酪乳杆菌GMNL-32、罗伊氏乳杆菌GMNL-89和罗伊氏乳杆菌GMNL-263对系统性红斑狼疮动物模型干预效果,发现这些乳酸杆菌可以缓解SLE相关症状,可能机制是通过抑制NF-κB通路以及细胞外信号调节的激酶致炎通路,进而降低TNF-a、IL-1β表达,提高抗炎细胞因子IL-10表达,减轻炎症。Fatemeh等[54]对降植烷诱导前的小鼠进行口服2个月的益生菌(鼠李糖乳杆菌和德氏乳杆菌)处理,持续至实验结束,结果发现益生菌能够明显抑制SLE的发病率;另外,用鼠李糖乳杆菌和德氏乳杆菌治疗降植烷正在诱导的小鼠实验中,发现可以延迟疾病的发生。其机制是通过抑制Th1和Th17极化,同时诱导IL-10生成,降低IL-17和IFN-γ数量。进一步证明益生菌在治疗SLE中的免疫调节作用。然而,目前在clinicaltrials.gov中尚未有关于益生菌治疗SLE患者的临床试验。益生菌用于SLE研究和防治的机制还相对不够深入,还有待进一步探索。
2.4 多发性硬化症
多发性硬化症是引起中枢神经系统(central nervous system,CNS)炎性脱髓鞘的自身免疫疾病,以多发病灶、缓解、复发病程为特点[55]。研究发现,MS主要由CD4+T细胞介导发生,MS患者在活动期时外周血中CD4+CD25 high T细胞数量比正常组减少,且CD4+CD25+T细胞的FOXP3 mRNA表达降低[56]。此外,最新研究显示,分泌IFN-γ的Th-1和分泌IL-17的Th-17的两个CD4+T细胞亚群失调,是MS及其实验动物模型EAE(experimental autoimmune encephalomy-elitis,实验性变态反应性脑脊髓炎)的主要病因[57],且MS患者Treg细胞功能的受损可能也与疾病发展有重要关系[58]。而益生菌作为自身免疫调节剂,可有效缓解MS相关症状。大量研究发现,乳酸杆菌、乳酸片球菌、双歧杆菌和脆弱拟杆菌等通过促进IL-10及TGF-β的分泌,诱导肠道粘膜中Treg细胞分化,且降低Th1/Th17细胞分化,从而改善CNS炎症反应[59-60]。在一项临床试验中,给予9名MS患者益生菌(乳酸菌和双歧杆菌)8周干预后,能够显著改善患者精神状态、痉挛和视力等相关症状。进一步研究发现,与正常组相比,干预组患者中艾克曼菌属和劳特氏菌属的丰度下降,乳酸菌和双歧杆菌丰度增加,炎症单核细胞数量减少,MHC-II和共刺激分子CD80表达降低,表明通过调节患者肠道菌群和肠道炎症水平等作用来恢复肠道正常,进而干预MS的发病[61]。在另一项随机双盲安慰剂对照临床试验中,60名MS患者服用12周益生菌(包括嗜酸乳杆菌、干酪乳杆菌、发酵乳杆菌和双歧杆菌)后,扩展残疾状况评分(expanded disability status scale,EDSS)和炎症标志物明显降低[62]。在动物试验中,轻度EAE小鼠口服肠产毒素大肠杆菌的“疫苗”后可以完全恢复,组织病理学显示脊髓灰质和白质炎性浸润减少,IFN-γ分泌降低,IL-4、IL-10、IL-13和TGF-β抗炎因子分泌增加,说明益生菌通过调节多种炎症因子来缓解EAE症状[63-64]。此外,Ochoarepáraz等[65-66]研究发现,脆弱拟杆菌可以产生一种双性离子型多聚糖(PSA),对EAE小鼠给予脆弱乳杆菌或PSA干预后,发现FoxP3+调节性T细胞、CD103+树突细胞以及CD39+CD4调节性T细胞数量增加,调节细胞因子IL-10数量也增加,但Th17细胞数量降低,说明脆弱类拟杆菌缺乏时,其代谢产物PSA含量减少,引起全身免疫调节作用下调。进一步证明了益生菌可以调节免疫细胞和细胞因子,参与机体肠道及系统免疫调节,改善患者相关症状。
3 结论
肠道菌群-宿主之间相互作用的研究越来越深入,为益生菌在治疗自身免疫性疾病提供了新的途径。无论临床研究或动物模型,益生菌在改善自身免疫性疾病中都展现出良好的干预效果。益生菌影响机体健康是多方面的,目前证据证实摄入的益生菌与肠道菌群相互协调,并通过与GALT相互作用,调节免疫细胞分化及其相关细胞因子分泌,减少炎症反应,从而改善自身免疫性疾病。由于自身免疫性疾病发病机制复杂,加上菌株特异性及患者病理状态不同,益生菌在治疗效果上有所差异。虽然大量试验表明益生菌具有免疫调节作用,但其治疗自身免疫性疾病的机制还不够完善,在临床应用上还未形成规模,仍需大量深入研究为益生菌的有益效果提供合理详细的证据。
