壳寡糖复合固体饮料对2型糖尿病小鼠糖脂代谢紊乱的调节作用分析
2020-04-01,2
,2
(1.天津科技大学,生物工程学院,工业发酵微生物教育部重点实验室 暨天津市工业微生物重点实验室,天津 300457;2.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457;3.仲恺农业工程学院,动物科技学院,广东广州 510225;4.广州优蓝海洋生物科技有限公司,广东广州 510530)
糖尿病(diabetes mellitus,DM)是一类以高血糖为特征的代谢紊乱综合症。临床上将其分为2种类型[1],分别为胰岛素依赖性的1型糖尿病以及非胰岛素依赖性的2型糖尿病。1型糖尿病是由于先天或后天胰岛素分泌缺陷引起的,多发于青少年;2型糖尿病(Type 2 diabetes,T2DM)主要因为胰岛素分泌不足或胰岛素代谢失效[2]所引起的,常伴随如神经性病变、肾病、心脑血管疾病等[3-4]多种慢性并发症发生,患者年龄层较高,常见于中年或老年人,并且总糖尿病患者中有90%左右是2型糖尿病患者。作为糖尿病患者大国,我国在糖尿病的防治方面面临着巨大的挑战。
传统的抗2型糖尿病策略主要是药物治疗结合饮食及运动调节。目前,二甲双胍、格列本脲、阿卡波糖等为临床上常见的口服抗糖尿病药物。然而,这些可用的抗糖尿病药物尚存在一些可能导致器官损伤或胃肠道功能障碍等不良反应。因此,寻找天然的,特别是食品源的降血糖活性物质,开发新的降血糖功能食品依然是大健康研究领域的重要热点之一[5]。
近些年,从动植物等天然食品资源中陆续发现了壳寡糖、水苏糖、燕麦β-葡聚糖等具有改善糖尿病功效的食源性功能糖类[6-8],其中,壳寡糖是N-乙酰氨基葡萄糖(GlcNAc)和氨基葡萄糖(GlcN)以β-1,4糖苷键连接、聚合度为2~10的寡聚物,是自然界中存在的由壳聚糖水解产生的碱性寡糖。其具有抗氧化、抗炎、降胆固醇、调节免疫和抗肿瘤等多种特性[9-13],而且目前已被批准为新食品原料。另外,研究发现来源于白芸豆的α-淀粉酶抑制剂作为一种植物来源的天然物质,具有明显降低餐后血糖的功效[14-15]。在前期研究中,依照现代药学理论,经过优化配方,开发了以壳寡糖、水苏糖、燕麦β-葡聚糖、白芸豆提取物等为主要原料的新型“壳糖平”复合固体饮料。在此基础上,本研究利用T2DM小鼠模型,就壳糖平对糖尿病糖脂代谢紊乱的影响作用,展开较为系统的分析,为其合理应用及保健食品申报奠定了基础。
1 材料与方法
1.1 材料与仪器
壳糖平及壳寡糖 广州优蓝海洋生物科技有限公司;昆明小鼠 健康雄性清洁级,4周龄(体重18~22 g),生产许可证:SCXK(军)2007-004,合格证号:00549571;高脂饲料和基础饲料 中国人民解放军军事医学科学院实验动物中心;阿卡波糖片(Acar) 杭州中美华东制药有限公司;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷草转氨酶试剂盒(AST)、谷丙转氨酶(ALT)试剂盒 南京建成生物工程研究所。
SpectraMax id3酶标仪 美谷分子仪器有限公司;TGL-16C型台式离心机 上海安亭科学仪器厂;96孔实时定量PCR仪 美国ABI公司;正置荧光显微镜 日本Olympus。
1.2 实验方法
1.2.1 实验分组和2型糖尿病小鼠模型的建立 健康雄性SPF昆明小鼠70只(4周龄,(20±2) g)。按照体重随机分组分为7组,每组10只,分组和饲喂剂量为:正常对照组(NFD)、模型组(T2DM+PBS)、阳性对照阿卡波糖(50 mg/kg)组(T2DM+Acar)、壳寡糖(80 mg/kg)组(T2DM+COS)、壳糖平低剂量(40 mg/kg)组(T2DM+LKTP)、壳糖平中剂量(80 mg/kg)组(T2DM+MKTP)、壳糖平高剂量(120 mg/kg)组(T2DM+HKTP)。以基础饲料适应性喂养小鼠一周后,T2DM、T2DM+Acar、T2DM+COS、T2DM+LKTP、T2DM+MKTP和T2DM+HKTP组小鼠禁食不禁水12 h并称量体重,采用65 mg/kg 链脲佐菌素(STZ)连续3 d进行腹腔注射,造模期间饲喂高脂饲料。注射药物5 d后,小鼠尾静脉取血,测定小鼠的血糖;空腹血糖水平≥7.0 mmol/L,餐后2 h血糖水平≥11.1 mmol/L为造模成功[16-17],从第3周后开始连续灌胃4周,灌胃期间正常对照组小鼠饲喂基础饲料,其它组小鼠饲喂高脂饲料。
1.2.2 小鼠血液样品及器官的处理与保存 实验结束后,小鼠禁食不禁水12 h并称量体重,采取摘眼球法活体取血,取血完毕后采用断颈法处死小鼠。将血液放室温平衡10 min,3000 r/min离心10 min,取上清,-20 ℃保存,对小鼠进行解剖,摘取小鼠的肝脏和心脏,用无菌生理盐水冲洗后吸干水分后快速称重,计算肝脏和心脏指数。参考文献方法[18],其计算公式为:脏器指数(%)=脏器重量/体重×100;同时将摘取的小鼠肝脏、心脏、升结肠、横结肠、肾脏组织分装于对应的离心管中,其中脏器组织的一部分迅速至于液氮罐中冷却,保存于超低温(-80 ℃)冰箱中。取脏器组织块少量置于含福尔马林溶液的离心管中,常温保存备用。
1.2.3 小鼠血糖和血清各指标的检测 从第2周开始直到实验结束,期间每周均对小鼠空腹血糖进行测定。将1.2.2收集的小鼠血清用酶标仪进行TC、TG、HDL-C、LDL-C、AST、ALT含量的测定。根据公式计算动脉粥样硬化指数:AI=(TC-HDL-C)/HDL-C。
1.2.4 肝脏组织和肾脏组织苏木精-伊红(hematoxylin-eosin staining,简称HE染色)染色 对存放在固定液中的组织块进行前处理,然后石蜡包埋并切片,随后进行HE染色,通过正置显微镜观察并获取照片。

表1 实时定量检测所设计引物序列Table 1 Primer design for real-time PCR
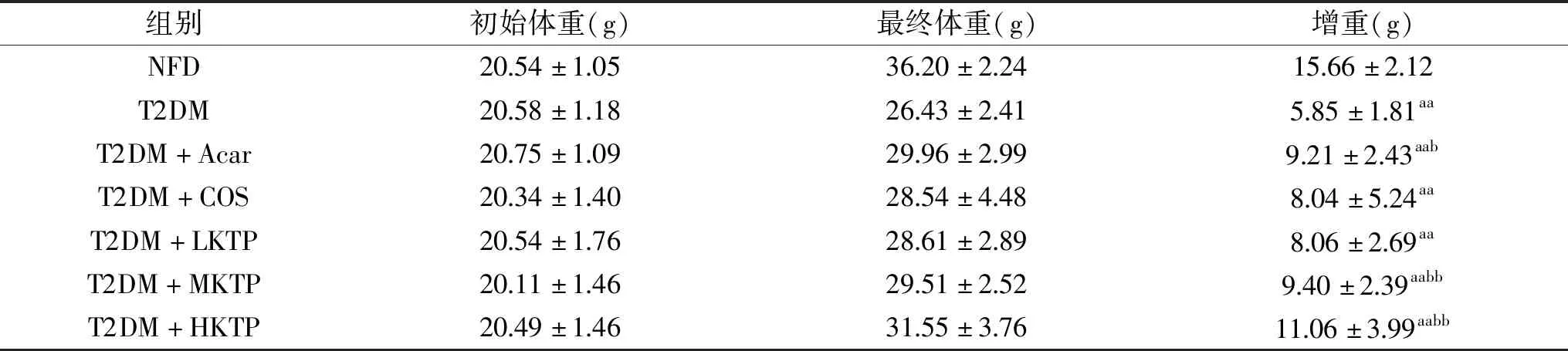
表2 各组小鼠实验前后体重变化(M±SD,n=10)Table 2 Changes in body weight of mice before and after intervention(M±SD,n=10)
注:a表示与NFD组比较差异显著(P<0.05),aa表示与NFD组比较差异极显著(P<0.01);b表示与T2DM组比较差异显著(P<0.05),bb表示与T2DM组比较差异极显著(P<0.01);c表示与T2DM+Acar组比较差异显著(P<0.05),cc表示与T2DM+Acar组比较差异极显著(P<0.01);表3~表5同。
1.2.5 肝脏mRNA提取和检测 将1.2.3保存的小鼠肝脏提取总RNA并逆转录成cDNA,使用表1设计的引物以SYBR Green PCR试剂检测各目的基因的mRNA水平,以β-肌动蛋白为参照并通过2-ΔΔct方法计算结果。
1.2.6 蛋白质印迹分析 用蛋白质裂解缓冲液在冰上裂解肝脏组织30 min。使用8%~12% SDS-PAGE凝胶电泳分离蛋白质并通过电印迹法转移到NC膜(nitrocellulose filter membrane),将膜置于含相应一抗(Rabbit monoclonal to HMGCR、PEPCK Monoclonal Antibody)溶液中4 ℃过夜孵育,再用相应的二抗(Goat anti-Rabbit、Goat anti-Mouse)抗体作用膜。通过红外成像系统使目的蛋白成像可视。
1.3 数据分析
数据采用软件SPSS 17.0进行统计学分析。实验结果表示为平均值±标准偏差(M±SD)。P<0.05时,表示与比较组存在显著差异,P<0.01表示与比较组差异极显著。
2 结果与分析
2.1 壳糖平对T2DM小鼠体重的影响
由表2可以看出,与对照组相比,其余各组小鼠体重显著降低(P<0.05),说明糖尿病小鼠“三多一少”中体重减少明显,符合糖尿病发病特征。与T2DM模型组比,壳糖平组以剂量依赖方式显著减缓小鼠体重降低(P<0.05)。该结果表明壳糖平能够减缓T2DM小鼠体重减轻的症状。
2.2 壳糖平对T2DM小鼠脏器指数的影响
由表3可以看出,与对照组(NFD)小鼠相比,其余各组小鼠肝脏指数和心脏指数显著增大(P<0.05),脏器指数能够反应脏器的健康状况[19],2型糖尿病联合高脂饮食会使得小鼠器脏发生脂质堆积及发生病变,继而使得脏器指数增大。与模型组(T2DM)相比,壳糖平组以剂量依赖方式显著降低T2DM小鼠肝脏和心脏指数(P<0.05)。该结果表明壳糖平能够显著逆转T2DM小鼠脏器脂质堆积(P<0.05)和病变。
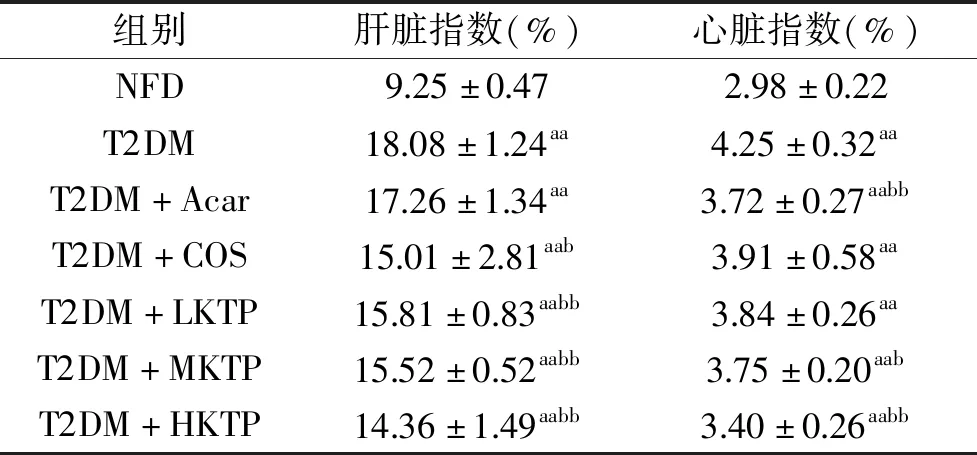
表3 壳糖平对T2DM小鼠脏器指数的影响(M±SD,n=10)Table3 Effect of Ke Tang Ping on organ index in T2DM mice(M±SD,n=10)
2.3 壳糖平对T2DM小鼠血糖及血脂指标的影响
由图1可以看出,与对照组(NFD)小鼠相比,其余各组小鼠血糖显著升高(P<0.05),说明T2DM模型小鼠成功建立。与模型组(T2DM)相比,壳糖平组以剂量依赖方式显著降低T2DM小鼠血糖(P<0.05),并且随实验时间延长稳步下降。

表4 壳糖平对T2DM小鼠血清TC、TG、HDL-C和LDL-C的含量的影响(M±SD,n=10)Table 4 Effect of Ke Tang Ping on serum TC,TG,HDL-C and LDL-C levels in T2DM mice(M±SD,n=10)
究其原因,可能是壳糖平的主要组成原料壳寡糖、水苏糖不能或难以被肠道消化酶水解,所以在小肠中不能被吸收,因此不会影响血糖水平和机体内胰岛素的正常功能,而这些低聚糖可被肠道菌吸收利用,并且β-葡聚糖是水溶性膳食纤维,可以促进肠道有益菌群的生长与定殖,进而发挥调节机体血糖水平作用[8,20];另外,白芸豆提取物中α-淀粉酶抑制剂可快速消化吸收淀粉类食物,也能够发挥控制血糖的作用[21-22]。
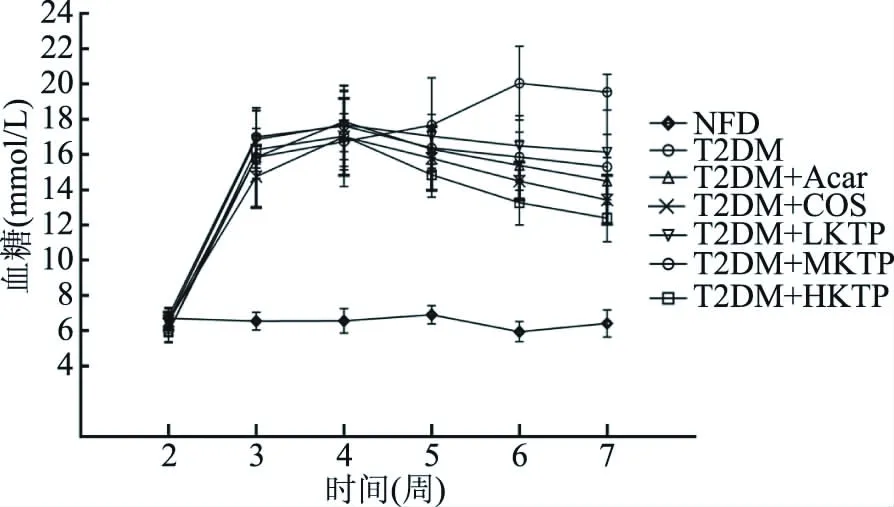
图1 壳糖平摄入4周对T2DM小鼠空腹血糖的影响(n=10)Fig.1 Effects of Ke Tang Ping on fasting blood glucose levels of the T2DM mice treated for four weeks(n=10)
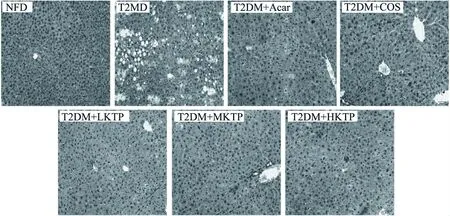
图2 各实验组小鼠肝脏病理切片的观察(20×)Fig.2 Pathological examination of liver tissue from experiment mice(20×)
Liu等[23]研究表明T2DM的异常血糖水平往往伴随着血脂水平的紊乱;由表4可知,与NFD组相比,T2DM组小鼠的TG、TC、LDL-C极显著上升,而HDL-C极显著下降(P<0.01),表明小鼠血清脂质水平发生改变,二型糖尿病小鼠模型造模成功。与T2DM模型组相比,壳糖平组能够显著降低T2DM小鼠血清中TG、TC、LDL-C水平,而提高HDL-C水平(P<0.05);说明壳糖平在调节T2DM小鼠脂质代谢紊乱方面发挥作用。
并且,与T2DM组相比,壳糖平组可显著降低AI值(P<0.05),表明壳糖平可能会辅助减少动脉粥样硬化相关疾病的发生概率。
2.4 壳糖平对T2DM小鼠血清AST、ALT的含量的影响
由表5可知,与对照组(NFD)小鼠相比,其余各组小鼠血清AST、ALT水平指数极显著增大(P<0.01);T2DM小鼠糖代谢障碍,导致脂肪在肝脏中蓄积,引起脂肪肝,造成肝损伤[19];与T2DM组相比,壳糖平组以剂量依赖方式显著降低血清AST、ALT水平(P<0.05);说明壳糖平能够显著恢复T2DM小鼠肝损伤。
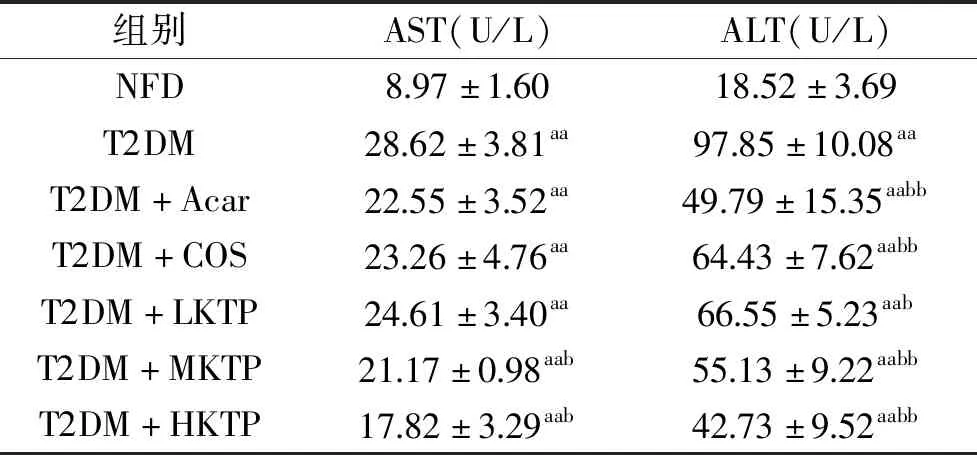
表5 壳糖平对T2DM小鼠血清AST、ALT的含量的影响(M±SD,n=10)Table 5 Effect of Ke Tang Ping on AST and ALT in T2DM mice(M±SD,n=10)
2.5 壳糖平对T2DM小鼠肝和肾组织的影响

图3 各实验组小鼠肾脏病理切片的观察(20×)Fig.3 Pathological examination of kidney tissue from experiment mice(20×)
小鼠肝和肾组织HE染色结果如图2所示,NFD组小鼠肝细胞形态、大小正常、核膜核仁清楚、核圆居中、肝小叶结构正常,肝板之间分界明显,肝窦清晰可见;T2DM模型组小鼠肝组织结构出现病理变化,如肝窦受压变窄甚至消失、肝细胞大小不一,核膜核仁模糊、肝索排列无序,肝纤维化和脂肪变性严重。同样的,如图3所示,与NFD组小鼠肾切片相比较,模型组(T2DM)小鼠肾小球体积增大,细胞数增多,肾小球毛细血管扩张,出现空泡变性。而壳糖平各组肝脏和肾脏脂肪变性症状及纤维化得到一定程度的恢复。该结果说明壳糖平具有良好保护肝脏和肾脏、缓解糖尿病的作用。
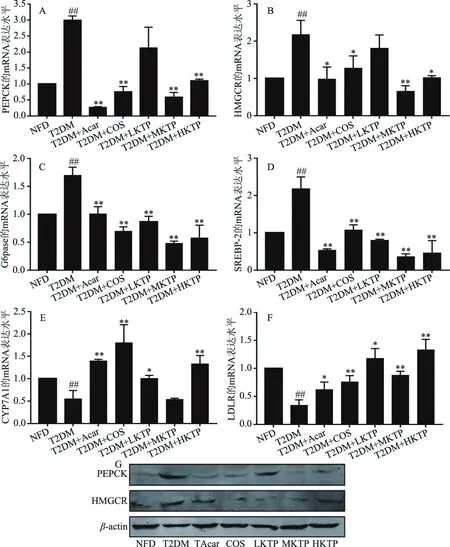
图4 壳糖平调节葡萄糖代谢中关键基因mRNA水平和蛋白水平Fig.4 The level of key genes’ mRNA and protein in glucose metabolism regulated by Ke Tang Ping注:(A)PEPCK mRNA水平;(B)HMGCR mRNA水平;(C)G6pase mRNA水平;(D)SREBP-2 mRNA水平;(E)CYP7A1 mRNA水平;(F)LDLR mRNA水平;(G)PEPCK、HMGCR蛋白水平。#表示与NFD组比较差异显著(P<0.05),##表示与NFD组比较差异极显著(P<0.01);*表示与T2DM组比较差异显著(P<0.05),**表示与T2DM组比较差异极显著(P<0.01),n=8。
2.6 壳糖平对T2DM小鼠肝组织mRNA水平和蛋白水平的脂质代谢影响
研究已发现,糖尿病中的肝胰岛素抵抗与过量葡萄糖输出,糖异生相关基因表达升高和糖原合成减少有关[24]。PEPCK是糖异生中的限速酶,而G6Pase在糖原分解的关键基因,肝脏G6Pase和PEPCK的表达增加与T2DM中肝糖原代谢受损有关[25-26]。此外,HMGCR是胆固醇合成的限速酶,而CYP7A1是一种参与胆固醇合成的酶,LDLR和SREBP-2基因是脂类物质代谢的关键转录因子。在本研究中,为了探讨壳糖平对T2DM诱导的异常葡萄糖代谢的潜在机制,从mRNA和蛋白水平对小鼠肝脏组织中PEPCK、G6Pase、HMGCR、SREBP-2、CYP7A1、LDLR基因的变化情况进行了检测。结果显示(图4):与正常组(NFD)相比,模型组(T2DM)小鼠PEPCK、G6Pase、HMGCR、SREBP-2基因极显著上调(P<0.01),CYP7A1和LDLR极显著下调(P<0.01),说明T2DM组小鼠葡萄糖代谢紊乱同时伴随着胆固醇代谢异常,因此PEPCK、G6Pase、HMGCR、SREBP-2基因表达被异常激活,而LDLR和CYP7A1基因表达被抑制。与T2DM组相比,壳糖平干预可降低PEPCK、G6Pase、HMGCR、SREBP-2基因表达,而上调LDLR和CYP7A1基因表达。这些结果表明壳糖平可以改善葡萄糖代谢紊乱和胆固醇代谢异常,维持机体内糖脂代谢平衡。
3 结论
本研究结果显示:壳糖平可减缓甚至消除T2DM小鼠体重的减少,而且能够显著降低小鼠血糖、血脂、AST和ALT水平并逆转肝肾损伤(P<0.05),这些作用可能与其下调G6Pase、PEPCK、SREBP-2、HMGCR,上调LDLR、CYP7A1,从而通过糖原异生和糖原生成途径调节葡萄糖及脂质代谢紊乱有关。这些发现提示:壳糖平适当剂量具有潜在辅助治疗二型糖尿病的效果。
