酶法制备阿拉斯加鳕鱼降压肽的工艺优化及其产物的结构鉴定
2020-04-01,*
,*
(1.滨州医学院药学院,山东烟台 264003;2.中国科学院烟台海岸带研究所,山东烟台 264003)
目前,心脏与心脑血管疾病,特别是心血管系统疾病中的高血压是威胁世界各国人们健康的重要原因。调查发现,全球高血压患者已超过14亿人口[1],因此降压药物的开发已成为科学家们关注的热点。临床上常用的抗高血压药物有血管紧张素转化酶抑制剂(Angiotensin-converting enzyme inhibitor,ACEI)和血管紧张素II(AngII)受体拮抗剂。在肾素-血管紧张素系统中,血管紧张素转化酶(Angiotensin-converting enzyme,ACE)可以将无活性的多肽血管紧张素I(AngI)催化酶解,得到八肽的血管紧张素II(AngII),AngII可以强烈收缩外周小动脉,促进肾上腺皮质激素的合成以及分泌醛固酮的作用,从而升高血压[2-3]。
目前,临床治疗高血压大多采用无机、人工合成的ACE抑制剂类药物,但长期服用会产生各种副作用。近年来,食源性蛋白肽作为一种新的非合成的ACE抑制剂类药物,由于其副作用小、安全性高等优点[4]受到很多研究者的青睐。人们已经从动物和植物蛋白的酶解物中获得了具有降压活性的肽片段。1986年,Feerreira等[5]首次从南美蝮蛇毒液中提取得到ACE抑制肽。很多研究者也从大豆、麦胚中制备得到ACE抑制肽[6]。相比于陆源生物活性多肽,海洋生物活性多肽更容易释放出独特的活性肽段,产生更好的降压作用[7]。
阿拉斯加鳕鱼为冷水性近底层鱼类,鱼皮中含有丰富的蛋白质,较鱼体的其他部分蛋白含量更高,但常作为下脚料被丢弃,造成大量水产资源的浪费及环境污染。利用鳕鱼加工副产物为原料,采用酶解法制备得到降压肽,并通过体外实验验证阿拉斯加鳕鱼降压肽的ACE抑制活性。为鱼皮的高值化综合利用提供途径,并为进一步开发新型海洋天然降血压活性物质提供基础。
1 材料与方法
1.1 材料和仪器
阿拉斯加鳕鱼皮 烟台嘉惠海洋生物科技有限公司;碱性蛋白酶(20万U/g)、胰蛋白酶(250 N.F.U/mg)、酸性蛋白酶(5万U/g)、菠萝蛋白酶(50万U/g)、木瓜蛋白酶(80万U/g)、复合蛋白酶(10万U/g) 北京索莱宝科技有限公司;马尿酰-组氨酰-亮氨酸(N-Hippuryl-His-Leu hydrate,HHL)、血管紧张素转化酶 Sigm-aldrich西格玛奥德里奇贸易有限公司;其他试剂 均为分析纯或色谱纯。
高速离心机(Avanti JXN-26) 贝克曼库尔特有限公司;紫外分光光度计(Cary 60) 安捷伦科技有限公司;高效液相色谱仪(Agilent1260) 安捷伦科技有限公司;高效液相色谱仪(Waters 1525) 沃特世科技有限公司。
1.2 实验方法
1.2.1 阿拉斯加鳕鱼皮水提原液的制备 将鳕鱼皮清洗干净,剪成方块状(1 cm×1 cm),组织匀浆机绞碎。加入15%的正丁醇溶液,4 ℃下搅拌8 h进行脱脂。滤出溶液,适量去离子水(鳕鱼皮体积的3倍)充分搅拌清洗。0.1 mol/L的NaOH溶液4 ℃继续搅拌10 h 除去杂蛋白。蒸馏水搅拌清洗至无味。经脱脂和除杂蛋白处理后的鱼皮中加入适量去离子水(料液比为1∶10),60 ℃水浴中搅拌提取,得到鳕鱼皮水提原液。冷冻干燥得到鳕鱼皮冻干粉,4 ℃储存。
1.2.2 阿拉斯加鳕鱼皮酶解液的制备 称取72 g阿拉斯加鳕鱼皮冻干粉(经1.2.1法制备得到),溶于360 mL去离子水(料液比为1∶5),充分混匀,以此溶液作为底物。表1列出了6种蛋白酶的最佳酶解条件。调节底物溶液为相应蛋白酶的最佳酶解温度和pH,分别加入3.6 g的酶(酶与底物的质量比为5%),酶解3 h后,将6种底物溶液经沸水水浴15 min,终止酶解反应[8-10]。冷却至室温,离心(4000 r/min,15 min,4 ℃),取上清液低温冷冻干燥得到酶解液冻干粉,4 ℃备用。
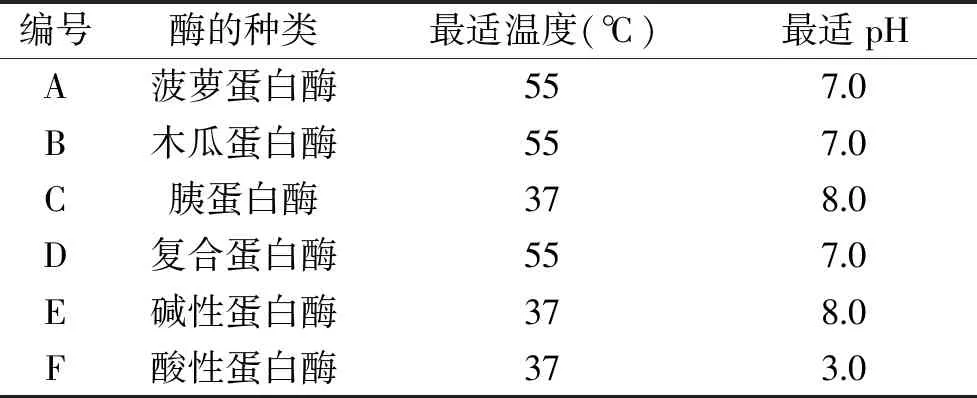
表1 6种蛋白酶的酶解条件Table 1 Enzymatic conditions of 6 kinds of proteinases
1.2.3 ACE抑制率的检测 ACE抑制率的检测参照文献中的方法进行[11-14]。将上述阿拉斯加鳕鱼酶解液冻干粉分别溶于适量蒸馏水中,0.5 mol/L NaOH或1 mol/L HCl溶液调节各溶液至相同pH(pH=7)。将ACE和HHL分别溶解在pH8.3,0.1 mol/L的硼酸钠缓冲溶液(含0.3 mol/L的NaCl),其中NaCl的浓度为0.3 mol/L,ACE溶液的酶活力为0.1 U/mL,HHL溶液的浓度为0.005 mol/L。取20 μL ACE溶液和80 μL上述酶解液冻干粉溶液(对照组加入等量的硼酸钠缓冲溶液)于4 mL离心管中混合均匀。在37 ℃环境下保温5 min后,向各个离心管中加入0.005 mol/L HHL溶液170 μL,混合均匀后,在37 ℃环境下保温30 min。继续向每个离心管中加入150 μL 1 mol/L的HCl溶液,摇动使其混合均匀,终止反应。最后向每个离心管中加入1 mL的乙酸乙酯,漩涡振荡30 s,离心(4000 r/min,15 min)。静置5 min,当有机层与水层完全分层后,移取0.8 mL有机层于5 mL离心管中,将离心管置于80 ℃水浴锅中挥干乙酸乙酯,最后向残渣中加入3.2 mL的去离子水使其充分溶解,测定该溶液在228 nm处的吸光度值(A228)。
I(%)=(A0-A1)/A0×100
其中:I为ACE抑制率;A0为对照组的吸光度值;A1为供试品的吸光度值。
1.2.4 胰蛋白酶酶解阿拉斯加鳕鱼皮的工艺条件优化
1.2.4.1 pH对ACE抑制肽的影响 以ACE抑制率为指标,在温度为37 ℃,料液比为1∶5,酶解时间为180 min,酶与底物质量比为5%的条件下研究不同pH(7.0、7.5、8.0、8.5、9.0)对ACE抑制肽的影响[15-16]。
1.2.4.2 料液比对ACE抑制肽的影响 以ACE抑制率为指标,在温度为37 ℃,pH=8.0,酶解时间为180 min,酶与底物质量比为5%的条件下研究不同料液比(1∶4、1∶5、1∶6、1∶7、1∶8)对ACE抑制肽的影响[17]。
1.2.4.3 温度对ACE抑制肽的影响 以ACE抑制率为指标,在pH=8.0,酶解应时间为180 min,料液比为1∶7,酶与底物质量比为5%的条件下研究不同温度(30、37、40、50、60 ℃)对ACE抑制肽的影响[8,18]。
1.2.4.4 酶解时间对ACE抑制肽的影响 以ACE抑制率为指标,在料液比为1∶7,pH=8.0,温度为50 ℃,酶与底物质量比为5%的条件下研究不同酶解时间(90、120、150、180、210 min)对ACE活性抑制肽的影响[16]。
1.2.4.5 酶与底物质量比对ACE抑制肽的影响 以ACE抑制率为指标,在料液比为1∶7,pH=8.0,温度为50 ℃,酶解时间为180 min的条件下研究不同酶与底物质量(0.5%、2%、3.5%、5%、6%)比对ACE抑制肽的影响[9]。
1.2.5 正交试验设计 在上述工艺优化实验的基础上,采用L18(37)正交表对胰蛋白酶酶解阿拉斯加鳕鱼皮的条件进行进一步优化,以ACE抑制率为指标,确定制备阿拉斯加鳕鱼降压肽最佳酶解工艺。如下表3所示为正交试验的水平与因素设计[19-20]。
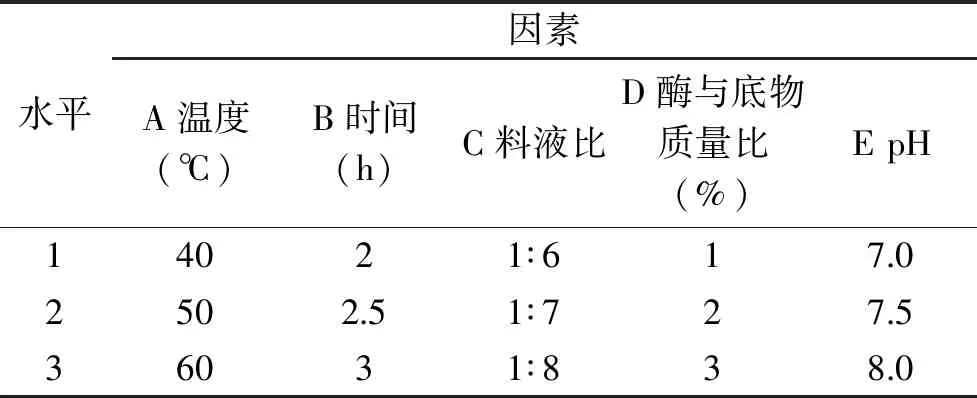
表2 正交试验设计因素水平表Table 2 Factors and levels table of orthogonal experiment design
1.2.6 SDS-PAGE分析 采用5%浓缩胶和18%分离胶对最佳酶解条件下制备的阿拉斯加鳕鱼皮酶解液的分子量进行测定[21-22],上样量为10 μL[23]。
1.2.7 分子量分布考察 对最优酶解工艺下的酶解液采用HPLC法和三重串联四级杆液质联用仪进行分子量分布考察[24]。
HPLC法色谱条件:色谱柱:TSK gel 2000 SWXL300 mm×7.8 mm,流动相:乙腈-水-三氟乙酸45∶55∶0.1,等度洗脱,检测波长:220 nm,流速0.5 mL/min,柱温:30 ℃[25-27]。
质谱检测条件:进样量10 μL,离子源:ESI,质量扫描范围为100~1400 u,正离子谱检测。
1.2.8 氨基酸含量测定 采用OPA柱前衍生RP-HPLC-UV法对最佳酶解条件下的酶解液中的17种氨基酸的含量进行测[28-29]。检测条件:色谱柱:ODS柱(5 μm,4.0 mm×250 mm),流动相:乙酸钠-甲醇-乙腈-乙酸钠-三乙胺-四氢呋喃;梯度洗脱:0~17 min:8% B~50% B;17~20 min:50% B~100% B;20~24 min:100% B~0% B;检测波长:338 nm;流速:1 mL/min,柱温40 ℃[30-31]。
1.3 数据处理
数据均以平均值±标准差的形式表示,采用Origin 9.0软件作图。
2 结果与讨论
2.1 蛋白酶的选择
本实验采用酶解法制备得到阿拉斯加鳕鱼ACE抑制肽,不同蛋白酶酶解阿拉斯加鳕鱼皮的能力不同,因此酶的选择对ACE抑制肽的制备至关重要。下表3为6种不同蛋白酶的酶解效果比较。
由表3可知,6种蛋白酶的酶解物对ACE均有抑制作用,其中,胰蛋白酶的酶解能力最佳,ACE抑制率为68.48%±2.96%,即胰蛋白酶酶解产物对ACE的抑制活性最佳。因此,胰蛋白酶可作为酶解阿拉斯加鳕鱼皮的最适酶种,复合蛋白酶的活性与菠萝蛋白酶的活性次之,ACE抑制率分别为63.56%±7.87%和62.70%±4.78%;其他3种蛋白酶的ACE抑制率均小于60%。不同的蛋白酶的酶切位点不同,6种蛋白酶酶解出来的肽段的氨基酸组成不同,释放出来的肽段序列各异,长短不一,活性会有较大差异,对ACE的抑制率影响也不同。
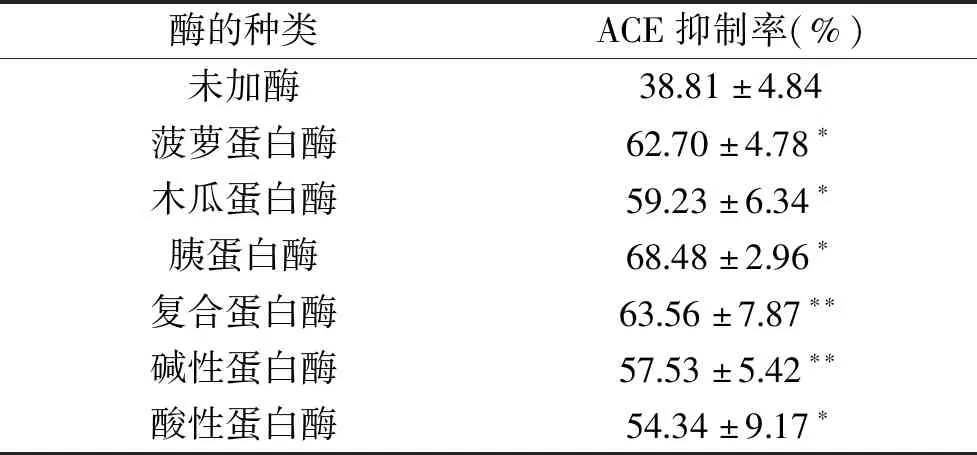
表3 6种不同蛋白酶的水解效果比较Table 3 Comparison of hydrolysis by 6 kinds of proteinases
注:*:与对照组(未加酶)比较,差异显著(P<0.05),**:与对照组(未加酶)比较,差异极显著(P<0.01)。
2.2 胰蛋白酶酶解阿拉斯加鳕鱼皮的工艺条件优化
2.2.1 pH对ACE抑制肽的影响 pH对ACE抑制肽的影响如图1所示。结果表明:在pH7.0~9.0的范围内,随着pH的增大,ACE抑制率呈现先增大后减小的趋势,其中pH=7.5时,ACE抑制率最高,为73.19%。分析主要原因是胰蛋白酶在过碱性条件下,酶的构象发生变化,酶出现了不可逆失活[32]。因此,胰蛋白酶在弱碱性条件下酶解活性较高。
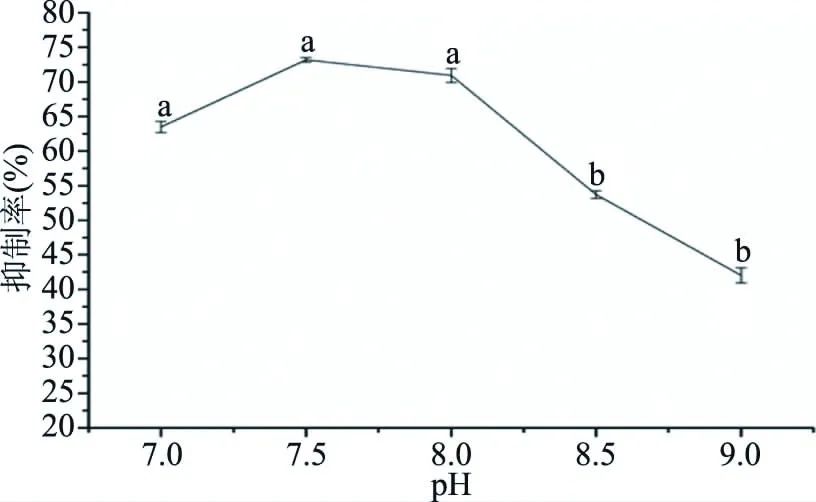
图1 pH对ACE抑制率的影响Fig.1 Effect of different pH on ACE inhibitory rate注:不同字母表示具有显著性差异,P<0.05;图2~图5同。
2.2.2 料液比对ACE抑制肽的影响 料液比对ACE抑制肽的影响如图2所示。结果表明:在料液比1∶4~1∶7时,随着料液比的不断升高,ACE抑制率呈现上升的趋势。当料液比为1∶7时,ACE抑制率达到最大值,为72.87%;当料液比由1∶7增加至1∶8时,ACE抑制率略有下降,为72.02%。可能是由于反应体系中底物浓度较大,酶活是一定的,随着料液比进一步增大,抑制率变化不明显[33]。因此,选择料液比为1∶7最为合适。
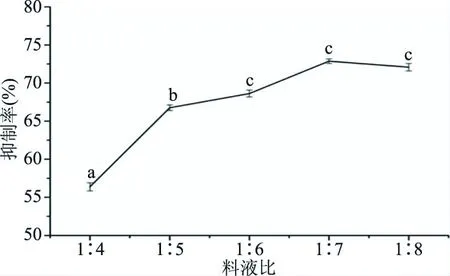
图2 料液比对ACE抑制活性的影响Fig.2 Effect of different solid-liquid ratio on ACE inhibitory rate
2.2.3 酶解温度对ACE抑制肽的影响 酶解温度对ACE抑制肽的影响如下图3所示。结果表明:在30~60 ℃范围内,随着酶解温度的升高,ACE抑制率也随之升高。说明随着温度升高,酶的结构未变化,活性也随之升高[18]。当温度为50 ℃时,ACE抑制率达到最大值,为79.26%。且随着温度升高,抑制率趋于平稳,所以50 ℃为优选温度。
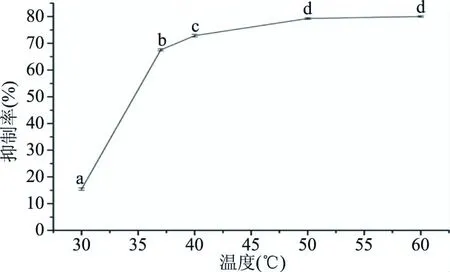
图3 酶解温度对ACE抑制率的影响Fig.3 Effect of enzymolysis temperature on ACE inhibitory rate
2.2.4 酶解时间对ACE抑制肽的影响 酶解时间对ACE抑制肽的影响如图4所示。结果表明:随着酶解时间的增加,在酶解时间为90~210 min范围内,抑制率呈现先增大后减小的趋势。当酶解时间为150 min时,抑制率达最大值,为75.66%。这可能是因为酶解时间越长,活性肽段的释放率越高,但随着酶解时间进一步延长,一些释放出的活性肽段会在蛋白酶的作用下被进一步酶解为无活性的分子,ACE抑制率也会随之降低[34]。
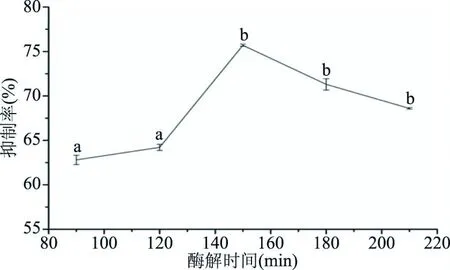
图4 酶解时间对ACE抑制率的影响Fig.4 Effect of enzymolysis time on ACE inhibitory rate
2.2.5 酶与底物质量比对ACE抑制肽的影响 酶与底物质量比对ACE抑制肽的影响如图5所示。结果表明,在酶与底物质量比为0.5%~2%的范围内,随着酶与底物质量比的增加,阿拉斯加鳕鱼皮蛋白肽被不断降解成小分子肽段,该反应体系的ACE抑制活性随之增加。当酶与底物质量比为2%时,抑制率达最大值,为70.06%。当ACE抑制肽被酶饱和后,酶的浓度不再是影响酶解反应的主要因素。进一步增加酶与底物质量比反而降低了活性肽段占蛋白肽的比重,导致酶解速率减慢,ACE抑制率呈下降趋势[35]。
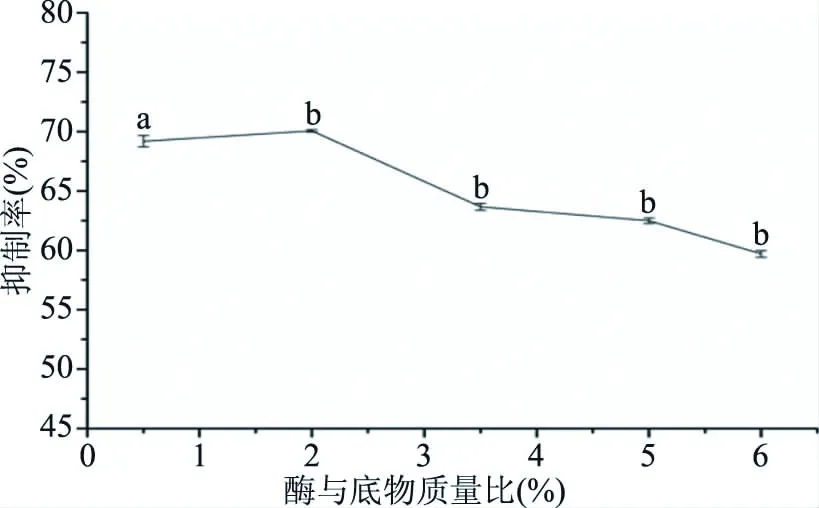
图5 酶与底物质量比对ACE抑制率的影响Fig.5 Effect of mass ratio of enzyme to substrate on ACE inhibitory rate
2.3 正交试验结果
采用正交试验优化制备阿拉斯加鳕鱼皮的酶解条件,正交试验结果如表4所示。
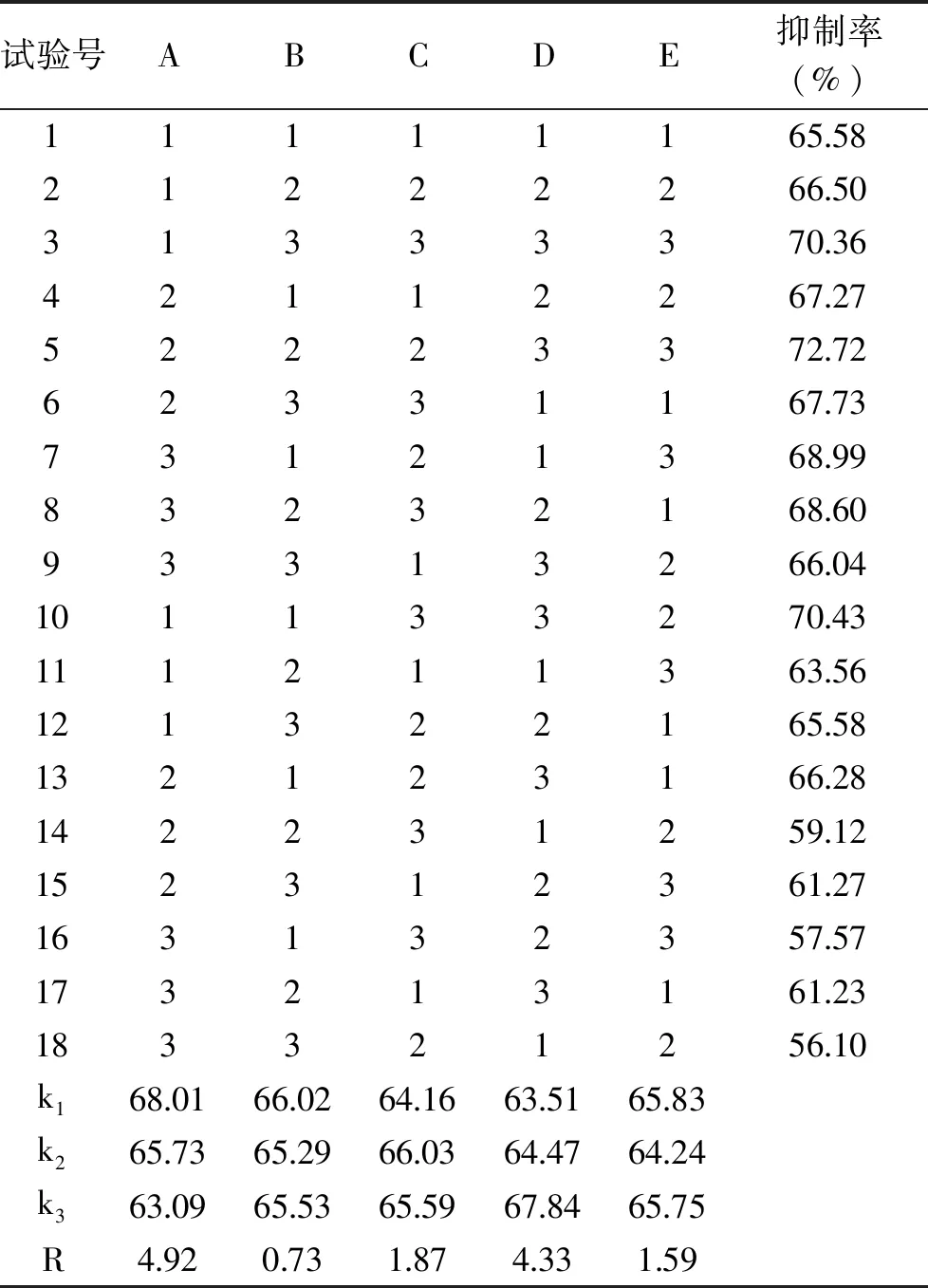
表4 正交试验设计与结果分析Table 4 Orthogonal test design and result analysis
由表4可知,各因素影响胰蛋白酶活性大小的顺序为A>D>C>E>B,即温度对胰蛋白酶活性的影响最大,其次为酶与底物质量比、料液比、pH,时间对其影响最小。
根据结果可知,最佳的酶解组合为A1B1C2D3E1,即酶解温度40 ℃,酶解时间2 h,料液比1∶7,酶与底物质量比3%,pH=7.0时胰蛋白酶酶解阿拉斯加鳕鱼皮的效果更好,抑制率可达79.62%。
2.4 SDS-PAGE分析
阿拉斯加鳕鱼低聚肽的SDS-PAGE电泳分析如图6所示。结果表明,未酶解的阿拉斯加鳕鱼皮水体原液的条带分布不一,经酶解的低聚肽溶液未见明显条带,需要进一步借助高效液相色谱法来测定低聚肽酶解液的分子质量分布。

图6 SDS-PAGE电泳分析Fig.6 SDS-PAGE analysis
2.5 分子量分布考察
相比大分子蛋白质和单一的氨基酸,二肽和三肽分子量较小(3~500 kDa),所以更易被人体直接吸收[36],因此分子量分布的考察极为重要。该部分通过HPLC法对最优酶解条件下的酶解液进行了分子量分布考察。从表5(由图7经计算分析可得)可以看出,分子量低于1000 Da的阿拉斯加鳕鱼降压肽占总体的93.08%,分子量在500 Da以下的占总体的70.74%,平均分子量为457.5 Da。研究发现:最大三肽(Trp-Trp-Trp)和最小二肽(Gly-Gly)的分子量分别为576 u和132 u[37],因此处于这个区域之内的肽段主要为二肽和三肽。对最优酶解条件下的酶解液进行质谱分析(图8)可以得出与HPLC法相同的结论:在图谱中可见质子峰多集中的m/z范围为200~500。这说明在最佳酶解条件下,阿拉斯加鳕鱼皮酶解得到了以二肽和三肽为主的降压肽。谱图中含有多种不同信号强度的质子峰,这说明最佳酶解条件的酶解液是含有多种不同分子量的多肽混合物。
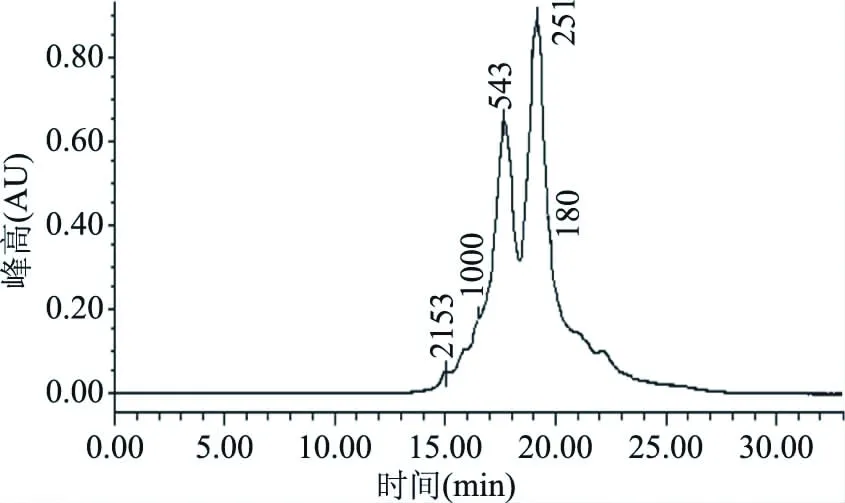
图7 阿拉斯加鳕鱼低聚肽酶解液的液相色谱图Fig.7 Chromatogram of enzymatic hydrolysate注:图中数值代表Mp值(最高位峰的分子量)。

分子量范围(Da)保留时间(min)峰面积百分比(%,λ220nm)>200015.0401.282000~100016.5035.641000~50017.67122.34500~18019.14748.19<18019.78322.55

图8 阿拉斯加鳕鱼低聚肽酶解液的质谱图Fig.8 MS spectrum of enzymatic hydrolysate
2.6 酶解液氨基酸含量测定结果
对最优酶解工艺条件下的酶解液进行氨基酸含量测定,测定结果如表6所示。阿拉斯加鳕鱼皮酶解液中氨基酸总含量约为83%,其中Gly含量最高,为29.41%,Pro含量次之,可达16.11%;人体必需氨基酸约占氨基酸总含量的18.9%。相比牡蛎ACE抑制肽,鳕鱼皮降压肽中氨基酸总含量更高[35]。与从罗非鱼鱼鳞胶降压肽的氨基酸组成几乎相同,但鳕鱼皮降压肽中Gly和Pro含量更高[38]。其中,在人体中枢神经系统中,Gly是最重要的神经递质之一。甘氨酸通过PTEN/AKT信号通路发挥对大鼠的神经保护作用,减轻大鼠的脑出血损伤[39]。脯氨酸是体内合成蛋白质的氨基酸之一,为细胞新陈代谢提供了物质基础[40]。降压肽中脯氨酸的含量较高会对多肽的ACE抑制作用起到很好的促进作用[38]。
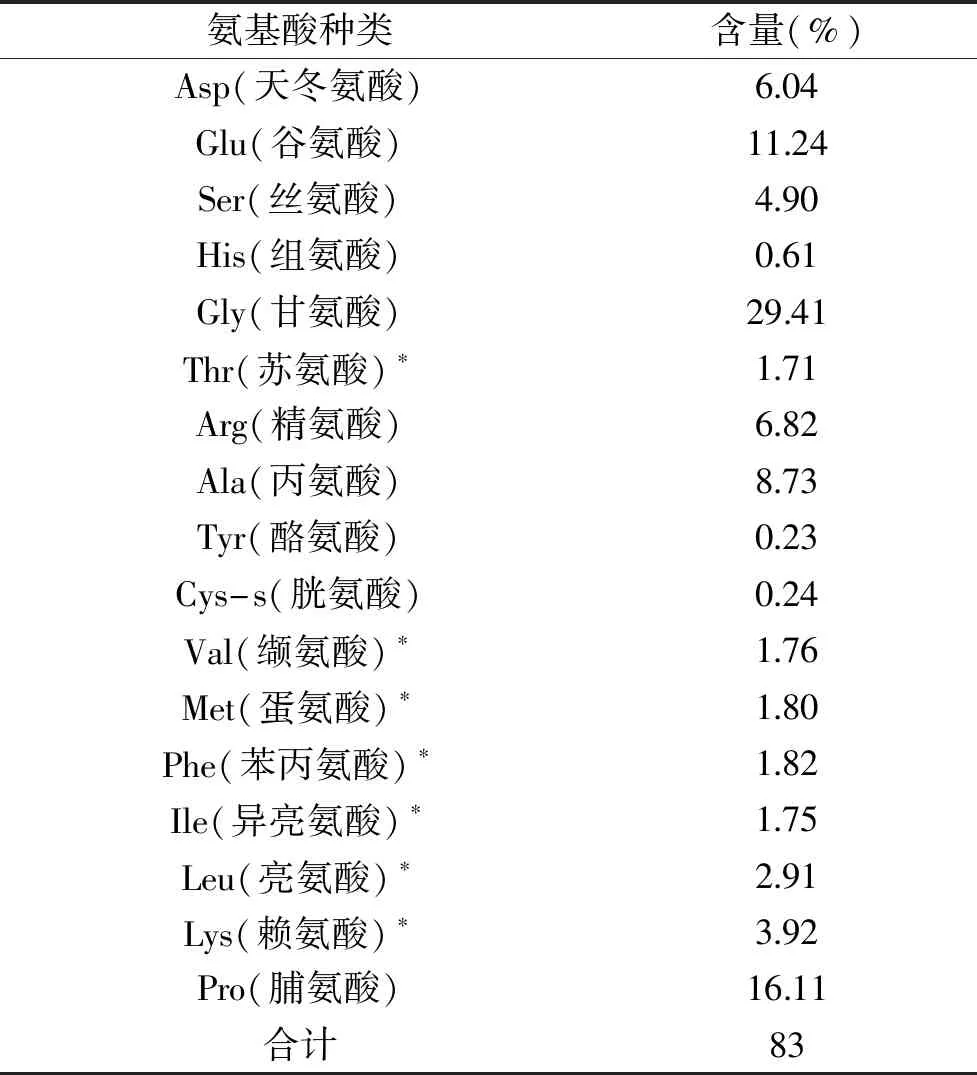
表6 酶解液的氨基酸组成Table 6 Amino acid composition of enzymatic hydrolysate
注:表中标注*为必需氨基酸。
3 结论
本研究以ACE抑制率为指标,比较了6 种蛋白酶酶解阿拉斯加鳕鱼皮的能力。通过工艺优化实验确定最佳工艺为:胰蛋白酶酶解温度40 ℃,酶解时间2 h,料液比1∶7,酶与底物质量比3%,pH=7。最优工艺的酶解液ACE抑制率为79.62%。分子量在500 Da以下的占总体的70.74%;酶解液氨基酸总含量为83%,其中Gly含量最高,为29.41%,Pro含量次之,可达16.11%;酶解液中含有7种必需氨基酸,分别是Ile、Leu、Met、Val、Phe、Lys、Thr。阿拉斯加鳕鱼皮酶解液在体外研究中具有很好的ACE抑制活性,未来在功能性食品的开发应用中将具有很高的研究价值。
