珍贵橙色束丝放线菌发酵产安丝菌素P-3的分离纯化工艺优化
2020-04-01吴兴可祁荃卞婷婷刘苏煜谷艺明郭静蔡志强
吴兴可,祁荃,卞婷婷,刘苏煜,谷艺明,郭静,蔡志强
(常州大学制药与生命科学学院,江苏常州213164)
安丝菌素(ansamitocin)主要是通过珍贵橙色束丝放线菌发酵产生的苯安莎类抗生素[1],具有良好的抗肿瘤活性[2]。它是一种19元环的大环内酯类化合物,根据其C-3 位侧链R 基的不同,可分为AP-1、AP-3、AP-2、AP-3’和AP-4 这五个部分,其中AP-3是主要成分之一且其抗肿瘤细胞毒性最强[3],可用于抗体药物偶联物(ADCs)的研发[4],其化学结构如图1所示。据报道,安丝菌素微生物发酵水平较低,纯化工艺复杂,分离提取成本高,因此提高回收率,简化纯化工艺,是目前迫切需要解决的问题[5-6]。
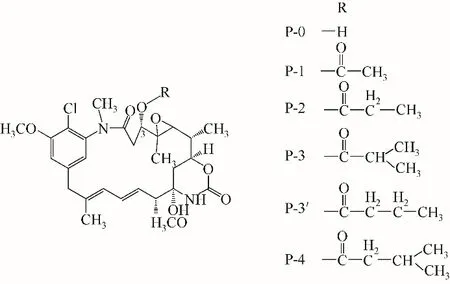
图1 安丝菌素结构式
近几年,学者主要通过诱变菌株、优化发酵培养基或改造基因、代谢节点等[7-9]来提高AP-3的发酵产量。在分离纯化上,传统方法有柱色谱法,但是该法有很多局限性,工艺繁琐,得率低;到20世纪80 年代发展起来的高效逆流色谱法与传统方法不同,是无需固体填料的高效分离技术,该法获得安丝菌素P-3 纯度达98%以上,回收率为80%,然而成本较高[10];美国一份专利[11]通过对发酵液进行热灭活处理后再进行分离纯化,另一份免疫基因公司申请专利[12]通过添加氯仿来使微生物灭活,再用硅胶柱和氧化铝柱吸附层析,发现对发酵液进行适当预处理后会显著降低后期分离纯化难度,由于专利保护或用于商业用途该结果没有对外公开。
微生物发酵生产的安丝菌素发酵液组成成分繁多且复杂,除了发酵产品AP-3 之外,还包括所培养的微生物菌体(菌丝、菌球)及未利用的培养基成分、发酵过程中的副产物等,主要是色素及易溶于有机溶剂中的酶等。这些杂质的存在会给安丝菌素的分离纯化带来困难,影响目标物质的回收率和质量,所以在分离提取前,必须对发酵液进行预处理。
本文通过对安丝菌素发酵液进行菌体分离、酸处理、活性炭吸附及解吸附等一系列预处理,有效地去除了发酵液中的菌体、杂蛋白质及色素,然后利用中性氧化铝对处理过的收集液进行分离纯化,建立了快速分离纯化安丝菌素P-3的方法。
1 材料与方法
1.1 菌株与培养基
珍贵橙色束丝放线菌变种(Actinosynnema pretiosumssp.auranticumB126-29) 为 本 实 验 室DES化学诱变所得的安丝菌素生产菌株。
种子培养基:甘油10g/L,葡萄糖5g/L,酵母膏10g/L,牛肉膏10g/L,氯化钠3g/L,pH=7.4,115℃灭菌30min。
优化发酵培养基:甘油20g/L,蔗糖25g/L,玉米浆10g/L,前体异丁醇2g/L,七水硫酸镁0.5g/L,七水合硫酸亚铁0.01g/L,pH 7.4,115℃灭菌30min。
1.2 材料与仪器
发酵液:实验室保藏的珍贵橙色束丝放线菌变种(Actinosynnema pretiosumssp.auranticumstrain B126-29)二次活化后接种于优化发酵培养基中,28℃,220r/min 发 酵7 天 所 得;AP-3 标 准 品(HPLC 级,购于药明康德天津分公司);Agilent 1260 高效液相色谱仪;R1001-VN 旋转蒸发仪,PB-10 酸度计;S53 紫外可见分光光度计;硅藻土过滤装置实验室自制;牛血清蛋白质、考马斯亮蓝、活性炭、硅藻土购于上海生工。
1.3 测定方法
1.3.1 液相色谱条件
UV 检测器;检测波长为254nm;色谱柱为EclipseXDB-C18柱(250mm×4.6mm×5μm),柱 温25℃;流动相为甲醇-水(体积比70∶30),流速0.8mL/min;进样量20μL。
1.3.2 标准曲线的绘制
称取适量AP-3 标准品溶于甲醇中,将其配制成800mg/L 的标准液作为母液,按梯度稀释成0、200mg/L、400mg/L、600mg/L、800mg/L 浓度的标准溶液,使用0.22μm的微孔滤膜过滤,在1.4.1节的色谱条件下平行测定3 次,平均峰面积为横坐标,AP-3标准液的质量浓度为纵坐标,绘制浓度-峰面积标准曲线,计算线性方程,标准曲线如图2所示。
AP-3标准曲线方程为y=0.031x-4.62(R2=0.9999)线性拟合良好,可用于发酵液中AP-3含量的计算。
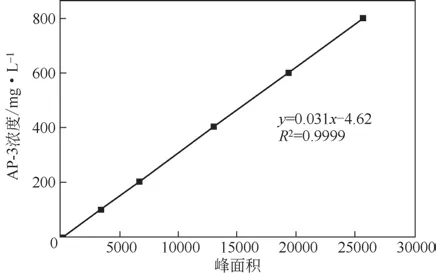
图2 AP-3的HPLC标准曲线
1.3.3 AP-3浓度测定
从摇瓶中吸取5mL 发酵液,加入等体积乙酸乙酯充分混合震荡后8000r/min 离心5min,吸取上层乙酸乙酯层,如此反复萃取三次后,在45℃下进行旋蒸,蒸干后溶于1mL甲醇(HPLC 级)充分溶解后过0.22μm的微孔滤膜,根据1.4.2节标准曲线计算发酵液中AP-3的含量[13]。
1.3.4 除菌量的测定
取适量发酵液,稀释,测量发酵液在波长660 nm 处的光密度值,控制在0.3~0.8 范围内;测量值乘以稀释倍数,即为发酵液中菌体生物量,从而确定菌体的去除率。
1.3.5 杂蛋白质测定
采用考马斯亮蓝G-250法[14]。
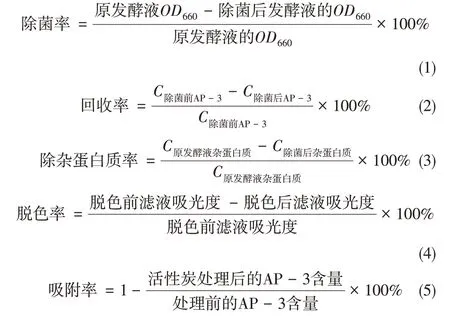
1.3.6 计算公式
安丝菌素P-3 的除菌率,生产过程安丝菌素P-3的回收率、除杂蛋白质率、脱色率、吸附率的计算如式(1)~式(5)。
1.4 实验方法
1.4.1 发酵液的预处理
(1)硅藻土添加量的影响 将滤纸浸湿后,铺于抽滤漏斗的底部,将硅藻土与水的均匀混液倒入铺好滤纸的漏斗内,待硅藻土沉淀后,开启真空泵进行真空抽滤,抽滤压力为0.1MPa。硅藻土形成1~2cm 厚涂层且其表面水抽尽后,倒入发酵液,在不换硅藻土滤层的情况下,连续抽滤3次。硅藻土也可作为助滤剂,将硅藻土与发酵液进行混合后再进行过滤,添加量分别为5g/L、10g/L、15g/L、20g/L、25g/L、30g/L。将没有添加硅藻土的发酵液作为对照,取少量发酵液8000r/min,离心5min,除菌体和杂质得到上清液,采用1.3.4 节和1.3.5 节的方法比较抽滤和离心对除杂蛋白质和除菌效果的影响,同时采用1.4.3节中的AP-3测定方法计算回收率,比较两种方法对AP-3含量的影响。
(2)不同pH对发酵液杂蛋白质、AP-3含量的影响 考察不同酸性条件下pH 分别为2、3、4、5、6时的除蛋白质率及回收率,考察不同pH对发酵液杂蛋白质、AP-3含量的影响。
(3)发酵液脱色波长的确定 发酵液成分复杂,将抽滤所得发酵液,稀释成不同浓度,分别在波长380nm、400nm、420nm、440nm、460nm处测其吸光度,绘制图谱,选择线性关系最好的波长作为测定AP-3发酵液色素的最佳波长[15]。
(4)活性炭吸附条件的优化 采用单因素优化实验,分别考察活性炭添加量(1g/L,5g/L,10 g/L,15g/L,20g/L)、吸附温度(30~70℃)、吸附时间(0~150min)对滤液色度以及AP-3 含量的影响。
(5)活性炭吸附安丝菌素的脱附 收集吸附安丝菌素发酵液的活性炭于锥形瓶中,加入不同种类的有机溶剂洗脱液后,密封,室温下震荡洗脱,静置后过滤洗脱液,测其安丝菌素P-3含量。
1.4.2 中性氧化铝柱层析
将上述洗脱液进行减压旋蒸浓缩呈浸膏状后加入其质量1.2~1.5倍的中性氧化铝(200~300目),然后加入适量乙酸乙酯后使两者混合均匀,减压旋蒸后,得到柱层析所需上样样品,湿法装柱后干法上样,再进行梯度洗脱,收集含有AP-3 的洗脱液后,减压旋蒸浓缩后,甲醇(HPLC 级)定容后过0.45μm滤膜,4℃保存待测。
1.4.3 重结晶
用少量正己烷溶解上述纯化AP-3浓缩品,然后超声至白色混浊物出现,最后在4℃下静置5~24h使其重结晶,如此反复得到纯度较高的AP-3。
1.4.4 质谱(MS)
用含有0.1%甲酸的50%甲醇溶液溶解重结晶后的样品后,选择H+、Na+和K+离子测试。
1.4.5 核磁共振(NMR)
将重结晶后的高纯样品溶于0.5mL的氘代氯仿中,装入干净的核磁管中,在300MHz下测H1NMR。
1.5 结晶
将脱色过程中收集的流出液减压浓缩再结晶,得到白色粉状结晶物,置于真空干燥箱中50~60℃烘干后得到结晶。
2 结果与讨论
2.1 发酵液的预处理
2.1.1 硅藻土添加量的影响
由图3可知,用涂有硅藻土涂层的抽滤装置进行抽滤时,发现抽滤效果比离心效果要好,但是回收率较低,这可能是因为硅藻土作为吸附剂除了吸附发酵液中的菌体和杂蛋白质,还会吸附部分AP-3,使得回收率降低。通过离心去除菌丝体后乙酸乙酯直接萃取上清液中的AP-3 发现产量降低,推测可能是因为菌丝体较黏吸附了部分AP-3,乙酸乙酯直接萃取上清液会损失部分菌丝体上的AP-3。硅藻土除了作为吸附剂外,还可作为助滤剂,添加不同浓度的硅藻土发现不仅除杂蛋白质率有所提高,AP-3 的回收率也有提高,这与其他文献研究结果相似[16]。在10g/L 时,回收率达到最大,因此本文作者选择10g/L作为硅藻土的添加量,此时除菌率为89.85%,除杂蛋白质率为54.12%,回收率为96%。
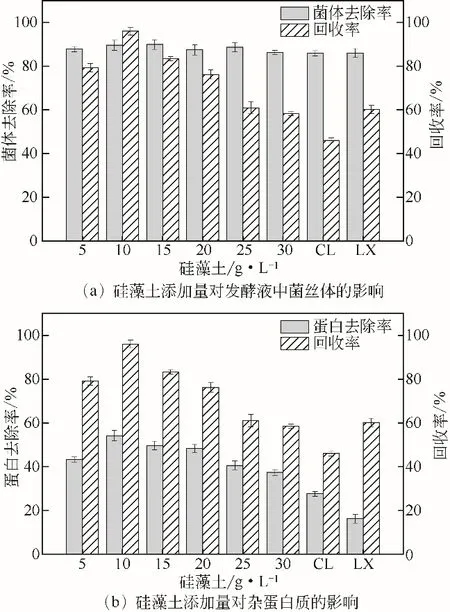
图3 硅藻土添加量对发酵液中杂质的影响
2.1.2 不同pH 对发酵液中杂蛋白质、AP-3 含量的影响
由图4可知,pH为2时,蛋白质析出最多,除蛋白质率最高。随着pH 升高,除蛋白质率逐渐降低,说明酸性条件下蛋白质更易变性沉淀,pH为3时AP-3的回收率达到最大,随后随着pH的提高逐渐降低,AP-3 在弱酸性条件下更易溶于乙酸乙酯中,可能是因为pH 下降,黏度下降,菌体缠绕AP-3能力降低,使得菌丝体上AP-3更易被萃取出来[17]。当pH 为2 时,AP-3 产量降低,可能是强酸性条件下AP-3不易溶于有机溶剂[18],使得AP-3萃取量降低。因此选择pH 为3 时对发酵液进行杂蛋白质预处理,此时除杂蛋白质率为68.2%,回收率为83.8%。
2.1.3 发酵液脱色波长的确定
发酵液浓度与吸光度关系见图5及表1。
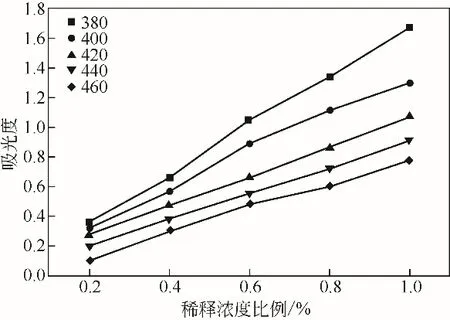
图5 脱色波长的确定

表1 不同波长下的相关系数
由表1可知,波长420nm时线性系数最好,故后续步骤用420nm作为活性炭脱色检测波长。
2.1.4 活性炭质量浓度对发酵液的影响
添加浓度1~2g/L 的活性炭,在恒温水浴60℃下加热1h后,离心取上清液测其脱色率及吸附率,结果见图6。
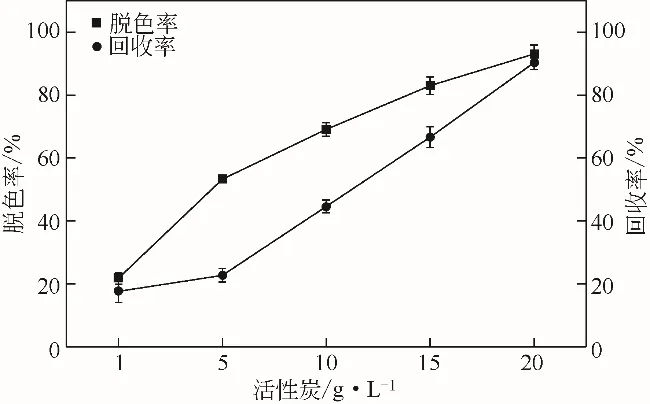
图6 活性炭加入量对发酵液的影响
由图6可知,随着活性炭用量增加,脱色率不断增加,增加到一定程度之后就趋向稳定,是因为活性炭属于物理吸附,当吸附到一定程度之后其内部达饱和状态,很难再吸附色素。随着活性炭质量浓度的增加,脱色率显著增加,回收率明显升高。当质量浓度为20g/L 时,回收率剧增,发酵液已几近无色,于是选择20g/L 浓度活性炭,此时脱色率达93.06%,吸附率达90.31%。
2.1.5 温度及脱色时间对脱色效果影响
由图7可知,温度升高能减小体系的黏度,加速分子的热运动,促使色素分子间碰撞机会增加,有利于加速活性炭对色素的吸附作用;随着脱色温度的升高,发酵液脱色率逐渐增大,60℃后没有明显的变化趋势,说明活性炭对色素的吸附达饱和状态,此时脱色率为91.63%。AP-3 的回收率随着温度的升高逐渐缓慢降低,但是变化不大,说明活性炭吸附已趋于平衡状态,当温度达到70℃时回收率明显降低,可能是温度过高导致安丝菌素降解。于是选择60℃下对发酵液进行活性炭脱色处理,此时吸附率达89.45%。
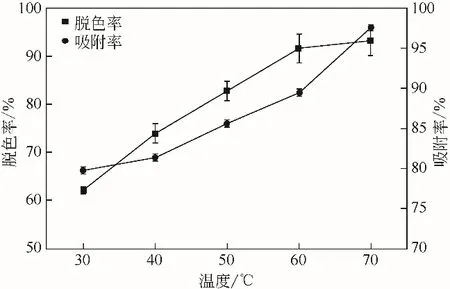
图7 脱色温度对发酵液的影响
由图8可知,随着脱色时间的延长,脱色率升高,表明被吸附物质与活性表面接触机会越多[19],当脱色时间到达2h 时,安丝菌素被全部吸附,大部分色素被全部脱除,随着脱色时间的延长活性炭吸附达到平衡状态,脱色率为93.12%,得率100%,于是选择2h作为脱色最佳时间。

图8 脱色时间对发酵液的影响
2.1.6 安丝菌素洗脱剂的选择
由表2可知,选取上述三种有机溶剂进行洗脱时,发现只有乙酸乙酯未有色素洗脱出来。推测可能色素吸附在活性炭内部,孔道内有水阻隔色素与乙酸乙酯接触,上述洗脱剂中,安丝菌素更易溶于乙酸乙酯,导致安丝菌素较色素更易被洗脱出来。
2.1.7 安丝菌素洗脱时间的选择
活性炭的吸附与脱附同时进行,在一定时间下会达到动态平衡。
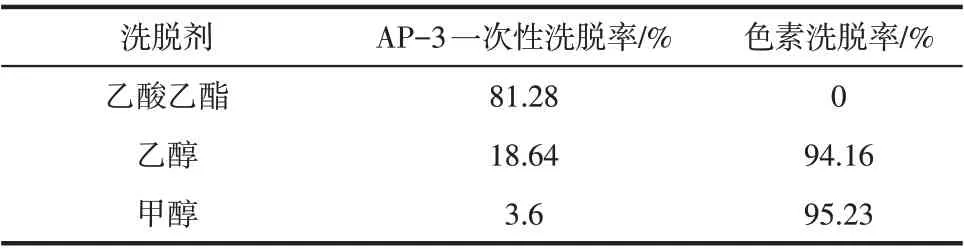
表2 不同洗脱剂对活性炭吸附安丝菌素的洗脱效果
由图9 可知,随着时间的延长,AP-3 的洗脱率逐渐增大,当达到2h 时,安丝菌素的洗脱率不再发生变化,说明已达到动态平衡,于是选择2h作为洗脱时间,此时AP-3的洗脱率为81.28%。
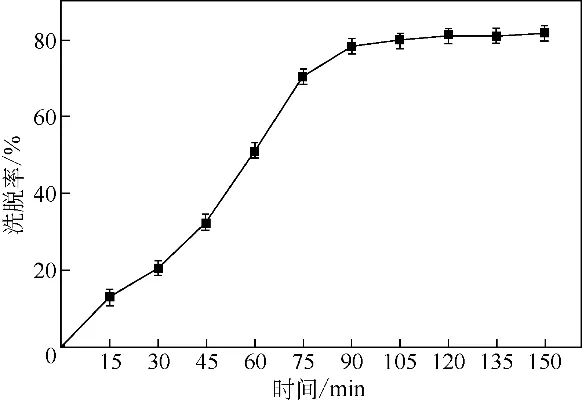
图9 活性炭吸附安丝菌素的洗脱过程
2.2 中性氧化铝柱层析结果
由表3可知,对发酵液进行预处理后,更易进行中性氧化铝柱层析,消耗有机溶剂总体积720mL(溶剂用量327mL/mg 产物),与文献[20]直接柱层析后消耗有机溶剂1680mL(溶剂用量763mL/mg产物)相比,其消耗体积显著降低,可见极性较大的物质并未完全分离出来,但是含量相对减少,此时AP-3纯度86.15%,洗脱率80.36%。

表3 中性氧化铝柱层析梯度洗脱消耗溶剂体积
2.3 质谱(MS)与核磁共振(NMR)结果
分离纯化后再重结晶得到AP-3 纯品,经过HPLC 检测得到其纯度达95%,AP-3 总体收率为78.5%,溶剂用量为347mL/mg AP-3。因此对其进行了MS 和1H NMR 分析(如图10),ESI 质谱数据显 示,[M+H]+(m/z)为635.27,[M+Na]+(m/z) 为657.26,[M+K]+(m/z)为701.49,证明发酵产物提取分离得到的确为AP-3。
3 结论
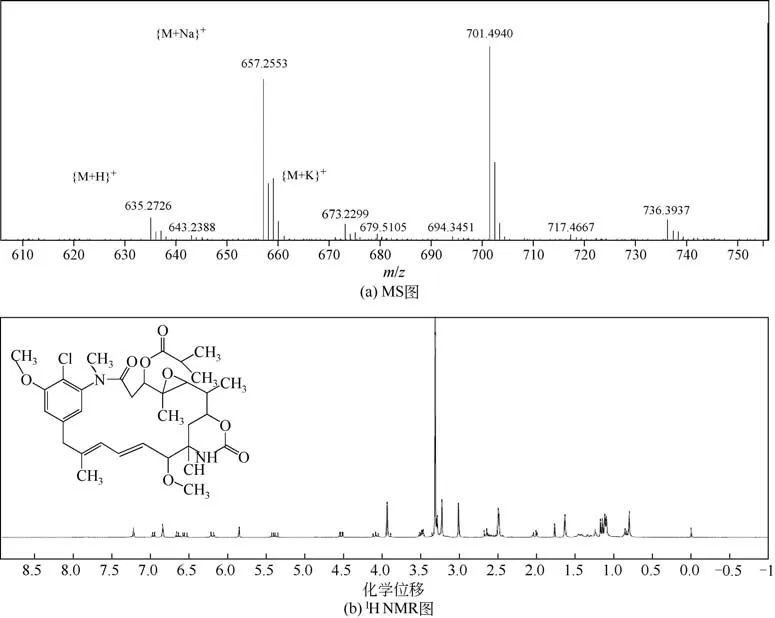
图10 纯化所得AP-3的MS、1H NMR图
为了提高分离纯化AP-3 的效率,本研究通过对发酵液进行预处理,以除去发酵液中的杂蛋白质及色素。本文用抽滤的方法代替了传统的离心方法,有效地去除了发酵液中的菌体杂质等。通过酸化发酵液,去除发酵液中的大量杂蛋白质,对发酵液进行了有效预处理,同时通过单因素实验考察活性炭吸附发酵液中色素的最佳条件,采用乙酸乙酯脱附来达到快速分离纯化的目的。除此之外,发现活性炭还可以重复利用,选取的脱附剂乙酸乙酯相较于其他有机试剂其毒性也小,此时AP-3的洗脱率为81.28%。最后采用中性氧化铝柱层析,消耗有机溶剂总体积720mL,洗脱率80.36%,此时AP-3 纯度86.15%。分离纯化后的AP-3 经重结晶后其纯度可达95%以上,经过MS 和1H NMR 分析可确定发酵产物提取分离得到的确为AP-3。本文从多角度研究纯化安丝菌素P-3的方法,该方法既快速又环保。另外本文为快速分离纯化安丝菌素也提供了新的方法及思路。
