粒度对氢氧化铝低温相变动力学的影响
2020-04-01范伟东李旺兴韩东战郑纯辉
范伟东,李旺兴,韩东战,郑纯辉
(1中南大学冶金与环境学院,湖南长沙410083;2中国铝业郑州有色金属研究院有限公司,河南郑州450041)
勃姆石,又称薄水铝石或一水软铝石,结构式为AlO(OH),分子式为Al2O3∙H2O,密度为3010kg/m3,硬度为3.9~4.0,属斜方晶系,结晶完好者呈菱形体、棱面状、棱状、针状、纤维状和六角板状[1],具有比表面积大、孔隙率大、分散性和胶溶性好等优点[2]。勃姆石是工业上用于制备活性氧化铝的重要前体[3-5],也在吸附材料[6-9]、薄膜填料[10]、阻燃剂[11-12]、催化剂载体[13-15]、医药[16-17]等领域有广泛的应用。
制备勃姆石的方法主要为有机醇盐水解[18-19]、铝盐中和-水热[20-21]等方法。这些方法物料不能循环利用,废水废料排放较多,生产成本较高。能否以价格相对便宜的氢氧化铝为原料,通过水热处理制备出勃姆石产品,是一个很值得研究的课题。彭志宏等[22]进行了氢氧化铝脱水至α-氧化铝过程动力学研究,认为在温度段268.03~308.13℃和473.14~548.51℃,氢氧化铝的脱水动力学反应机理分别为三维扩散和化学反应;龚念[23]开展了特殊形貌超细颗粒氢氧化铝煅烧过程动力学研究,发现煅烧过程主要有两个动力学过程,即300~500K温度段的表面吸附水脱除过程和600~800K温度段的内部结构水脱除过程,两个阶段的平均活化能分别为42.976kJ/mol 和139.185kJ/mol;关昕等[24]开展了粒径在300nm的勃姆石粉体脱水动力学研究,计算得出勃姆石脱水过程活化能为160.34kJ/mol。单独进行氢氧化铝低温相变生成勃姆石的动力学研究则尚没有相关文献。
本文通过综合热分析仪测试技术研究氢氧化铝低温相变生成勃姆石的过程,并用Kissinger 方程、Ozawa 方程以及Crane 方程等对这一过程进行热力学分析。利用激光粒度仪分析低温煅烧前后粒度的变化,利用X射线衍射(XRD)和扫描电子显微镜(SEM)来分析氢氧化铝相变产物的物相以及微观形貌,探讨粉体粒度对氢氧化铝低温相变动力学的影响。
1 实验仪器和方法
1.1 原料和分析仪器
3 种氢氧化铝原料,1#为中国铝业山东分公司生产的砂状氢氧化铝产品,2#为砂状氢氧化铝经12h 研磨后细氢氧化铝粉体,3#为实验室采用工业氧化铝生产工艺制备的亚微米氢氧化铝,其主要物理化学指标见表1。

表1 氢氧化铝原料物理化学指标
差热分析仪(DSC,3型),美国Mettler Toledo公司;HELOS 激光粒度分析仪,德国新帕泰克公司;JSM-35型扫描电子显微镜(SEM),日本株式会社X'Pert PRO X 射线分析仪(XRD),荷兰帕纳科公司。
1.2 实验方法
差热分析检测:将样品10mg放入设备坩埚中,在升温速率分别为5℃/min、10℃/min、15℃/min、20℃/min、25℃/min和30℃/min的条件下进行加热,升温范围为25~350℃,测试过程采用氮气保护,气体流量为0.020L/s。
煅烧试验:取10g氢氧化铝放入200mL的刚玉坩埚中,放入马弗炉中以10℃/min速度升温至预定温度,保温90min,室温条件下冷却后,送样进行粒度分析、灼减、XRD分析和SEM分析。
2 实验结果与讨论
2.1 热分析实验结果
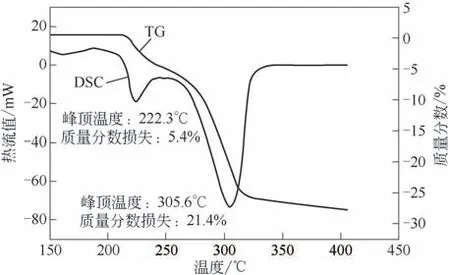
图1 1#样品DSC-TG曲线图
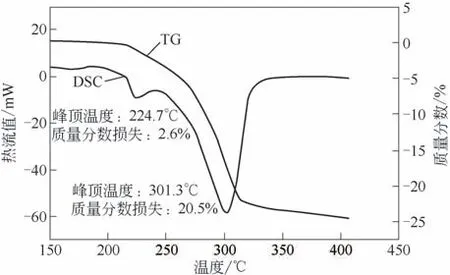
图2 2#样品DSC-TG曲线图
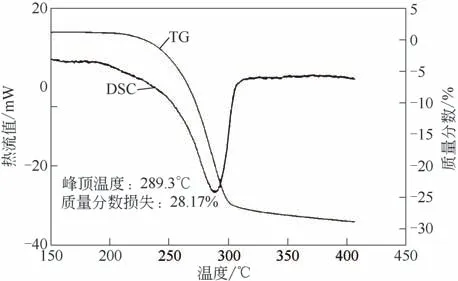
图3 3#样品DSC-TG曲线图
当升温速率为5℃/min 时,3 种不同粒度的氢氧化铝试样差热-热重(DSC-TG)分析结果见图1~图3。由图1可以看出,普通工业用氢氧化铝(1#样品)在升温过程中有两个明显的吸热峰,第一个吸热峰峰顶温度为222.3℃,第二个吸热峰峰顶温度为305.6℃,对应的温度处TG曲线均出现了失重,表明氢氧化铝发生相变。经研磨后的氢氧化铝(2#样品)在升温过程中同样有两个明显的吸热峰,第一个吸热峰峰顶温度为224.7℃,第二个吸热峰峰顶温度为301.3℃,对应的温度处TG曲线均出现了失重,表明氢氧化铝也发生相变。而实验室自制的亚微米氢氧化铝(3#样品)在升温过程中则只有1 个吸热峰,峰顶温度为289.3℃,TG 曲线出现了明显的失重,说明氢氧化铝发生了相变。
2.2 不同粒度对DSC曲线吸热峰的影响

图4 1#样品不同升温速率下DSC曲线图
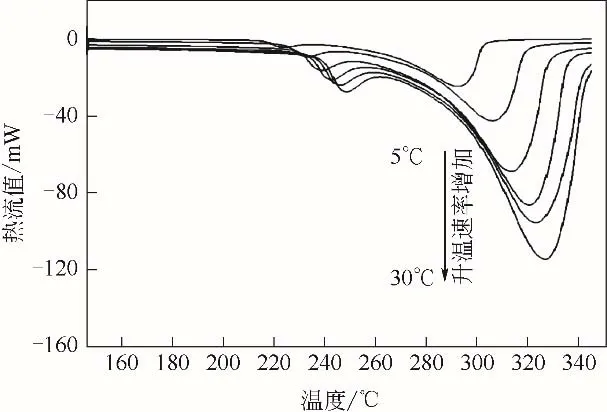
图5 2#样品不同升温速率下DSC曲线图
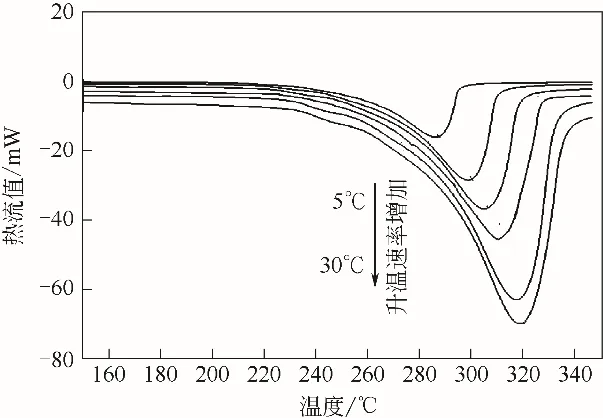
图6 3#样品不同升温速率下DSC曲线图
图4~图6 为3 种样品在不同升温速率下的DSC低温相变曲线图。图中曲线从上到下,升温速率分别为5℃/min、10℃/min、15℃min、20℃/min、25℃/min 和30℃/min。从图中可以看出,随着升温速率的增大,氢氧化铝的吸热峰逐渐向高温区移动;3种样品在不同升温速率下,DSC曲线峰形基本保持不变。对比图4~图6 中曲线还可以看出,在相同的升温速率下,随着氢氧化铝粒度的降低,DSC曲线的第一个吸热峰逐渐变得不明显且吸热峰对应的温度逐渐降低。图中曲线吸热峰曲线参数见表2,表中ω1/2为吸热峰的半高宽。
2.3 动力学分析
非等温相变动力学通常采用Ozawa 方程、Crane 方程和Kissinger 方程来计算活化能E、反应级数n以及指前因子A等相变过程的动力学参数。通过3种方法计算得到的动力学参数,分析粒度对氢氧化铝低温相变动力学的影响。
2.3.1 相变活化能E的计算
(1)Kissinger方程分析 Kissinger方程如式(1)所示[25]。
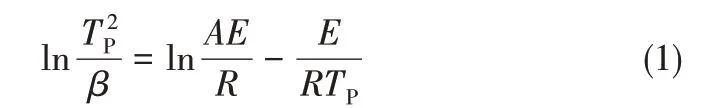
式中,β为升温速率,K/min;E为相变活化能,kJ/mol;R为普适气体常数;Tp为DSC 曲线上相变吸热峰处的绝对温度,K;A代表指前因子。对于确定的反应,活化能E和频率因子A为常数。因此式(1)中ln(T2p/β)对1/Tp作图,可以得到斜率为E/R的直线,通过直线斜率可以计算出相变活化能E的值。将表2 中的曲线参数值代入式(1)中,以ln()对1/Tp作图,结果见图7。在图7 中,所得曲线拟合的线性较好(R2均大于0.97),表明使用Kissinger方程分析氢氧化铝低温相变是可行的。
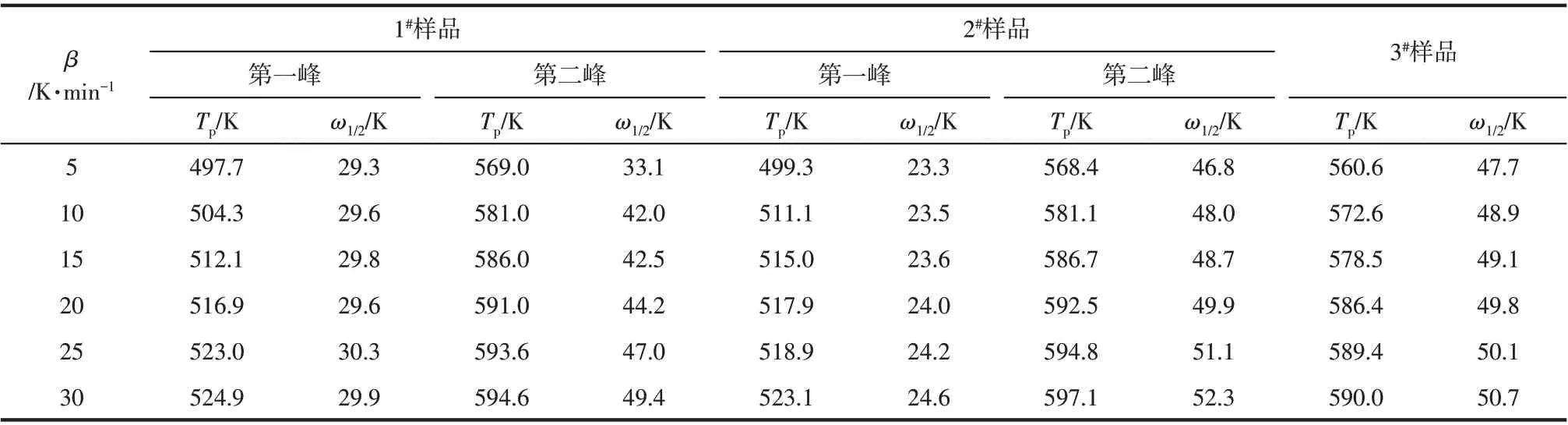
表2 不同升温速率下的DSC放热峰特征参数
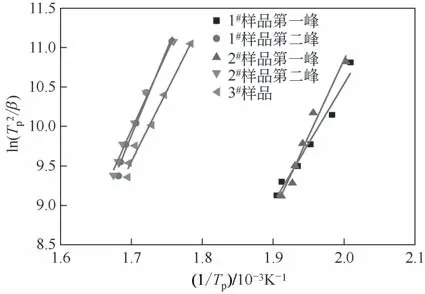
图7 基于Kissinger方程拟合的曲线
(2) Ozawa 方程分析 Ozawa 方 程如式(2)所示[25]。

式中,β为升温速率,K/min;E为相变活化能,kJ/mol;R为普适气体常数;Tp为DSC 曲线上相变吸热峰处的绝对温度,K;C为常数。式(2)中lnβ对1/Tp作图可以得到斜率为-1.052E/R的直线,通过直线斜率可以计算出相变活化能E的值。将表2 中的不同升温速率β对应的吸热峰处的温度Tp代入式(2)中,以lnβ对1/Tp作图,结果见图8。在图8中,所得曲线拟合的线性也较好(R2均大于0.97),故Ozawa方程也可以分析氢氧化铝低温相变。

图8 基于Ozawa方程拟合的曲线
根据Kissinger方程计算出的3个样品的相变活化能E值的结果见表3。从表3 中可以看出,当样品为普通工业用砂状氢氧化铝时,第一峰处相变活化能为125.24kJ/mol,第二峰处相变活化能为181.17kJ/mol,两个吸热峰的相变活化能差别较大。当氢氧化铝经研磨变细后,第一峰处相变活化能为161.38kJ/mol,高于普通氢氧化铝第一峰相变活化能,低于其第二峰相变活化能;第二峰处相变活化能为164.13kJ/mol,与第一峰相变活化能差距很小。当氢氧化铝为自制的亚微米氢氧化铝时,相变活化能最低,为148.41kJ/moll,且整个过程只有1 个吸热峰。
从表3中可以看出,使用Kissinger方程和使用Ozawa 方程所得相变活化能数据基本接近,根据Ozawa方程可以检验其它假设条件方程的优点,可以确定Kissinger方程假设的SDC峰顶为最大反应速率发生的位置,其一阶导数为零,与之相对应的温度为Tp;(1-αp)n-1与β无关,其值近视等于1,对于氢氧化铝低温相变反应都是成立的。
2.3.2 指前因子A和反应级数n的计算
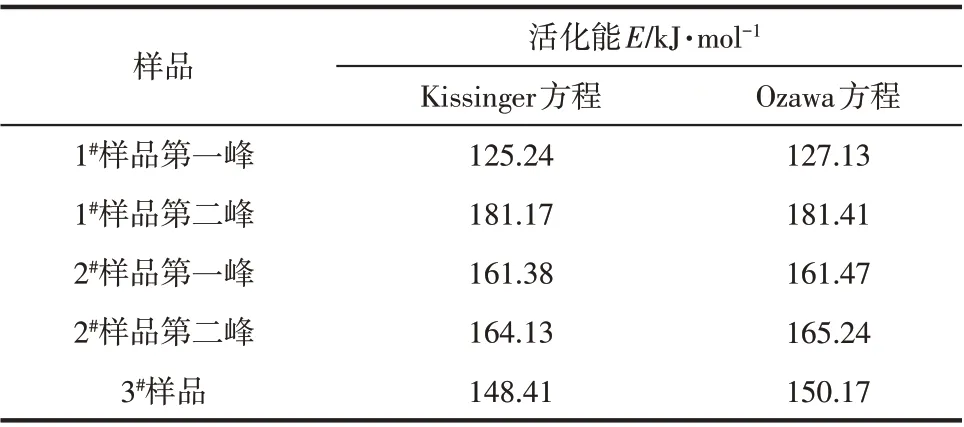
表3 基于Kissinger方程和Ozawa方程得到的相变活化能

表4 基于Kissinger方程得到的指前因子
根据Crane方程[27]dln(β)/d(1/Tp)=-E/nR+ 2Tp,由前所计算出的热力学数据可知,E/nR≫2Tp,因此上式中2Tp可忽略。由图8中lnβ对1/Tp直线,可以求得直线斜率K',然后又由公式n=-E/(K'R),求出低温相变过程的反应级数n。所得结果见表5。
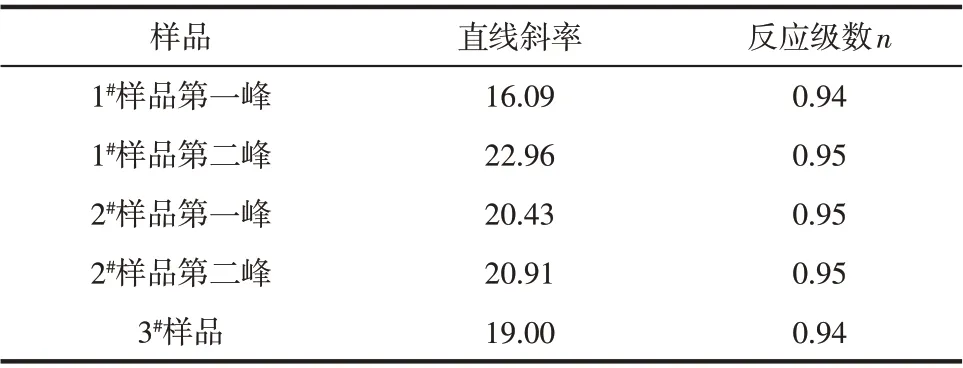
表5 基于Crane方程得到的反应级数
2.4 样品的表征
根据3 个样品吸热峰的温度范围,选取了220℃和300℃两个温度点煅烧试验,升温速度为10℃/min,保温时间为90min,保温时间结束后,自然降温至室温。将煅烧后样品进行粒度、SEM和XRD 分析,观测样品煅烧前后的变化情况。样品粒度分析结果见表6,样品灼减见表7,SEM 照片见图9,XRD分析图谱见图10和图11。

图9 未煅烧样品及220℃和300℃煅烧后样品SEM照片
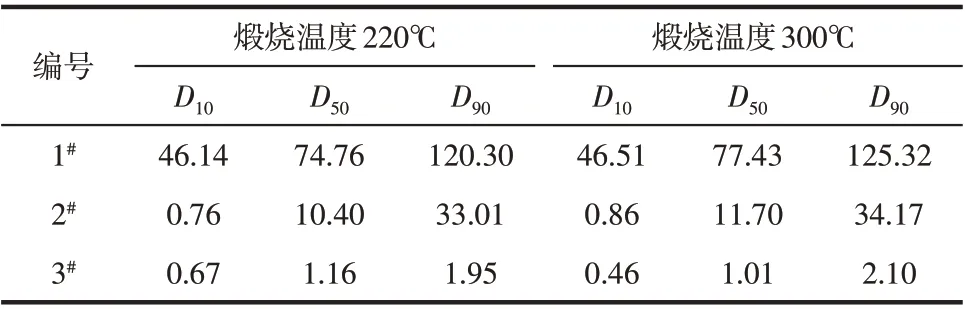
表6 样品煅烧后粒度分布

表7 样品煅烧后灼烧失量
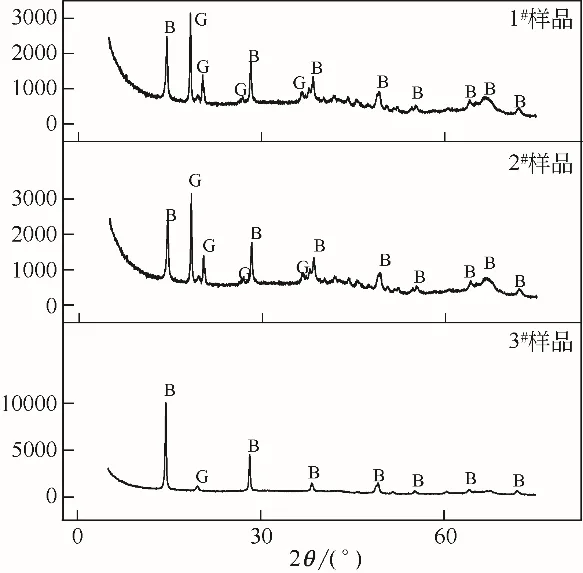
图10 各试样220℃煅烧90分钟后的XRD图谱
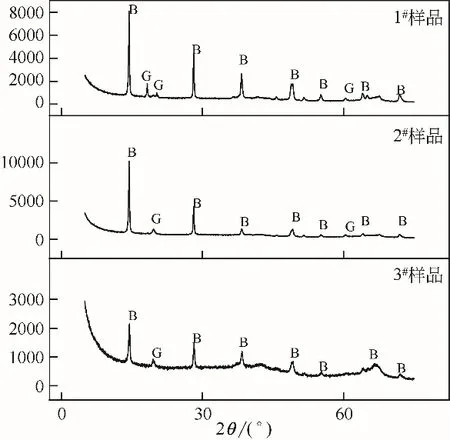
图11 各试样300℃煅烧90分钟后的XRD图谱
从表6 和图9 可以看出,3 个样品在220℃和300℃煅烧后,粒度和样品形貌和煅烧之前没有明显的变化。通过图10 和图11 的XRD 图谱可以看出,在220℃和300℃发生的相变反应也是一样的,即三水铝石脱水生成勃姆石,故样品中存在三水铝石和勃姆石两种物相形态。根据表7中煅烧后样品的灼烧失量结果可以看出,随着样品粒度的细化,煅烧后样品灼减逐渐降低,说明三水铝石含量逐渐减少,勃姆石的转化率逐渐升高。
3 结论
(1)采用三种动力学方程分析了氢氧化铝低温相变动力学过程,结果表明粒度越细,越有利于氢氧化铝向勃姆石的转变。普通砂状氢氧化铝在相变过程有两个较为明显的吸热峰,将砂状氢氧化铝研磨至中位径D50在12μm左右时,相变过程仍然有两个明显的吸热峰。而实验室采用改良工业生产技术条件制备的中位径D50在1μm 左右的氢氧化铝,相变过程则只有一个吸热峰。
(2)采用Kissinger方程计算出氢氧化铝相变过程的相变活化能,随着粒度的降低,其相变活化能也相应的降低,说明降低氢氧化铝粒径,有利于勃姆石的制备;通过Crane方程计算出氢氧化铝相变过程的反应级数n为0.94,说明其在低温过程,其发生的反应为氢氧化铝脱除结晶水生成勃姆石。
(3)氢氧化铝分别在220℃和300℃煅烧90min后,样品粒度和形貌都没有明显的变化。XRD 图谱显示,低温煅烧后,样品的主要物相为勃姆石,有少量三水铝石。粒径越细,勃姆石含量越高。
