DPPA2和Cyclin H在胃癌组织中的表达及临床意义
2020-03-31徐纪伟孙丹华
徐纪伟 孙丹华
胃癌是我国消化系统疾病中最常见的恶性肿瘤。在胃癌早期没有临床特异性症状及体征,导致临床诊断非常困难。当发现胃癌时已经成为进展期肿瘤,肿瘤细胞早已出现侵袭和转移,临床治疗效果不理想,患者预后较差,生存率较低。
细胞周期蛋白H的稳定表达能激活细胞周期蛋白依赖性激酶(cyclin-dependent-kinases,CDK)复合物发生磷酸化,从而精确调控细胞的整个生长、分裂及增殖的过程,若细胞周期蛋白H出现异常表达情况就会造成细胞周期进程失控的局面,刺激细胞不断发生分裂出现无限制的增殖情况,最终会导致机体出现恶性肿瘤。
多能性相关基因2 (developmental pluripotency associated gene 2,DPPA2)是近几年在多能性细胞中新发现的特异表达基因,与机体发育过程中细胞的多能性密切相关。目前研究发现,在细胞增殖、部分肿瘤以及胚胎发育过程中DPPA2呈现高表达状态,而在细胞分化过程中DPPA2却呈现逐渐减少趋势,直到成体组织中呈现出不表达或微弱表达。DPPA2存在着进化保守序列SAP结构域,可以介导蛋白与特异的DNA结合,还可以作为转录因子直接结合靶基因的启动子区,通过表观遗传调控胚胎干细胞的染色体结构重塑、细胞核构建及RNA代谢过程[1,2]。目前有关发育多能性相关基因2和细胞周期蛋白H的研究还没有涉及到胃癌组织,需要对此开展深入的研究报道。
本研究测定组织内DPPA2和Cyclin H的表达情况,分析DPPA2和Cyclin H与临床病理参数之间的相关性,探讨其在胃癌的发生、发展过程中内在关系。
材料与方法
1.材料:60例胃癌组织和对应癌旁组织(距离边缘2cm)均来自漯河医学高等专科学校附属医院2010年5月~2015年5月期间就诊的患者。其中,男性36例,女性24例,患者年龄26~77岁,平均年龄是52.5±2.5岁,按照WHO胃癌组织学分类分级标准将样本归类如下:分化程度:高分化13例,中分化19例,低分化28例;肿瘤直径分级:<5cm有27例,≥5cm有33例;浸润深度:黏膜下6例,浅肌层15例,深肌层28例,外膜11例。手术前所有患者均没有经过任何化学药物治疗及放射性治疗,通过手术切除肿瘤组织后,经病理诊断证实为胃癌。本研究所有实验均通过漯河医学高等专科学校医学伦理学委员会批准通过,标本采集和研究过程均符合赫尔辛基宣言。所有患者均明确本研究内容并签署知情同意书。
2.主要试剂和仪器:羊抗人DPPA2多克隆抗体、鼠抗人Cyclin H多克隆抗体(美国圣鲁克兹生物公司),兔抗人β-actin多克隆抗体、生物素标记羊抗兔抗体(武汉博士德生物工程有限公司),生物素标记兔抗山羊抗体、生物素标记马抗鼠抗体、ABC试剂(北京中杉生物技术有限公司),RM2235型切片机(德国Leica公司)。
3.免疫组化:将切片先放置100μl的10%小牛血清封闭,室温放置30min,切片滴加羊抗人DPPA2多克隆抗体(1∶300倍稀释)或鼠抗人Cyclin H多克隆抗体(1∶100倍稀释),4℃过夜,用PBS洗除一抗,再加入生物素标记兔抗山羊抗体或生物素标记马抗鼠抗体,室温放置30min,用PBS洗除二抗,加入ABC 试剂,DAB 染色。阴性对照不加入一抗,只加入二抗。
4.Western blot法检测:蛋白样品上样,行SDS-聚丙烯酰胺凝胶电泳后转到PVDF,置脱脂奶粉(50g/L)TBST液中2h,用TBS漂洗,加入DPPA2多克隆抗体、Cyclin H多克隆抗体、β-actin多克隆抗体(1∶1000),4℃放置12h,用TBS洗除一抗,加入生物素标记兔抗山羊抗体或生物素标记马抗鼠抗体或生物素标记羊抗兔抗体(1∶1000),放置2h,用TBS洗除二抗,加入ABC试剂,避光放置1h,用TBS漂洗,加入DAB,查看结果,测目的条带与β-actin条带灰度比值。
5.免疫组化结果判定:切片DPPA2或Cyclin H细胞染色强度分级计分标准:细胞基本没颜色记0分,呈浅黄色记1分,呈棕黄色记2分,呈棕褐色记3分。切片阳性细胞百分比分级计分标准:200倍阳性细胞率<10%记0分,10%~25%记1分,26%~50%记2分,51%~75%记3分,>75%记4分。将切片内DPPA2或Cyclin H染色强度和阳性细胞百分比评分相乘,≤1分是阴性表达,1~3(不含1)分是低水平表达,>3分是高水平表达。
6.Western blot法结果判定:应用图像分析软件对Western blot法检测条带进行密度扫描,通过测定DPPA2、Cyclin H和β-actin的条带灰度值,计算各种组织的DPPA2和Cyclin H蛋白相对表达量,相对表达量=A目的蛋白/Aβ-actin×100%。
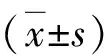
结 果
1.免疫组化检测DPPA2和Cyclin H表达:通过对胃癌组织、对应癌旁组织进行免疫组织化学染色,发现DPPA2主要出现于细胞核,Cyclin H主要出现于细胞膜和细胞质。DPPA2和Cyclin H在胃癌组织内的表达水平均明显高于癌旁组织,DPPA2和Cyclin H在胃癌组织中的阳性率分别为91.7%(55/60)和90.0%(54/60),而两者在对应癌旁组织中的阳性率分别为8.30%(5/60)和6.67%(4/60),差异均有统计学意义(χ2=80.056,P=0.000;χ2=83.705,P=0.000)。Spearman相关分析结果显示,胃癌组织中DPPA2与Cyclin H蛋白表达呈显著正相关(r=0.754,P=0.029,图1)。
图1 免疫组化检测DPPA2和Cyclin H在两种组织中的表达(×400)A.胃癌组织中DPPA2的表达;B.癌旁组织中DPPA2的表达;C.胃癌组织中Cyclin H的表达;D.癌旁组织中Cyclin H的表达
2.Western blot法检测DPPA2和Cyclin H的表达:Western blot法检测得到的PVDF膜在对应的分子量区域(38kDa)可以观察到一条抗原条带,即检测的Cyclin H组织蛋白条带,在对应的相对分子质量区域(34kDa)可以观察到另一条抗原条带,即检测的DPPA2组织蛋白条带。通过数据分析发现胃癌组织中DPPA2和Cyclin H呈现明显的高水平表达,而癌旁组织中发现他们呈现少量表达(P<0.01),和免疫组化的结果一致(图2)。

图2 DPPA2和Cyclin H相对值1、3、5分别为3例患者的癌组织;2、4、6分别为3例患者的癌旁组织
3.DPPA2和Cyclin H表达与胃癌临床病理特征的关系:DPPA2蛋白表达与胃癌临床病理资料的相关性分析结果显示,DPPA2蛋白与肿瘤分化(χ2=9.706,P=0.046)、浸润深度(χ2=7.376,P=0.025)及淋巴结转移(χ2=8.205,P=0.017)呈显著相关性,而与性别(χ2=3.749,P=0.153)、年龄(χ2=0.523,P=0.770)、肿瘤直径(χ2=0.302,P=0.860)和TNM分期(χ2=3.579,P=0.167)无相关性。Cyclin H蛋白表达与胃癌临床病理特征的相关性分析结果显示,Cyclin H蛋白与淋巴结转移(χ2=6.101,P=0.047)呈显著相关性,而与性别(χ2=0.741,P=0.690)、年龄(χ2=2.048,P=0.359)、肿瘤直径(χ2=1.414,P=0.493)、肿瘤分化(χ2=4.556,P=0.336)、浸润深度(χ2=0.600,P=0.741)和TNM分期(χ2=1.026,P=0.599)无相关性(表1)。
讨 论
细胞周期蛋白H在广泛分布于真核细胞中,是一种含323个氨基酸残基、分子量为38kDa的细胞周期调控蛋白,分子结构包含两个A螺旋,但是没有B片层,与周期蛋白C具有明显同源性,通过结合细胞周期蛋白依赖性激酶7形成CDK活化激酶复合物而发挥生物学作用,保持细胞进行正常分裂增殖[3]。同时细胞周期蛋白H还是转录因子ⅡH亚基的组成部分,参与细胞周期调控、Ⅱ型转录和核苷酸切除修复。目前研究表明,细胞周期蛋白H在子宫内膜癌、乳腺癌以及恶性黑色素瘤等多种恶性肿瘤细胞中均出现明显表达,并且它的表达水平可达到非转化细胞的1.4~3.0倍,与此同时相应CDK活化激酶的抑制因子表达水平则出现明显下降,导致大量的CDK活化激酶出现异常激活,进而整个细胞周期调控过程失衡,细胞周期的频率加快,最终促使细胞出现大量分裂增殖情况,因此细胞周期蛋白H异常表达在肿瘤的发生、发展过程中具有重要意义。
笔者研究发现胃癌组织中有大量Cyclin H的表达,这是由于Cyclin H是CDK活化激酶复合物重要的调节亚基,肿瘤组织中过度表达可以缩短细胞周期、促进细胞增殖。CDK活化激酶复合物是由Cyclin H、
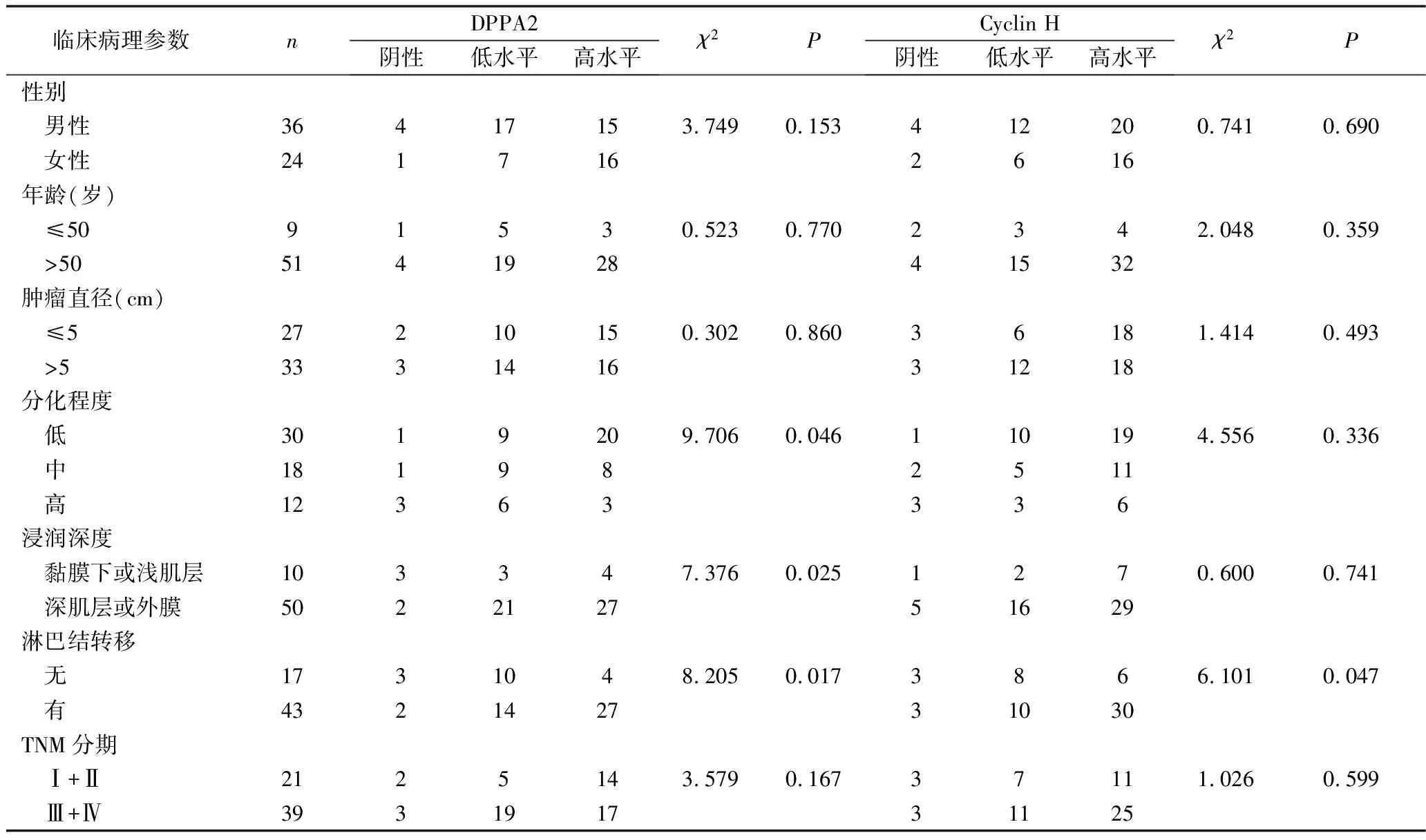
表1 DPPA2和Cyclin H表达与胃癌临床病理特征的关系
CDK7和MAT1结合成的复合体,其中CDK7作为催化亚单位、Cyclin H作为调节亚单位,Cyclin H激活CDK7并结合形成异源二聚体,再与MAT1的结合促使活性进一步提高[4]。Cyclin H高表达状态可以合成大量CDK活化激酶复合物,促使细胞快速通过细胞周期调控的限定点,通过磷酸化有丝分裂型细胞周期蛋白Cyclin A、Cyclin B,促使细胞由G2期进入M期,还可激活G1期细胞周期蛋CDK2/Cyclin E2,释放E2F2转录因子,遗传物质DNA呈现高转录状态,促使细胞自G1期进入S期,从而导致细胞周期缩短、加快细胞增殖[5]。同时Cyclin H还可以通过促使RNA聚合酶Ⅱ大亚基发生磷酸化,从而发挥调控细胞周期过程、mRNA基因启动子转录和核苷酸切除修复的生物学作用。此外有研究表明Cyclin H过表达可以明显促进黏着斑激酶FAK磷酸化,与胞质内相应的功能蛋白发生相互作用,从而导致肿瘤细胞的黏附能力下降,容易发生迁移;若是抑制Cyclin H表达则会抑制黏着斑激酶FAK磷酸化,从而促进肿瘤细胞的黏附能力,抑制肿瘤细胞的迁移,这与笔者的研究结果一致[6]。
人DPPA2基因定位于第3号染色体上,包括9个外显子和8个内含子,其cDNA编码区长度为1393kb,主要编码由298个氨基酸残基组成的多肽。DPPA2的氨基端存在着进化保守序列SAP结构域,它由35个氨基酸残基组成,包括疏水氨基酸和极性氨基酸两部分,有研究表明SAP结构域剔除后,ZAR1L表达受到抑制,会导致受精卵分裂到2细胞期就停止,同时组蛋白去甲基化及染色体结构的重新组织构建,最终生殖细胞发育停滞[7]。此外,多能性细胞从细胞增殖到细胞分化的转换过程中要经历染色质调节、非编码RNA和组蛋白修饰,需要有esBAF染色质重塑复合体等表观遗传学因子参与,复合体含有Brg1和BAF155的蛋白产物,是多能性细胞的核心基因转录调控网络组成部分[8]。DPPA2可以结合Brg1和BAF155,与染色质重塑复合体相互作用,抑制多能性细胞分化,参与细胞多能性的表观遗传调控[9]。研究人员发现在成肌细胞分化阶段MyoD可以促使长链非编码RNA大量出现,长链非编码RNA引导DNA甲基转移酶家族成员Dnmt3a、Dnmt3b和Dnmt1结合到DPPA2的启动子区域,将其CpG岛甲基化,最终沉默DPPA2表达,促进细胞分化,这从另一方面说明DPPA2对抑制细胞分化有重要作用[10]。
研究发现,在卵巢癌组织中的肿瘤相关抗原PLAC1(CT92)及DPPA2均呈现阳性表达,同时还发现DPPA2阳性表达部位与肿瘤干细胞增殖分化高度依赖干细胞niche位于相同区域,这些情况说明在肿瘤干细胞内DPPA2是一类肿瘤相关抗原,成为肿瘤抗原特异性免疫治疗的新靶点[11]。研究发现成纤维细胞经过丁酸诱导处理后,可以促使组蛋白H3发生乙酰化,诱导多能性相关基因启动子DNA发生去甲基化,从而大大提升了DPPA2表达水平,从而高效促进重编程的进行,因此DPPA2作为一种染色质重塑因子,在体细胞重编程过程中由沉默状态转为激活状态,促使细胞表观遗传信息改变,从而导致成体细胞重新转为多能性干细胞的状态[12]。另外采用染色质修饰剂曲古菌素A和5-氮胞苷处理神经球细胞,可以促使包括DPPA2在内的多种干细胞多能性相关基因呈现高水平表达,加强组蛋白乙酰化和DNA去甲基化,最终激发神经球细胞的分化潜能,导致其横向分化出造血能力[13]。
研究发现,在通过对绵羊慢病毒易感性基因筛选过程中发现DPPA2的SNP位点和慢病毒感染率高度相关,这是由于DPPA2存在于精液和生殖道中,通过垂直传播参与慢病毒的感染过程[14]。此外研究人员还通过染色体免疫共沉淀的实验技术中发现DPPA2出现于胚胎发育早期,DPPA2在胚胎干细胞中与Nkx2-5的调节区域结合,对肺部的生长发育有重要作用,还参与免疫系统的发育与功能维持[15]。因此DPPA2既可以通过生殖系统参与慢病毒感染,还可以通过调控免疫系统和白细胞的形成参与慢病毒感染[16]。DPPA2可以通过结合靶基因启动子区调控基因转录水平,或通过表观遗传方式调控染色体结构的组织构建,或在肿瘤干细胞内DPPA2作为肿瘤相关抗原大量表达,或是作为染色质重塑因子,在体细胞重编程过程中由沉默状态转为激活状态,促使体细胞重新转为多能性干细胞,DPPA2由于具有干细胞的多能性,所以研究人员常将其应用于细胞鉴定。
笔者研究发现在低分化胃癌组织中DPPA2大量表达,这是由于DPPA2的编码蛋白主要定位于细胞核中,由核转运蛋白KPNA7介导DPPA2基因,激活细胞碱性磷酸酶活化,促进SOX2/OCT4干性调节复合物形成,增强NANOG表达,促进肿瘤细胞增殖,减少FST、PSX1等早期分化标志基因表达,抑制细胞分化。已有研究发现在胚胎发育过程中,随着细胞增殖减少而细胞逐渐开始转入分化阶段,DPPA2的表达也开始发生下调,这与本研究结果相结合,更进一步证实了DPPA2主要是促进细胞增殖而抑制细胞分化。
目前研究发现,在胚胎干细胞中细胞周期蛋白依赖性激酶CDK2可以激活SOX2发生磷酸化,通过调节OCT4、KLF4诱导神经细胞、成纤维细胞重编程为多能性细胞[17]。该作用在重编程过程中建立多能性状态是必需的,但是不能维持多能性细胞的发育,因此通过CDK2蛋白介导的SOX2磷酸化仅促进细胞多能性状态的建立,而不能促进细胞发育[18]。本研究发现胃癌组织中Cyclin H有大量表达,推测它可以通过CDK2介导SOX2大量磷酸化,促进细胞多能性状态的建立,同时Cyclin H大量表达还可以促使细胞自G1期快速进入S期,从而导致细胞周期缩短、调控细胞增殖,并且SOX2大量激活,也可以促进E2F2转录因子释放,更进一步激活CDX1/2,最终反馈促进DPPA2大量表达[19]。
目前研究发现,在肿瘤细胞中NANOG、OCT4阳性表达水平越高表明肿瘤细胞分化程度越低,恶性度越高,并且NANOG、OCT4大量表达可以通过调节MMP2降解细胞外间质中的各种蛋白成分,重组细胞骨架,减少细胞黏附和促进细胞迁移,可见NANOG、OCT4的表达与肿瘤细胞的恶性程度及转移趋势是呈正相关的。本研究发现在低分化和有淋巴转移的胃癌组织中DPPA2大量表达,推论它主要是通过促进NANOG、OCT4阳性表达水平升高,导致肿瘤细胞分化度低且容易发生转移。
DPPA2和Cyclin H在人胃癌组织中呈现高水平表达,对胃癌的发生、发展及患者预后具有重要意义,可以作为胃癌恶性程度和预后不良的标志,在临床诊断治疗方面具有重要指导意义,但是胃癌的具体发病机制仍不清楚,希望在以后的研究中能够对DPPA2和Cyclin H进行更加深入地了解。
