急性肝衰竭小鼠血清与组织中PTX3、HBP、PCT及IL-6、IL-1β、TNF-α的变化及诊断价值
2020-03-31石春霞焦方舟龚作炯
石春霞 陈 倩 王 瑶 焦方舟 龚作炯
急性肝衰竭(acute liver failure, ALF),也称暴发性肝衰竭,是由多种原因引起的严重肝脏损害,病情进展迅速,病死率高,预后差,并且缺乏有效的治疗方法,严重威胁患者的生命健康。影响ALF生存率的因素包括病因、年龄、脑病的严重程度、肝坏死的程度以及患者是否有其他疾病等[1]。肝脏活检显示有大量肝细胞坏死和不同程度的肝脏炎症[2]。全身炎性反应综合征(systemic inflammatory response syndrome, SIRS)及其伴随的多器官功能衰竭通常是患者死亡的主要原因[3]。因此,炎性反应是ALF进展过程中的一个重要因素。PTX3、HBP及PCT是近些年发现的炎性指标。本实验用D-氨基半乳糖联合脂多糖诱导小鼠急性肝衰竭模型,检测小鼠血清与肝脏、脾脏、小肠组织中PTX3、HBP、PCT及IL-6、IL-1β、TNF-α的水平,探讨PTX3、HBP、PCT及IL-6、IL-1β、TNF-α水平变化的意义以及各项指标的诊断价值。
材料与方法
1.实验材料:(1)动物:选取32只8周龄,雄性,无特定病原体级C57BL/6小鼠,体质量20~25g,购自湖南斯莱克景达实验动物有限公司。(2)药物与试剂:D-氨基半乳糖盐酸盐(D-galactosamine, D-Gal)和脂多糖(lipopolysaccharide, LPS)购自美国Sigma-Aldrich公司。PTX3试剂盒购自上海江莱生物科技有限公司、HBP试剂盒购自上海江莱生物科技有限公司、PCT试剂盒购自上海联硕生物科技有限公司、IL-6试剂盒购自武汉伊莱瑞特生物科技股份有限公司、IL-1β试剂盒购自武汉伊莱瑞特生物科技股份有限公司、TNF-α试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
2.方法:(1)动物模型的制备与取材:将32只小鼠随机分为两组:①模型组16只,小鼠在禁食后12h腹腔注射D-Gal(400mg/kg)和LPS(100μg/kg)制备ALF模型;②正常组16只,于小鼠腹腔内注射等量0.9%氯化钠注射液。12h后处死小鼠。采血,分离血清,-80℃冻存备检。同时留取肝脏、脾脏、小肠组织。组织匀浆的比例按照10%进行(即1g组织加9ml的匀浆液),匀浆液选取磷酸缓冲盐溶液(phosphate buffer saline, PBS),浓度为0.01mol/L,pH值为7.2~7.4。将称取重量的样本剪碎,放入碾钵中,加入匀浆液,匀浆器匀浆,5000r/min离心15min取上清液,-80℃冻存备检。(2)肝组织病理形态学观察:取小鼠肝组织约0.3cm×0.4cm于质量浓度为40g/L的多聚甲醛溶液中固定,行常规石蜡包埋,切片后行HE染色,光镜下观察肝组织结构。其余肝组织冻存备检。(3)血清肝功能的检测:采用生化法检测血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和总胆红素(TBIL)水平。(4)血清及组织 PTX3、HBP、PCT、IL-6、IL-1β、TNF-α水平的检测:采用ELISA法检测小鼠血清及肝脏、脾脏、小肠组织PTX3、HBP、PCT、IL-6、IL-1β、TNF-α的表达水平,操作步骤严格按照试剂盒说明书进行。
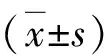
结 果
1.两组小鼠肝组织病理形态学变化:HE染色结果显示,正常组小鼠肝小叶结构清晰完整,肝细胞形态正常,无变性和坏死,无炎性细胞浸润;模型组小鼠肝组织结构严重紊乱,肝细胞大片坏死,可见大量炎性细胞浸润,详见图1。

图1 小鼠肝组织HE染色(×200)A.正常组;B.模型组
2.两组小鼠血清肝功能水平变化:正常组小鼠血清ALT、AST、TBIL水平很低,分别为29.7±8.7U/L、27.7±9.5U/L、3.4±0.7U/L,而模型组小鼠血清ALT、AST、TBIL水平显著升高,分别为2986.2±319.4U/L、2668.8±227.9U/L、91.3±12.2U/L,差异有统计学意义(P<0.05),详见表1。

表1 两组小鼠血清肝功能指标比较(U/L)
与正常组比较,*P<0.05
3.两组小鼠血清及组织PTX3、HBP、PCT及IL-6、IL-1β、TNF-α水平变化:正常组小鼠血清及肝脏、小肠组织中也可检测到PTX3,但模型组小鼠血清及肝脏、小肠组织中PTX3显著升高,差异有统计学意义(P<0.05);正常组小鼠与模型组小鼠脾脏组织中PTX3水平比较,差异无统计学意义(P>0.05)。与正常组小鼠比较,模型组小鼠血清及肝脏、脾脏、小肠组织中HBP、PCT及IL-6、IL-1β、TNF-α均有升高,差异有统计学意义(P<0.05),详见图2。

图2 两组小鼠血清及组织各指标表达水平A.两组小鼠血清及组织PTX3表达水平;B.两组小鼠血清及组织HBP表达水平;C.两组小鼠血清及组织PCT表达水平;D.两组小鼠血清及组织IL-6表达水平;E.两组小鼠血清及组织IL-1β表达水平;F.两组小鼠血清及组织TNF-α表达水平。与正常组比较,*P<0.05
4.ROC曲线分析:各指标的ROC曲线详见图3。PCT的诊断效能最高,其AUC为0.941,cut-off值为35.2pg/ml,敏感度为93.8%,特异性为87.5%,阳性预测值为88.2%,阴性预测值为93.3%;PTX3其次,AUC为0.859,cut-off值为475.4pg/ml,敏感度为81.3%,特异性为87.5%,阳性预测值为86.7%,阴性预测值为82.4%;TNF-α的诊断效能最低,其AUC为0.695,cut-off值为54.5pg/ml,敏感度为68.8%,特异性为62.5%,阳性预测值为64.7%,阴性预测值为66.7%;HBP的AUC为0.844,cut-off值为17.3pg/ml,敏感度为75.0%,特异性为81.2%,阳性预测值为80.0%,阴性预测值为76.5%;IL-6的AUC为0.832,cut-off值为50.1pg/ml,敏感度为81.3%,特异性为68.7%,阳性预测值为72.2%,阴性预测值为78.6%;IL-1β的AUC为0.762,cut-off值为15.7pg/ml,敏感度为75.0%,特异性为62.5%,阳性预测值为66.7%,阴性预测值为71.4%,详见表2。

图3 各指标的ROC曲线A.PTX3;B.HBP;C.PCT;D.IL-6;E.IL-1β;F.TNF-α
讨 论
ALF患者病情进展迅速,病死率高,预后差,因此对ALF进行早期和可靠的诊断非常重要。目前认为ALF肝损伤的主要机制是病原体等导致的直接损伤和内毒素、细胞因子等所介导的继发性损伤。其中,免疫反应的激活和炎性因子的过量产生在ALF中发挥着重要作用[4]。因此,炎性反应是ALF发生、发展的重要环节。

表2 各项指标的诊断效能
PTX3、HBP及PCT参与多种疾病的炎性反应过程,是近些年发现的炎性指标。PTX3和超敏C反应蛋白(high sensitive C reaction protein, hs-CRP)、血清淀粉样蛋白A(serum amyloid A, SAA)同属于正五聚蛋白超家族,hs-CRP和SAA是典型的短正五聚蛋白,而PTX3则是长正五聚蛋白的主要成员,与短正五聚蛋白在染色体定位、基因表达、细胞来源和配体等方面存在差异[5]。正常情况下PTX3储存在中性粒细胞特定的颗粒中,在细菌感染等炎症刺激下被激活释放到细胞外,释放的PTX3定位于中性粒细胞外诱捕网(neutrophil extracellular traps, NETs),在感染中发挥非冗余作用[6]。在许多炎症中,PTX3是较早出现的生物学标志物,相比CRP,与预后的关系更密切[7]。
受伤的肝脏库普弗细胞、内皮细胞和胆管上皮细胞也能够产生PTX3,本实验中ALF模型小鼠血清及肝脏、小肠组织中PTX3的表达水平高于正常小鼠(P<0.05),这表明PTX3可以反映机体的炎症和损伤,并且ROC曲线显示其曲线下面积为0.859,敏感度为81.3%,特异性为 87.5%,诊断价值高于IL-6、IL-1β、TNF-α(曲线下面积分别为0.832、0.762、0.695)。本实验结果两组小鼠脾脏组织中PTX3水平比较,差异无统计学意义(P>0.05),其原因可能是脾脏组织中炎症轻微,PTX3升高不明显以及小鼠个体化差异所致。另外有报道显示PTX3对感染引起的器官损伤具有保护作用。在由鼠肝炎病毒1(MHV-1)感染引起的严重急性呼吸综合征小鼠模型中,PTX3缺乏增加了肺中性粒细胞和巨噬细胞的早期浸润,PTX3缺失小鼠表现出比野生型小鼠更严重的肺损伤[8]。PTX3在无菌性炎症中也有保护作用的报道,如急性肺损伤、脑缺血等[9,10]。因此,PTX3被认为是调控早期中性粒细胞的负反馈机制,可能作为初始炎性反应的内在微调因子,限制过度炎症诱导的组织损伤,这表明PTX3升高可能是对ALF小鼠肝功能的一种保护机制[5]。
HBP是存在于中性粒细胞嗜天青颗粒和分泌囊泡中的一种蛋白分子,由于其具有极强结合肝素的能力,因而被命名为肝素结合蛋白[11]。二者结合后HBP的活性受到明显抑制。当机体受到感染后,细菌蛋白或IL-8等趋化因子激活中性粒细胞,释放大量HBP,HBP可以影响血管内皮细胞的通透性,导致血管渗漏,还具有杀菌、趋化以及调节炎症的作用[12]。HBP还可以结合LPS,但与LPS结合后产生何种作用尚不清楚[13]。在脓毒症导致的急性肾损伤的24h内,HBP的表达显著增加,进一步加重肾脏损害,在肾损伤的早期炎性反应中起着重要作用[14]。本实验结果显示,ALF模型小鼠血清及肝脏、脾脏、小肠组织中HBP的表达水平均高于正常组小鼠(P<0.05),这与其他研究结果一致,ROC曲线显示其曲线下面积为0.844,cut-off值为17.3pg/ml,敏感度为75.0%,特异性为81.2%,诊断效能高于IL-6、IL-1β、TNF-α。由于HBP在炎症发生之前就已经储存在中性粒细胞中,受到刺激后被迅速释放,并且可以影响多种细胞类型。因此HBP可以作为早期炎症的标志物,及早发现炎症的发生,并给予干预,这对于急性肝衰竭的早期诊断以及延缓ALF的快速进展具有重要意义[12]。
PCT是降钙素的前体,含有116个氨基酸,由甲状腺的滤泡旁细胞分泌[15]。正常情况下,PCT都转化为降钙素,因此健康个体的PCT浓度很低。LPS是PCT的强烈刺激因素,当机体收到细菌等微生物入侵时,所有实质细胞均被激活产生PCT,PCT水平会显著升高,并且其浓度与感染严重程度呈正相关。在炎症过程中,PCT生成主要受到两种机制刺激:一是细菌内毒素或LPS的直接刺激,二是受到炎性介质如TNF-α、IL-1、IL-6的间接刺激[16]。机体感染后,PCT在2~6h内显著升高,6~24h达到峰值[17]。PCT水平在感染症状出现之前就已经升高,还被应用于指导脓毒症及脓毒性休克患者的抗生素治疗[18]。有研究表明,PCT对严重腹腔炎症患者的预后评估具有特异性强、敏感度高的优点,比CRP、IL-6等传统炎性指标具有更高的敏感度与特异性,这与本实验结果一致[19]。本实验结果显示,ALF模型小鼠血清及肝脏、脾脏、小肠组织中PCT的表达水平均高于正常组小鼠(P<0.05),ROC曲线显示其曲线下面积为0.941,敏感度为93.8%,特异性为87.5%,诊断效能高于IL-6、IL-1β、TNF-α。目前,PCT已经在临床上广泛应用,在多种疾病中包括急性肝衰竭,都具有良好的辅助诊断功能。
本研究结果表明,PTX3、HBP、PCT可以用于急性肝衰竭早期的辅助诊断,其cut-off值分别为475.4、17.3、35.2pg/ml,并且较IL-6、IL-1β、TNF-α的诊断效能高。在正常组小鼠血清及组织中检测到PTX3、HBP、PCT水平较低,而模型组小鼠血清及组织中PTX3、HBP、PCT水平明显升高,提示PTX3、HBP、PCT可能在急性肝衰竭的发生、发展中起着重要作用,PTX3、HBP、PCT可能是参与急性肝衰竭时器官组织功能障碍的重要介质。
