骨髓间充质干细胞源外泌体对软骨细胞迁移、增殖和凋亡的影响
2020-03-31景金珠
孟 迪 景金珠 王 莹 梁 震
骨关节炎(osteoarthritis, OA)为常见的慢性退行性疾病,多发于中老年人,病变累及整个关节,危害严重,目前临床上尚无有效的治疗手段[1]。近年来,间充质干细胞(mesenchymal stem cell, MSC)为OA治疗带来曙光,研究证实其可有效修复OA软骨损伤[2]。但是,MSCs治疗存在致瘤性、异常堆积等诸多亟待解决的问题,限制了其临床应用。研究表明,MSC的治疗效果主要来自于外泌体(exosome)介导的旁分泌途径[2~4]。MSCs分泌的exosome(MSC-Exo)存在与其来源亲本干细胞类似的功能,且与MSC治疗比较,具有更加简便、安全、稳定等优势[4,5]。最新研究结果显示,MSC-Exo可促进OA关节软骨再生,但相关机制尚不明确[6~9]。软骨细胞是关节软骨内唯一的细胞成分,因此本研究以软骨细胞为研究对象,检测骨髓间充质干细胞源外泌体(BMSC-Exo)对软骨细胞迁移、增殖和凋亡的影响,初步探索BMSC-Exo修复OA关节软骨损伤的机制,为OA的临床防治提供更为广阔的思路,为探索新型“无细胞”治疗方法奠定基础。
材料与方法
1.材料:(1)实验动物:SPF级SD大鼠购自北京维通利华实验动物技术有限公司[SCXK(京)2013-0011]。(2)主要仪器:恒温CO2培养箱(美国Thermo Fisher公司);低温离心机(美国Sigma公司);超速离心机(美国Beckman公司);透射电子显微镜(日本Hitachi公司);倒置相差显微镜(日本Olympus公司);流式细胞仪(美国BD公司);酶标仪(美国Molecular Devices公司)。(3)主要试剂:α-MEM、低糖DMEM培养基(美国Hyclone公司);澳洲胎牛血清(美国Gibco公司);0.25%胰酶(美国Life Technologies公司);Ⅱ型胶原酶(美国Sigma公司);无外泌体血清、anti-CD63抗体、anti-CD81抗体、anti-Tsg101及二抗(美国System Biosciences公司);IL-1β(美国PeproTech公司);SD大鼠骨髓间充质干细胞成骨、成脂诱导分化培养基(中国赛业公司);BCA蛋白浓度测定试剂盒、Annexin Ⅴ-FITC细胞凋亡检测试剂盒、CCK-8试剂盒(中国碧云天公司)。
2.BMSC的分离与培养:6~8周龄雄性SD大鼠,处死后于无菌条件下分离股骨和胫骨,剪断两端干骺端,用含10%FBS的α-MEM培养基反复冲洗骨髓腔直至变白,收集冲洗液并吹打成单细胞悬液,1000r/min离心5min,弃去上清,加入适量含10%FBS的α-MEM培养基制备成细胞悬液,置于37℃、5% CO2培养箱中培养。24~48h后更换培养基以去除未贴壁细胞,之后每2天换液1次,至细胞密度80%~90%时,用0.25%胰蛋白酶消化,按1∶2比例传代。使用第3~5代细胞用于实验。
3.BMSC多向分化能力鉴定:(1)成骨诱导分化:取第3代BMSC,使用SD大鼠骨髓间充质干细胞成骨诱导分化培养基试剂盒,按照说明书步骤进行诱导分化,诱导3周后进行茜素红染色,光学显微镜下观察矿化结节形成情况。(2)成脂诱导分化:取第3代BMSC,使用SD大鼠骨髓间充质干细胞成脂诱导分化培养基试剂盒,按照说明书步骤进行诱导分化,待脂滴变得足够大、圆,进行油红O染色,光学显微镜下观察成脂染色效果。
4.软骨细胞的分离与培养:1周龄左右SD大鼠,处死后于无菌条件下游离双侧后肢,削取股骨髁、膝关节表面软骨并剪碎至1mm3大小,充分漂洗,0.25%胰蛋白酶37℃摇荡消化30min,然后按体积比1∶5加入0.2%(2g/L)Ⅱ型胶原酶,于37℃培养箱内消化4h。消化后将细胞悬液通过200目不锈钢滤网过滤,1000r/min离心5min,弃去上清,加入适量含10%FBS的低糖DMEM培养基重悬细胞,置于37℃、5% CO2培养箱中培养。细胞贴壁后更换培养基,之后每2天换液1次,至细胞密度约90%时,用0.25%胰蛋白酶消化,按1∶2比例传代。通过形态学观察和甲苯胺蓝染色鉴定分离的软骨细胞。使用第3~5代细胞用于实验。
5.外泌体的提取:取第3~5代大鼠BMSC,使用含无外泌体FBS的α-MEM培养基培养48h。收集细胞上清,300g离心10min,然后收集上清,2000g离心10min,再次收集上清,0.22μm滤器过滤后转移到滤膜孔径为100kDa NWCO的超滤离心管,4000g离心30~50min浓缩上清液。收集浓缩液,10000g离心30min。上清转移至超速离心管,100000g离心70min,2次。得到的沉淀即为外泌体,加入适量PBS重悬,-80℃保存备用。BCA试剂盒测定外泌体蛋白浓度。
6.外泌体形态的鉴定:采用透射电子显微镜观察外泌体的形态。将载样铜网置于滤纸上,滴加20μl外泌体提取液,室温静置3min。滤纸吸干铜网侧边液体,加入30μl 3%磷钨酸溶液,室温负染5min。将铜网置于样品室,观察外泌体形态并拍照。
7.外泌体表面标志物的鉴定:Western blot法检测外泌体特异性表面标志物CD63、CD81和Tsg101的表达。提取外泌体,RIPA裂解液裂解后BCA法测定蛋白浓度。按照50微克/孔上样,进行SDS-PAGE电泳后,采用湿转法将蛋白转至PVDF膜。然后PVDF膜依次经5%脱脂奶粉室温封闭1h,anti-CD64、anti-CD81、anti-Tsg101、anti-β-actin抗体4℃过夜孵育,HRP标记的二抗室温孵育30min,最后用ECL发光液显影曝光。去除外泌体的细胞培养基(BMSC-Ed-CM)作为对照。
8.细胞迁移的检测:划痕实验检测软骨细胞的迁移能力。6孔板背面画线,接种软骨细胞,密度以过夜长满为宜。细胞长满后用200μl无菌枪头垂直于画的线进行划痕,PBS洗去悬浮细胞,CM组(细胞培养基对照组)加入含1%FBS的细胞培养基,Exo组分别加入终浓度为25、50和100μg/ml的外泌体,为模拟OA病理环境,同时设置IL-1β(10ng/ml)对照组,各组分别于0、12和24h进行显微拍照,使用Image J软件分析划痕愈合率。
9.细胞增殖的检测:CCK-8试剂盒检测软骨细胞的增殖。软骨细胞按2×103个/孔的密度接种96孔板,次日每组加入对应的完全培养基(实验分组同前),继续培养1、3、5和7天。作用结束后每孔加入10μl CCK-8溶液,细胞培养箱内继续孵育2h,使用酶标仪在450nm测定吸光度。
10.细胞凋亡的检测:流式细胞术检测软骨细胞的凋亡。软骨细胞接种6孔板,待细胞密度约80%时,每组加入对应的完全培养基(实验分组同前),继续培养24和48h后收集细胞,按照试剂盒说明书步骤操作进行Annexin Ⅴ-FITC和PI染色,流式细胞仪检测细胞凋亡。
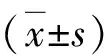
结 果
1.细胞分离与鉴定:分离的原代软骨细胞呈多角形或短梭形,折光性强,密度高时呈“铺路石”样,甲苯胺蓝染色呈阳性。贴壁后的大鼠BMSC呈梭形,涡旋状生长。通过干细胞多向分化能力实验鉴定分离的BMSC,结果如图1所示。成骨诱导后BMSC内逐渐出现钙质沉积,第21天用茜素红染色可见红色致密结节(图1A)。成脂诱导后BMSC逐渐由梭形变为圆形,细胞内出现小脂滴,且脂滴逐渐融合变大,第14天油红O染色脂滴呈红色(图1B)。

图1 大鼠BMSCs的成骨、成脂诱导分化A.成骨诱导分化茜素红染色结果;B.成脂诱导分化油红O染色结果
2.外泌体的鉴定:提取的BMSC-Exo在透射电镜下呈圆形或椭圆形,有完整的胞膜结构,直径主要集中于40~80nm(图2A);经Western blot法检测其表面特异性标志物CD63、CD81、Tsg101表达呈阳性(图2B)。

图2 大鼠BMSC-Exo的鉴定A.透射电镜下的外泌体;B.Western blot法检测外泌体表面标志物蛋白表达
3.BMSC-Exo对软骨细胞迁移的影响:细胞划痕实验结果如图3所示,BMSC-Exo可显著促进软骨细胞划痕的愈合,且随着BMSC-Exo浓度增加和作用时间延长,愈合速度明显加快(图3A、B,P<0.05)。浓度为100μg/ml的BMSC-Exo作用24h时,划痕愈合率达93.46%±2.58%,已几乎完全愈合。加入IL-1β(10ng/ml)后,与对应浓度的BMSC-Exo组比较,软骨细胞的愈合速度减慢,IL-1β+Exo-100μg/ml组作用24h时,划痕愈合率仅83.48%±0.50%。但是,与IL-1β对照组比较,BMSC-Exo处理可以减弱IL-1β对软骨细胞增殖的抑制作用(图3C、D,P<0.01)。
4.BMSC-Exo对软骨细胞增殖的影响:CCK-8法检测细胞增殖的实验结果如图4所示,BMSC-Exo可显著促进软骨细胞的增殖活力,且呈时间和剂量依赖性(P<0.01);IL-1β(10ng/ml)刺激会抑制软骨细胞的增殖,而BMSC-Exo的存在可减弱IL-1β的抑制作用(P<0.05)。
5.BMSC-Exo对软骨细胞凋亡的影响:流式细胞术检测软骨细胞凋亡的实验结果如图5所示,随着BMSC-Exo浓度增高和作用时间延长,软骨细胞的凋亡比例逐渐降低(P<0.01),加入IL-1β(10ng/ml)可诱导软骨细胞发生凋亡, 但同时加入BMSC-Exo可显著抑制IL-1β的促凋亡作用(P<0.01)。
讨 论
OA严重影响患者的健康和生活,并会造成巨大的经济损失。OA的治疗一直是临床难点,至今仍无预防、改善或是逆转OA病程的有效途径[1]。MSC组织工程为OA的治疗带来了新的曙光。

图3 BMSC-Exo对软骨细胞迁移的影响(×100)A、C.细胞划痕实验结果;B、D.划痕愈合率统计分析结果;与CM组或IL-1β组比较,*P<0.05,**P<0.01
MSC属多功能干细胞,存在于骨髓、脂肪等多种组织,具有促生长、抗凋亡、抗炎和免疫抑制等功能,并有来源广、易获取、多向分化等特性,广泛应用于再生细胞治疗领域,特别是OA这种退行性疾病[2]。自20世纪90年代起,大量的临床研究证实直接关节腔内注射MSCs或将含有MSC的材料植入体内,均可有效治疗轻度至中度OA的软骨缺损,产生透明样软骨,减轻患者疼痛,提高生活质量[2~12]。尽管应用MSC治疗OA具有损伤小、见效快、疗效好等优点,但该方法花费巨大且存在医学伦理学争议、患者体重限制、有恶性转化风险等诸多限制因素,使得其临床应用受到局限。

图4 BMSC-Exo对软骨细胞增殖的影响与CM组或IL-1β组比较,*P<0.05,**P<0.01
近年来,大量研究证实MSC的治疗效果主要来自于其旁分泌功能[2~4]。Exosome是一种重要的细胞旁分泌效应成分,属于细胞外囊泡(extracellular vesicle, EV)的一种,经由内体途径产生,几乎所有细胞都可分泌[13]。Exosome直径30~100nm,由磷脂双分子层和其内包裹的脂类、蛋白质、核酸等生物信息物质构成,在细胞间信息传递中发挥重要作用[13]。研究证实,MSC-Exo具有与其来源亲本干细胞类似的功能[4,13],在心肌梗死以及脑、肺、肝脏和急性肾损伤等疾病的动物模型中均可发挥良好的损伤修复效果[5,13]。最新研究结果显示,基于MSC-Exo的抗炎和促生长作用,其可促进OA关节软骨再生,但相关机制尚有待于深入研究[6~9]。软骨细胞是关节软骨内唯一的细胞成分,目前有关MSC-Exo对软骨细胞作用效果的研究较少。

图5 BMSC-Exo对软骨细胞凋亡的影响A.流式细胞术实验结果;B.细胞凋亡比例统计分析结果;与CM组或IL-1β组比较,**P<0.01
本研究采用超速离心结合超滤浓缩法成功提取BMSC-Exo。使用浓度梯度的BMSC-Exo处理软骨细胞,结果表明BMSC-Exo可促进软骨细胞的迁移和增殖,抑制软骨细胞的凋亡,且这些作用效果均存在明显的时间和剂量依赖性。Zhu等[14]曾证实,诱导性多能干细胞和滑膜干细胞分泌的外泌体均可刺激软骨细胞的迁移和增殖。Zhang等[15]的研究结果显示,MSC-Exo在软骨修复过程中可促进细胞增殖、抑制细胞凋亡,并且推测AKT/ERK等多条信号通路可能参与调控该过程。本研究结果与上述研究结果一致,并且更全面系统地阐述了BMSC-Exo作用效果与时间和剂量的相关性,但是相关机制有待于进一步探索。研究证实,Wnt/β-catenin信号通路在多种组织和细胞内可参与调控细胞迁移、增殖及凋亡[16,17]。因此,下一步实验中笔者将重点探索Wnt/β-catenin通路是否参与MSC-Exo调控软骨细胞迁移、增殖和凋亡的过程。
OA患者的软骨可自发产生大量的自分泌型IL-1β,而在正常软骨中检测不到。IL-1β(10ng/ml)是公认的OA体外模型诱导剂,可导致关节软骨退化[10,11]。本研究使用IL-1β(10ng/ml)刺激软骨细胞以模拟OA病理环境,与既往研究者的结果类似,IL-1β可显著抑制软骨细胞的迁移和增殖,同时存在促凋亡作用[18,19]。本研究结果显示,加入BMSC-Exo可有效减弱甚至逆转IL-1β对软骨细胞迁移、增殖和凋亡的影响,但深入机制还有待于后续实验进一步研究。Liu等[20]的最新研究结果同样表明,MSC-Exo可减弱IL-1β产生的抑制细胞增殖和促进细胞凋亡的作用,并且lncRNA-KLF3-AS1/miR-206/GIT1轴参与调控该过程。
综上所述,本研究证实BMSC-Exo存在与其来源亲本干细胞类似的作用效果,可促进软骨细胞的迁移运动和增殖能力,抑制软骨细胞的凋亡,可对软骨细胞的生长发挥重要的调控作用。本研究为探索外泌体修复关节软骨损伤的分子机制奠定基础,为新型“无细胞”治疗方法提供基础数据,为OA的临床防治提供更为广阔的思路。
