‘巨峰’葡萄皮花色苷的分离纯化、结构鉴定及抗肿瘤活性
2020-03-31薛宏坤谭佳琪刘成海
薛宏坤,谭佳琪,刘 钗,刘成海,
(1.东北农业大学工程学院,黑龙江 哈尔滨 150030;2.东北农业大学农学院,黑龙江 哈尔滨 150030)
近年来合成色素过量使用引发一系列安全问题备受人们的广泛关注,利用天然色素取代合成色素成为当前研究的热点。花色苷是一类天然水溶性的植物色素,来源广泛,具有诱人的色泽和特殊的芳香。研究表明花色苷具有抗氧化[1]、抗炎[2]、抗肿瘤[3]、预防心血管疾病[4]等生理活性。因此,有必要对花色苷进一步深入研究,对提高花色苷的学术价值和商业价值有重要的指导意义。‘巨峰’葡萄是我国主要的栽培品种之一,因其粒大肉多、酸甜适中等特点,深受广大消费者的喜爱。‘巨峰’葡萄主要被加工成果汁和果酒,在其加工生产过程中形成的副产物‘巨峰’葡萄皮,其内部含有大量花色苷(以锦葵素为主)、多酚等活性成分。而‘巨峰’葡萄皮通常被遗弃,造成环境污染和资源浪费。‘巨峰’葡萄皮为天然色素的主要原料,但对这种优质的天然色素资源研究开发较少,而且锦葵素相关的标准品稀缺且价格昂贵。因此,建立简单易行的分离纯化花色苷的方法获得单一高纯度的花色苷组分是必要的。
目前,花色苷的分离纯化方法主要有柱层析法、膜分离法、高效逆流色谱法、高效制备型液相色谱法等。Wang Erlei等[5]和陈阳[6]等均采用大孔树脂分别对蓝莓花色苷和红花芸豆色素进行分离纯化,经树脂纯化后样品的纯度得到显著提高。邓洁红等[7]利用纸层析-薄层层析联用技术从刺葡萄皮中分离纯化得到5 种花色苷组分,但是分离纯化过程复杂,所需纯化周期长。滕学峰[8]运用单一的Sephadex LH-20葡聚糖凝胶技术对黑大豆皮中色素进行分离纯化,分离效果较好,但是由于提取物中杂质含量较多,容易造成层析柱的堵塞和污染。在花色苷结构鉴定方面,常用的鉴定方法主要有紫外-可见光谱法、红外光谱法、液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用法和核磁共振法等。Rasines-Perea等[9]利用红外光谱法鉴定出红葡萄中含有12 种花色苷组分。Escribano-Bailon等[10]采用紫外-可见光谱法-HPLC-MS法鉴定奇异果中花色苷结构,研究表明,奇异果中含有8 种花色苷。曹少谦[11]利用NHA-9大孔树脂-Toyopearl TSK HW-40S凝胶层析联用技术对血橙花色苷进行分离纯化,并对纯化后的产物进行结构鉴定,研究发现纯化技术可行,经纯化后得到8 种花色苷组分。花色苷的抗肿瘤活性方面,刘奕琳[12]、陈建杨[13]和薛宏坤[14]等分别研究发现蓝靛果花色苷洗脱物、马铃薯花色苷提取物和蓝莓提取物对HepG2肺癌和A549肝癌细胞增殖的影响,研究发现3 种花色苷提取物均能显著抑制肿瘤细胞的生长,而针对花色苷单一组分的抗肿瘤活性研究有限。目前,利用大孔树脂-Sephadex LH-20葡聚糖凝胶联用技术分离纯化‘巨峰’葡萄皮中花色苷,并探究纯化后的单一高纯度花色苷组分的抗肿瘤活性鲜见报道。
鉴于此,本实验采用AB-8大孔树脂-Sephadex LH-20葡聚糖凝胶联用技术分离纯化‘巨峰’葡萄皮中花色苷,获得单一高纯度的花色苷组分;利用超高效液相色谱三重四极杆飞行时间质谱联用技术对纯化后所得的花色苷组分进行结构鉴定及探究花色苷组分的抗肿瘤活性。
1 材料与方法
1.1 材料与试剂
‘巨峰’葡萄(采摘于东北农业大学园艺学院),成熟后于8月中旬采摘,洗净,晾干,手工去皮,果皮置于冷冻干燥机冻至48 h,然后用植物粉碎机进行粉碎,过40 目筛,制成葡萄皮粉末,避光密封保存在-18 ℃冰箱中。
AB-8大孔树脂 天津市大钧科技有限公司;聚酰胺树脂 日本三菱公司;Sephadex LH-20 美国Sigma公司;乙醇、乙酸、乙酸乙酯、冰醋酸、氯化钾、甲酸 国药集团化学试剂有限公司分析纯;磷酸盐缓冲液(phosphate buffered saline,PBS)、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)和DMEM完全培养基 北京索莱宝科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)上海莱昂生物科技有限公司;HepG2肝癌细胞和A549肺癌细胞 哈尔滨医科大学;超纯水(过0.45 μm滤膜) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
1100高效液相色谱仪和1290超高效液相色谱-G6500四极杆飞行时间质谱联用仪 美国Agilent公司;DK-98-IIA型恒温水浴锅 天津市泰斯特仪器有限公司;TG18K-II型高速离心机 上海赵迪生物科技有限公司;SHZ-D(III)型循环水式真空泵 巩义仪器有限责任公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;UV-mini1240紫外-可见分光光度计 日本岛津公司;HZQ-F全温振荡培养箱 哈尔滨市东联电子技术开发有限公司;TS100倒置荧光显微镜 日本Nikon公司;ZE5流式细胞仪 美国Bio-Rad公司。
1.3 方法
1.3.1 实验流程
实验设计流程如图1所示。
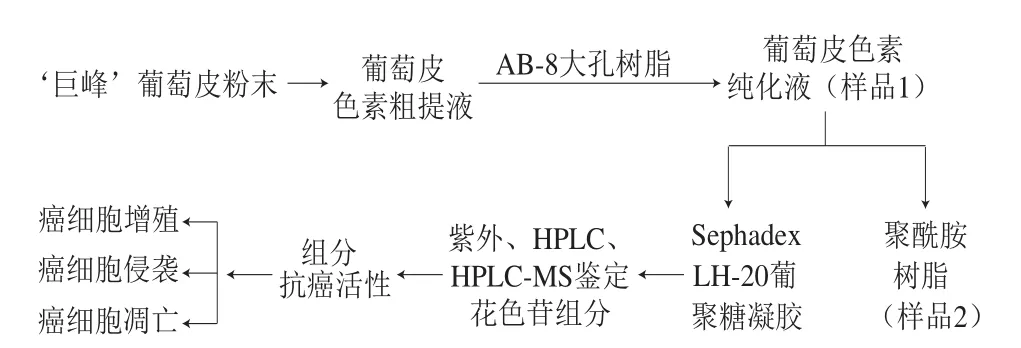
图 1 实验设计流程图Fig. 1 Flow chart of the experimental design
1.3.2 ‘巨峰’葡萄皮花色苷的纯化与分离
1.3.2.1 ‘巨峰’葡萄皮色素粗提液的制备
在预实验的基础上,准确称取50 g葡萄皮粉末,以1∶8的料液比加入体积分数为60%酸化乙醇溶液(含体积分数0.05%醋酸),恒温水浴35 ℃,避光浸提6 h,真空抽滤,收集滤液,将其在35 ℃旋转蒸发仪减压浓缩,回收乙醇,将浓缩液以4 000 r/min离心15 min,取上清液以1∶4的体积比加入无水丙酮,避光35 ℃水浴振荡1 h,真空抽滤,将其在35 ℃旋转蒸发仪减压浓缩,回收丙酮,取色素浓缩液以1∶1的体积比加入无水乙醚萃取2 次,弃上层有机相,将得到的萃取液以1∶1的体积比再加入无水乙酸乙酯萃取2 次,将水层除去有机溶剂,然后再将其在35 ℃旋转蒸发仪减压浓缩,最终得到‘巨峰’葡萄皮色素粗提液。采用pH示差法[15]测得花色苷的质量浓度为1.280 6 mg/mL。
1.3.2.2 AB-8大孔树脂对‘巨峰’葡萄皮花色苷的吸附纯化
在预实验的基础上,取10 mL经预处理后的AB-8大孔树脂湿法装柱(2.6 cm×60 cm),控制上样流速为5 s/滴,当从AB-8大孔树脂流出液的吸光度值达到上样液的1/10时,认为大孔树脂吸附饱和,此时停止进样,然后用蒸馏水洗脱树脂至洗出液无色,最后依次用酸化的去离子水(含体积分数0.02% HCl溶液)、体积分数60%酸化乙醇溶液(含体积分数0.05% HCl溶液)和体积分数80%酸化乙醇溶液(含体积分数0.05% HCl溶液)洗脱层析柱,洗脱流速为4 s/滴,洗脱液在35 ℃旋转蒸发仪减压浓缩(样品1)。
1.3.2.3 聚酰胺树脂对‘巨峰’葡萄皮花色苷的吸附纯化
在预实验的基础上,取10 mL经预处理后的聚酰胺树脂湿法装柱(3.0 cm×40 cm),样品1过聚酰胺柱,上样流速为5 s/滴,当从聚酰胺柱流出液的吸光度达到上样液的1/10时,认为聚酰胺树脂吸附饱和,此时停止进样,然后用蒸馏水洗脱树脂至洗出液无色,将体积分数为50%的酸化甲醇溶液(含体积分数为0.1% HCl溶液)作为洗脱液对层析柱进行洗脱,洗脱流速为4 s/滴,洗脱液在35 ℃旋转蒸发仪减压浓缩(样品2)。
1.3.2.4 Sephadex LH-20凝胶对‘巨峰’葡萄皮花色苷的分离纯化
在预实验的基础上,经预处理后的Sephadex LH-20凝胶湿法装柱(1.0 cm×100 cm),样品1经过0.22 μm微孔滤膜过滤后上样,上样体积为2 mL,当样品1完全渗入胶床后,然后用体积分数为50%的酸化甲醇溶液(含体积分数为0.1% HCl溶液)对层析柱进行洗脱,洗脱流速为10 s/滴,当色素带在色谱柱中分离开后,将洗脱流速调至为2 s/滴,每2 mL一管,根据HPLC检测结果,合并纯度大于95%的收集管,在真空冷冻干燥机中将其冻干,得色素I、色素II、色素III、色素IV粉末,花色苷组分得率的计算如式(1)所示。
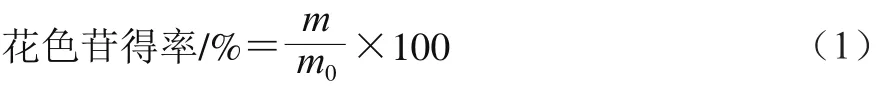
式中:m为花色苷组分粉末质量/g;m0为‘巨峰’葡萄皮粉末质量/g。
1.3.3 紫外-可见光谱分析
利用体积分数为0.01%盐酸甲醇溶液溶解样品1、样品2、色素I、色素II、色素III和色素IV粉末,将其在200~700 nm波长范围内进行扫描[16],分析其光谱特征。
1.3.4 高效液相色谱分析
样品处理:将样品1、样品2、色素I、色素III和色素IV分别用体积分数0.1% HCl-甲醇溶液稀释后,配制成质量浓度为0.1 mg/mL的样品溶液,溶液过0.45 μm滤膜,用于HPLC分析。
色谱条件:1100 C18柱(150 mm×4.6 mm,2.6 μm);流动相A为V(甲酸)∶V(水)=1∶5;流动相B为V(乙腈)∶V(水)∶V(甲酸)=57.5∶40∶2.5;洗脱程序:10% B(0 min)~30% B(5 min)~30% B(10 min)~100% B(15 min)~100% B(25 min)~10% B(28 min);流速为0.8 mL/min;柱温25 ℃;进样量为20 μL;检测波长为520 nm。
1.3.5 超高效液相色谱三重四极杆飞行时间质谱联用分析
HPLC条件:1290 C18柱(150 mm×2.1 mm,5 μm),流动相A:体积分数为0.1%甲酸水溶液;流动相B:体积分数为0.1%甲酸乙腈;洗脱程序:15% B(0 min)~40% B(9 min)~60% B(15 min)~75% B(25 min)~90% B(25 min)~15% B(30 min);流速为0.3 mL/min;柱温35 ℃;进样量为20 μL;扫描波长为190~400 nm。色素检测波长为287 nm。
质谱条件:电喷雾电离离子源,质谱采用正离子扫描方式,质量扫描范围m/z 100~1 200,毛细管电压4.5 kV,雾化器压力138 kPa,干燥气温度335 ℃。
1.3.6 抗肿瘤活性指标
1.3.6.1 MTT法检测细胞增殖能力
采用MTT法测定‘巨峰’葡萄皮花色苷组分对肿瘤细胞的增殖抑制作用,参照文献[17]方法测定,细胞存活率计算如式(2)所示。
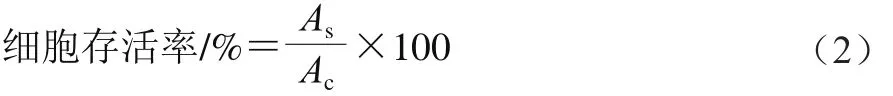
式中:As为样品组的吸光度;Ac为空白对照组的吸光度。
1.3.6.2 花色苷组分对HepG2肝癌细胞和A549肺癌细胞侵袭能力的影响
采用Transwell侵袭实验考察花色苷组分对HepG2肝癌细胞和A549肺癌细胞侵袭能力。参考杨三维等[18]研究紫小麦花色苷对肿瘤细胞侵袭能力影响的操作方法。在倒置显微镜下观察,计算细胞数量,侵袭率的计算如式(3)所示。

1.3.6.3 花色苷组分对HepG2肝癌细胞和A549肺癌细胞凋亡的影响
取对数期HepG2肝癌细胞和A549肺癌细胞接种于60 mm细胞培养板(2.5×105个/孔),培养24 h,用色素I、色素III和色素IV处理24 h,移除培养基,用胰蛋白酶消化,收集细胞,用PBS洗两次,然后采用Annexin V-FITC/PI双标记染色法,用流式细胞仪检测细胞凋亡。
1.4 数据处理
每组实验重复3 次,结果用平均值±标准差表示;采用Statistix 8.0软件对每组实验数据进行方差分析;采用SAS 8.0软件分析结果的差异显著性;Origin 9.0软件进行绘图。
2 结果与分析
2.1 ‘巨峰’葡萄皮花色苷得率
依据式(1)计算可得,色素I、色素III和色素IV的得率分别为(0.108±0.011)%、(0.053±0.007)%和(0.038±0.005)%,而根据‘巨峰’葡萄皮花色苷的含量计算可得花色苷的理论得率范围为0.21%~0.25%。因此,该纯化分离方法在制备效率上是可行的。
2.2 紫外-可见光谱分析结果
经AB-8大孔树脂纯化后的样品(样品1)和经聚酰胺树脂纯化后的样品(样品2)的紫外-可见吸收光谱如图2所示。样品1和样品2在280 nm左右和520 nm左右均有最大吸收峰,由此可判断花色苷是经AB-8大孔树脂和聚酰胺树脂纯化后的色素溶液中主要成分[19]。并且样品1和样品2在330 nm左右也有弱的吸收峰,说明样品1和样品2溶液中可能存在酰化的花色苷[20]。
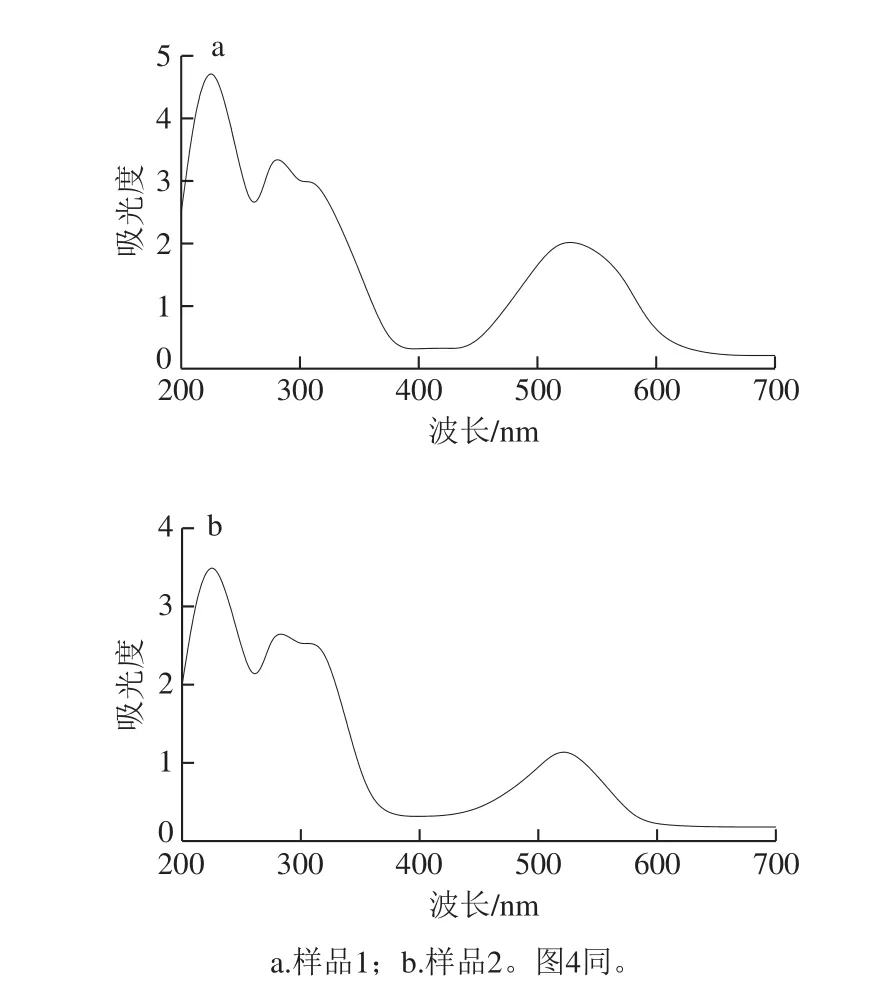
图 2 样品的紫外-可见扫描光谱Fig. 2 UV-Vis absorption spectra of purified samples
样品1再经Sephadex LH-20凝胶分离纯化后,‘巨峰’葡萄皮色素溶液被凝胶柱分离成4 个不同颜色的色素带,分别为色素I(淡粉色)、色素II(橙色)、色素III(紫红色)和色素IV(粉红色),对各色素带在200~700 nm范围内进行紫外-可见光谱扫描,其结果如图3所示。色素II在280 nm和520 nm附近均无紫外吸收峰,结果表明色素II为非花色苷类的物质,不再进行后续的研究。而色素I、色素III和色素IV均在280 nm和520 nm附近有最大吸收峰,由此可知,色素I、色素III和色素IV均为花色苷类物质,另外色素III在305 nm波长处有弱的吸收峰,由此说明色素III可能为酰基化的花色苷类物质[21]。
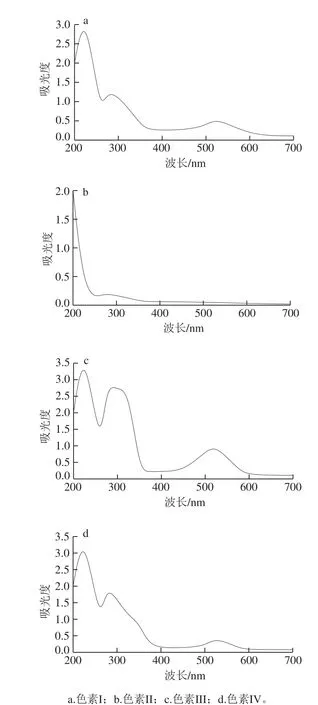
图 3 经Sephadex LH-20分离纯化的4 条色素带的紫外-可见光谱Fig. 3 UV-Vis absorption spectra of four pigments isolated by Sephadex LH-20 chromatography
2.3 HPLC分析结果
利用HPLC在520 nm波长处将经AB-8大孔树脂纯化后的样品(样品1)和经聚酰胺树脂纯化后的样品(样品2)进行分析,其色谱结果如图4所示。

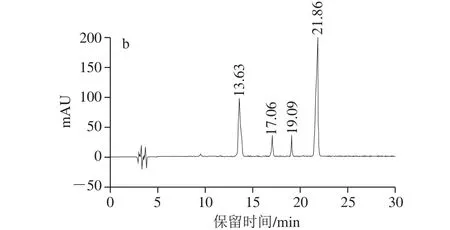
图 4 纯化后样品在520 nm波长处的HPLC色谱图Fig. 4 High performance liquid chromatography at 520 nm of purified samples
由图4a可知,在520 nm条件下,样品1共检测出6 种花色苷组分,出峰时间集中在13~22 min范围内。出峰时间在13.69 min和21.84 min为样品1中主要的2 种花色苷组分,两种组分相对含量分别为38.15%和47.62%。其他4 种组分的出峰时间依次为15.51、16.99、19.05、20.04 min,其相对含量分别为2.57%、4.08%、4.05%、3.53%。由图4b可知,样品2共检测出4 种花色苷组分,出峰时间在13.63 min和21.86 min仍为主要的2 种花色苷组分,其相对含量分别为27.58%和69.11%,其他两峰的出峰时间分别为17.06 min和19.09 min,相对含量分别为2.08%和1.23%。对比样品1和样品2中花色苷组分比例发现,样品经不同纯化方法所得的花色苷比例差别较大。其原因是在聚酰胺纯化花色苷过程中,一部分花色苷被吸附在聚酰胺树脂上,从而使得纯化后的花色苷组分比例相差较大[22]。聚酰胺对出峰时间在13.69 min的花色苷吸附较为严重,原因需要进一步分析。以花色苷比例和分离度为考察因素,将样品1再经过Sephadex LH-20继续纯化分离。
样品1经Sephadex LH-20分离纯化得到色素I、色素III和色素IV,三者的HPLC图见图5,色素I、色素III和色素IV的出峰时间分别为13.73、17.07和21.82 min,分别与样品1中出峰时间为13.69、16.99、21.84 min的花色苷组分相对应,依据归一法计算组分的相对含量,在520 nm条件下,3 种花色苷组分的纯度分别为98.52%、96.84%和91.36%,采用HPLC-MS联用技术进一步鉴定以上3 种花色苷组分的结构,另外也说明了Sephadex LH-20具有较好的分离效果。
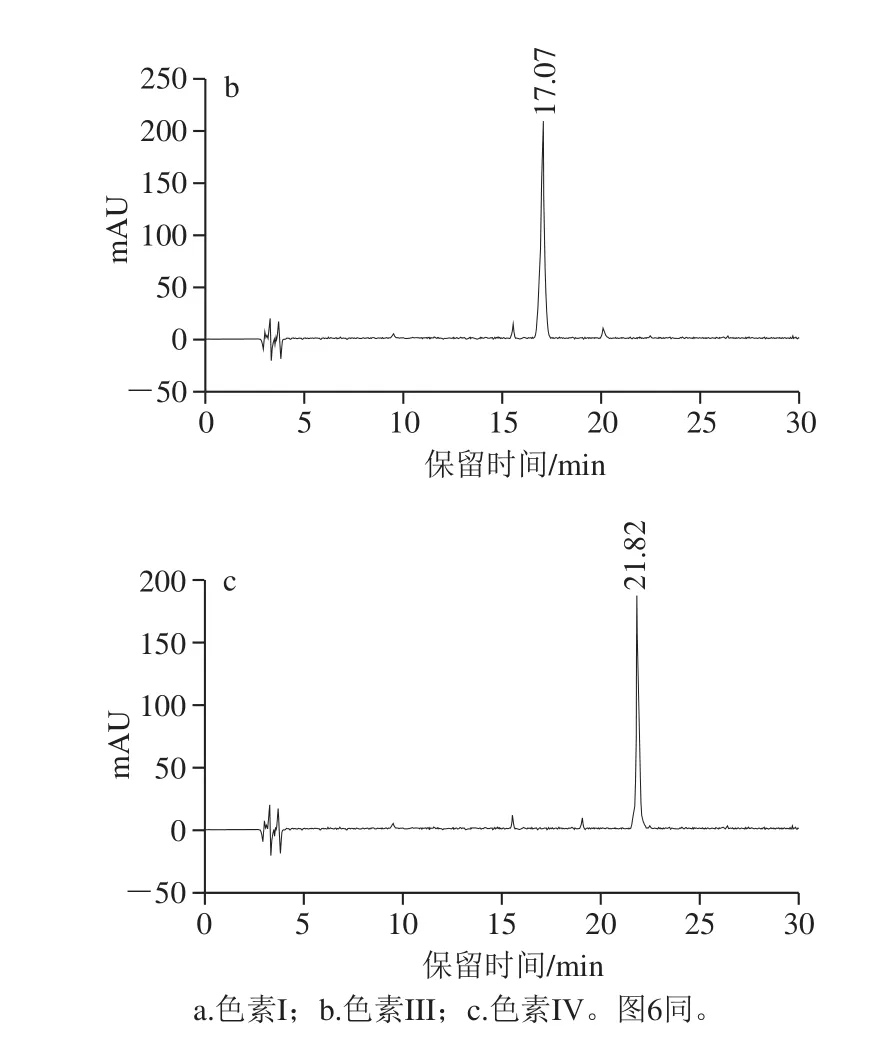
图 5 经Sephadex LH-20分离纯化后的3 种花色苷组分在520 nm波长处的HPLC图Fig. 5 High performance liquid chromatography at 520 nm of three anthocyanin components isolated by Sephadex LH-20 chromatography
2.4 超高效液相色谱三重四极杆飞行时间质谱联用分析结果
为了研究色素I、色素III和色素IV的花色苷组成,采用超高效液相色谱三重四极杆飞行时间质谱对3 种色素的结构进行鉴定。花色苷的结构根据分子离子峰、碎片及标准品的保留时间来确定。3 种花色苷的MS图见图6,其鉴定结果如表1所示。
由图6a1、a2可知,色素I保留时间为2.57 min,MS和MS2信息表明,其分子离子峰[M+]为595.4,在质谱中检测到两个碎片离子分别为m/z 449.1和m/z 287.2。m/z 287是矢车菊色素的特征离子,碎片([M-146]+)对应于花色苷分子中失去一个鼠李糖基所得的碎片,而m/z 287的碎片([M-146-162]+)对应于m/z 449的碎片上再失去一个己糖基得到的碎片。该研究结果与Liu Liang等[23]研究荔枝皮花色苷和Eguchi等[24]研究荞麦花色苷中矢车菊-3-芸香糖苷的质谱信息相一致。因此,色素I被鉴定为矢车菊-3-芸香糖苷。由图6b1、b2可知,色素III保留时间为4.87 min,MS和MS2信息表明,其分子离子峰[M+]为801,碎片离子m/z分别为331.1、493.2和639.1。m/z 331是锦葵色素的特征离子,m/z 493对应锦葵色素的单己糖,m/z 639对应锦葵素-香豆酰单己糖,碎片([M-146]+)对应于香豆酸脱去一分子水后所得的碎片。A440nm/Aλmax的百分比为13.2%,推测色素III为3,5-双己糖,该研究结果与王维茜等[22]研究刺葡萄皮花色苷和Hong等[25]研究果汁花色苷中的锦葵素-3,5-双葡萄糖苷-香豆酰的MS信息相一致。因此,色素III被鉴定为锦葵素-3,5-双葡萄糖苷-香豆酰。这于紫外-可见光谱分析中的色素III可能为酰化的花色苷这一结论相吻合。由图6c1、c2可知,色素IV保留时间为6.35 min,MS和MS2信息表明,其分子离子峰[M+]为493,碎片离子m/z 331.1。m/z 331是锦葵色素的特征离子,丢失碎片162,可能为葡萄糖和半乳糖,结合文献[26-27]可知色素IV为锦葵-3-半乳糖苷。
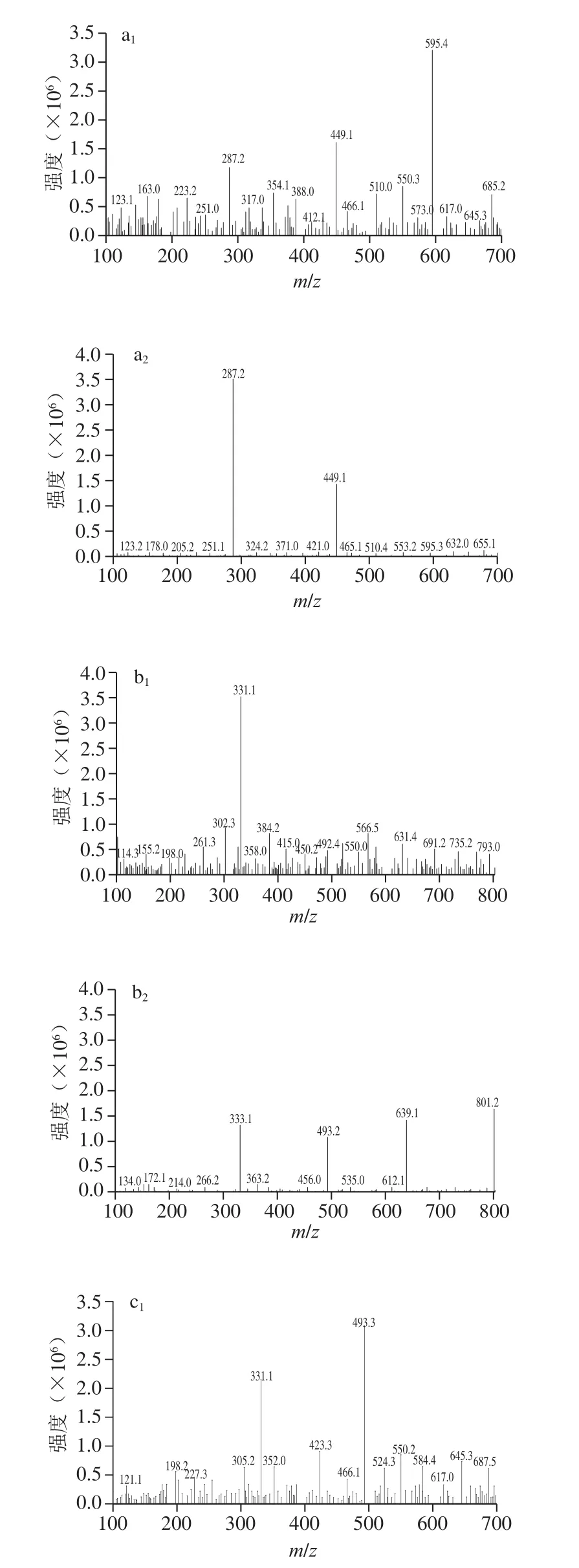
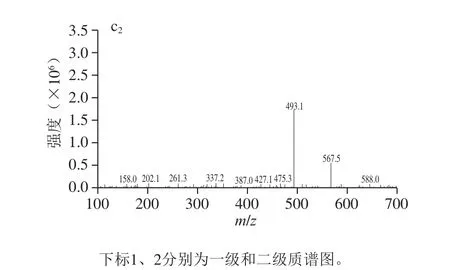
图 6 3 种花色苷组分一级和二级质谱图Fig. 6 Mass and tandem mass spectra of three anthocyanin components
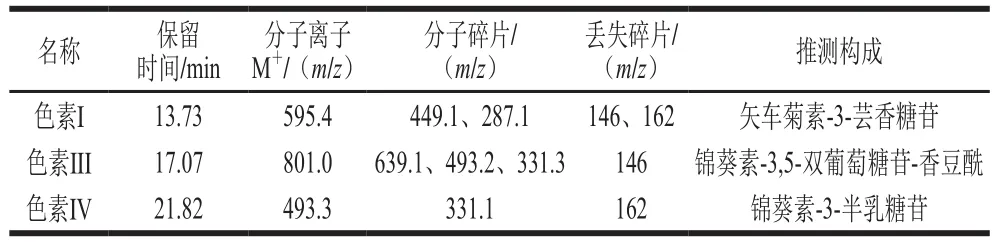
表 1 ‘巨峰’葡萄皮花色苷种类鉴定Table 1 Identification of three anthocyanins isolated from kyoho grape skins
2.5 花色苷组分对HepG2肝癌细胞和A549肺癌细胞生长增殖抑制作用
色素I、色素III和色素IV对HepG2肝癌细胞和A549肺癌细胞的增殖抑制效果如图7所示。
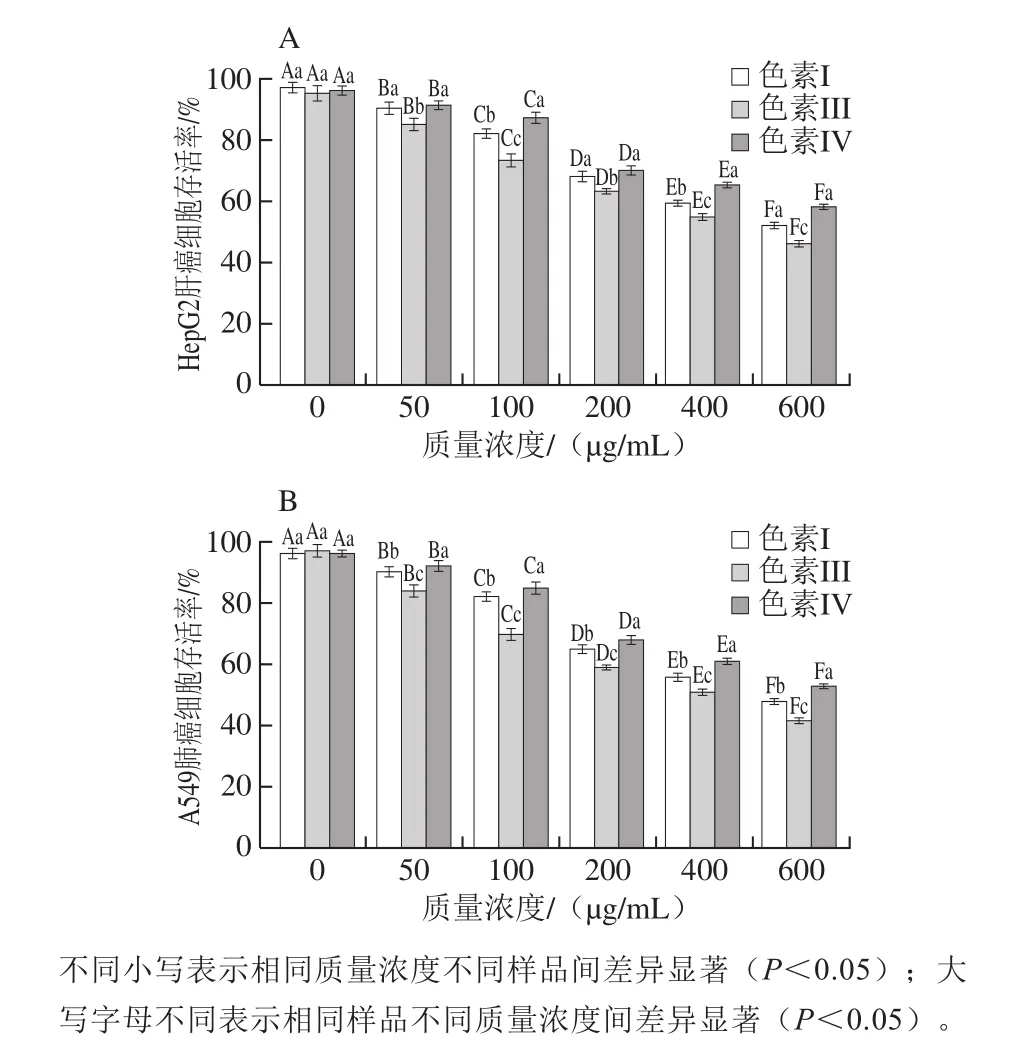
图 7 花色苷组分对癌细胞生长抑制作用的剂量效应Fig. 7 Inhibitory effect of anthocyanins on the growth of cancer cells
由图7可知,3 种花色苷组分处理HepG2肝癌细胞和A549肺癌细胞24 h后,两种癌细胞的存活率随3 种花色苷组分质量浓度增加呈现显著降低的趋势(P<0.05)。当花色苷组分质量质量浓度在50 μg/mL时,色素I、色素III和色素IV样品对HepG2肝癌细胞和A549肺癌细胞的存活率分别为(90.01±2.03)%、(85.11±1.86)%、(91.02±1.55)%和(90.03±1.43)%、(83.99±1.89)%、(91.98±1.52)%,而当花色苷组分质量浓度在600 μg/mL时,色素I、色素III和色素IV样品对HepG2肝癌细胞和A549肺癌细胞的存活率分别为(51.98±0.87)%、(46.05±0.92)%、(58.05±0.84)%和(47.97±0.89)%、(42.04±0.82)%、(53.12±0.91)%,前者较后者HepG2肝癌细胞和A549肺癌细胞的存活率分别降低了38.03%、39.06%、32.97%和42.06%、41.95%、38.86%。结果表明,色素I、色素III和色素IV均能显著抑制HepG2肝癌细胞和A549肺癌细胞的增殖,且质量浓度越大,抑制效果越显著,表现出显著的剂量效应。因此,后续实验3 种花色苷组分的质量浓度均选择600 μg/mL。对比相对质量浓度花色苷组分对HepG2肝癌细胞和A549肺癌存活率发现,色素III对HepG2肝癌细胞和A549肺癌的增殖抑制效果最强,其次是色素I,最低的是色素IV。分析原因是由于色素III中花色苷组分酰基化,酰基化后使得花色苷呈现“三明治”结构,提高花色苷稳定性和生理活性[28]。崔清慧[29]研究同样发现,酰化的花色苷对抗肿瘤的效果优于未酰化的花色苷。色素I中花色苷的酚羟基数较色素IV多,酚羟基数越多,生理活性越强[30]。因此,色素V对HepG2肝癌细胞和A549肺癌增殖的抑制效果优于色素IV。
2.6 花色苷组分对HepG2肝癌细胞和A549肺癌细胞侵袭能力的影响
侵袭能力通常被作为评价肿瘤细胞的重要指标之一。因此,研究3 种花色苷组分(质量浓度为600 μg/mL)对HepG2肝癌细胞和A549肺癌细胞侵袭影响,结果如图8和表2所示。
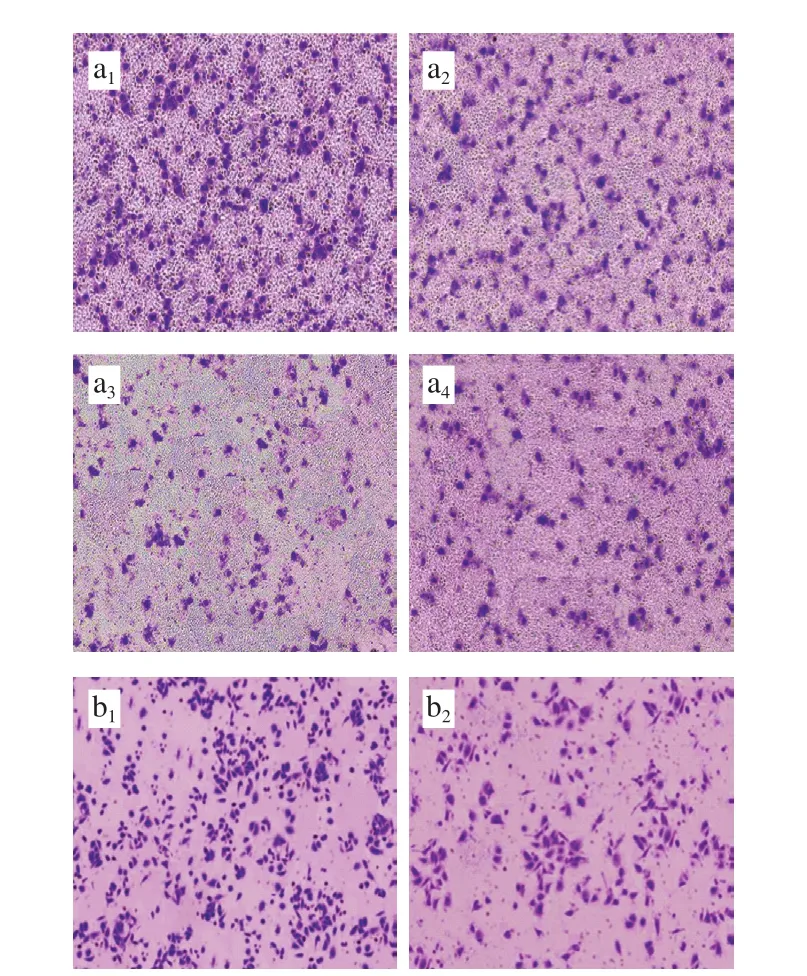
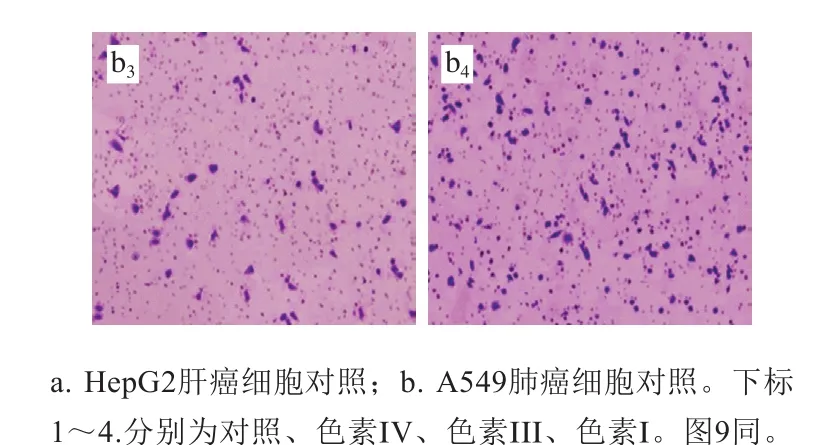
图 8 3 种花色苷组分对肿瘤细胞侵袭的影响(200×)Fig. 8 Effect of three anthocyanin components on the invasion of cancer cells (200 ×)
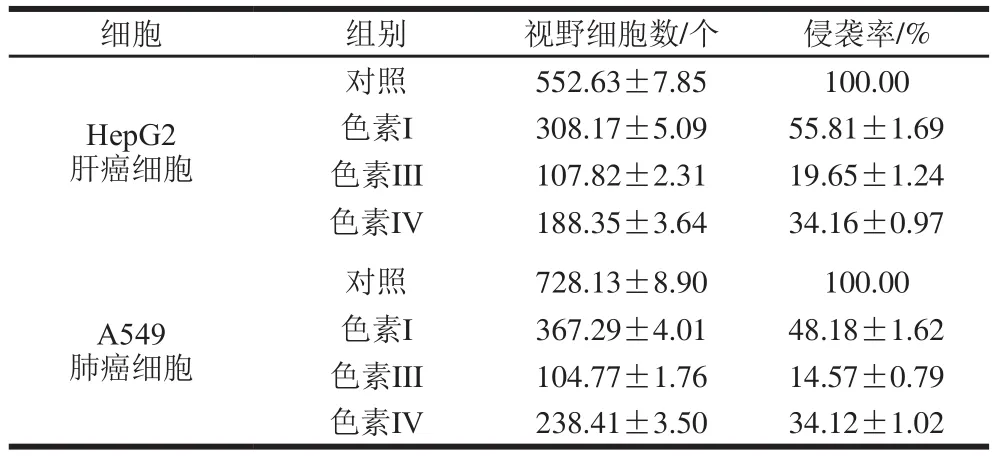
表 2 3 种花色苷组分对HepG2肝癌细胞和A549肺癌细胞侵袭能力的影响Table 2 Effects of three anthocyanins on the invasive ability of HepG2 hepatoma cells and A549 lung cancer cells
由图8和表2可知,分别与HepG2肝癌细胞和A549肺癌细胞对照组相比,3 种花色苷组分处理HepG2肝癌细胞和A549肺癌细胞后,发现穿膜细胞数量明显降低,侵袭率显著降低。依据式(3)可计算出对照组、色素I、色素III和色素IV对HepG2肝癌细胞和A549肺癌细胞侵袭率分别为100%、(55.81±1.69)%、(19.65±1.24)%、(34.16±0.97)%和100%、(48.18±1.62)%、(14.57±0.79)%、(34.12±1.02)%,分析数据发现,3 种花色苷组分均能显著抑制HepG2肝癌细胞和A549肺癌细胞侵袭能力,3 种花色苷组分对HepG2肝癌细胞和A549肺癌细胞侵袭抑制能力大小顺序依次是色素III>色素I>色素IV。该研究结果与MTT实验结果一致。
2.7 花色苷组分对HepG2肝癌细胞和A549肺癌细胞凋亡的影响
3 种花色苷组分(质量浓度为600 μg/mL)处理HepG2肝癌细胞和A549肺癌细胞24 h后,癌细胞凋亡情况如图9所示。
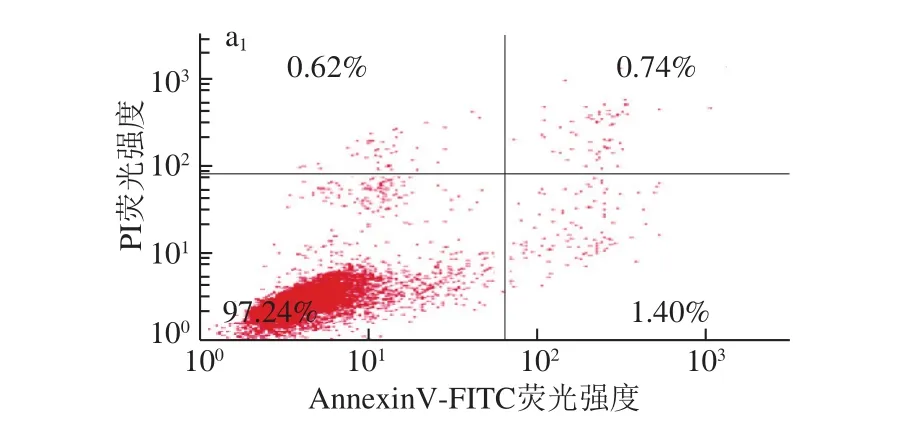
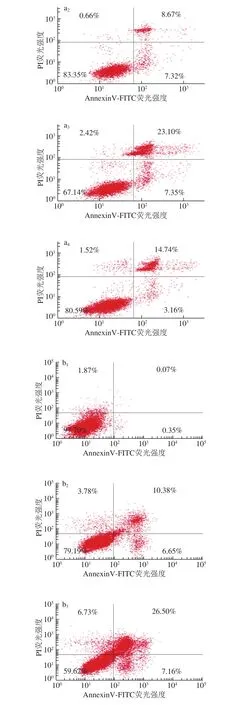
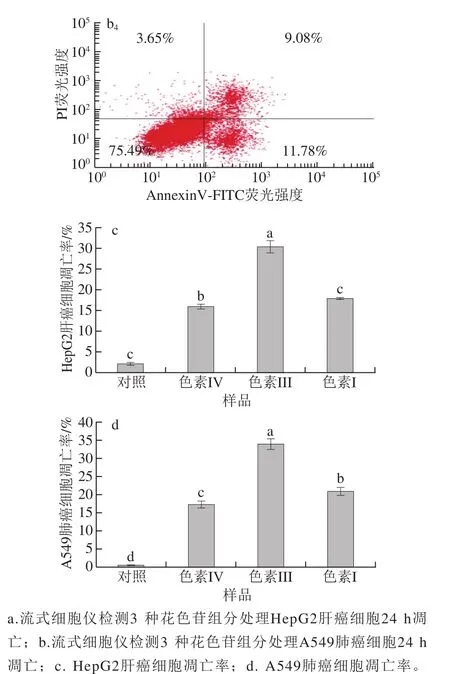
图 9 3 种花色苷组分对癌细胞凋亡的影响Fig. 9 Effects of three anthocyanin components on the apoptosis of cancer cells
目前,大量研究证明花色苷提取物具有抗氧化和清除自由基的能力[31],对癌细胞的增殖具有显著的抑制作用,加速癌细胞的凋亡[32]。因此,本实验在MTT和细胞侵袭的基础上,进一步探究3 种花色苷组分对癌细胞凋亡的影响。由图9可知,色素I、色素III和色素IV对HepG2肝癌细胞凋亡率分别为(17.90±0.22)%、(30.45±1.39)%和(15.99±0.36)%,与对照组相比,凋亡率分别提高了15.76%、28.31%和13.85%。结果表明,3 种花色苷组分均能显著提高HepG2肝癌细胞凋亡率,且促进HepG2肝癌细胞凋亡的效果顺序依次为色素III>色素I>色素IV。Urias-Lugo[33]和Yeh[34]等同样发现花色苷能显著提高癌细胞的凋亡,其作用机制是通过上调和下调相关的凋亡蛋白和凋亡因子,从而促进癌细胞凋亡。由图9d可知,色素I、色素III和色素IV对A549肺癌细胞凋亡率分别为(20.86±0.88)%、(33.66±1.52)%和(17.03±1.04)%,与对照组A549肺癌细胞凋亡率分别提高了20.44%、33.24%和16.61%。结果表明,3 种花色苷组分均能显著提高A549肺癌细胞的凋亡率,促进癌细胞凋亡的效果顺序同HepG2肝癌细胞。这与Chen Peini等[35]研究桑葚花色苷和陈建杨[13]研究特色马铃薯花色苷对A549肺癌细胞凋亡的研究结果相似。癌细胞凋亡的研究结果与MTT和细胞侵袭实验结果一致,进一步说明花色苷组分具有显著的抗肿瘤活性。
3 结 论
‘巨峰’葡萄皮色素粗提物经AB-8大孔树脂纯化-葡聚糖凝胶Sephadex LH-20纯化后,得到4 种组分,其中色素II为非花色苷类,色素I、色素III和色素IV分别为矢车菊-3-芸香糖苷、锦葵素-3,5-双葡萄糖苷-香豆酰和锦葵-3-半乳糖苷,其得率和纯度分别为(0.108±0.011)%、(0.053±0.007)%、(0.038±0.005)%和98.52%、96.84%、91.36%;而‘巨峰’葡萄皮色素粗提物经AB-8大孔树脂纯化-聚酰胺树脂纯化后,样品在相同HPLC条件下检测,花色苷组成比例相差较大,原因需进一步研究。探究色素I、色素III和色素IV对抗肿瘤活性的影响发现,3 种花色苷组分均能显著抑制HepG2肝癌细胞和A549肺癌细胞的增殖和侵袭能力,并且显著增加癌细胞的凋亡。3 种花色苷组分的抗肿瘤效果顺序依次为色素III>色素I>色素IV。研究结果为花色苷分离鉴定及天然抗肿瘤药物的开发提供理论依据。
