枇杷功能成分及生物活性研究进展
2020-03-31刘丽丽刘玉垠赵小娜鲁周民
刘丽丽,刘玉垠,王 杰,赵小娜,鲁周民
(西北农林科技大学林学院,陕西 杨凌 712100)
枇杷(Eriobotrya japonica(Thunb.)Lindl.)又名卢桔,属于蔷薇科枇杷属常绿小乔木,原产于中国。枇杷资源种类多样、分布广泛,在中国主要分布在福建、四川、浙江、江苏、广东和陕南等地[1],后经引种在日本、巴基斯坦、以色列、西班牙、马达加斯加、美国等地都有分布[2]。
枇杷在人类医疗、食用方面发挥着重要的作用。枇杷果实柔软多汁、味道甘酸,富含多种营养元素和功能成分[3-4]。枇杷叶是中国传统中药,据《中国药典》记载,枇杷叶饮片能归肺、胃经,止咳清肺、降逆止呕;用于肺热咳嗽、气逆喘急、胃热呕逆、烦热口渴[5]。现今枇杷叶已被加工成多种止咳制剂走进人们生活,包括枇杷露、膏、冲剂、胶囊、颗粒、滴丸等[6]。研究表明枇杷叶中的三萜酸是与止咳功能相吻合的活性成分,除此之外三萜酸还有抗肿瘤等功能;枇杷果实、花和种子中的萜类、酚类、黄酮、挥发油和苦杏仁苷等活性成分,具有止咳平喘、抗氧化、抗肿瘤、保肝护肾和降血糖等作用,有潜在的开发利用价值。
1 主要功能成分
1.1 萜类
萜类是广泛存在于植物组织中的次生代谢物质,根据其含的异戊二烯单位的数目分单萜、倍半萜、二萜、三萜和多萜[7]。枇杷中主要是6 个异戊二烯单位组成的乌苏烷型、齐墩果烷型(游离或以酯、苷的形式存在)五环三萜类和少量单萜化合物(表1),其主要分布在枇杷叶、花和果实中[8-20]。《中国药典》中记录的药用枇杷叶质量要求为:含齐墩果酸(oleanolic acid,OA)和乌苏酸(ursolic acid,UA)的总量不少于0.70%(以干质量分数计,下同)[5]。洪燕萍等[21]对11 种枇杷属植物中主要三萜酸含量进行测定,发现南亚枇杷、台湾枇杷、栎叶枇杷、大花枇杷、大渡河枇杷、台湾恒春、早钟六号和普通枇杷野生树OA和UA总量均超过0.70%。枇杷果实中OA和UA总量在0.50%左右[11]。
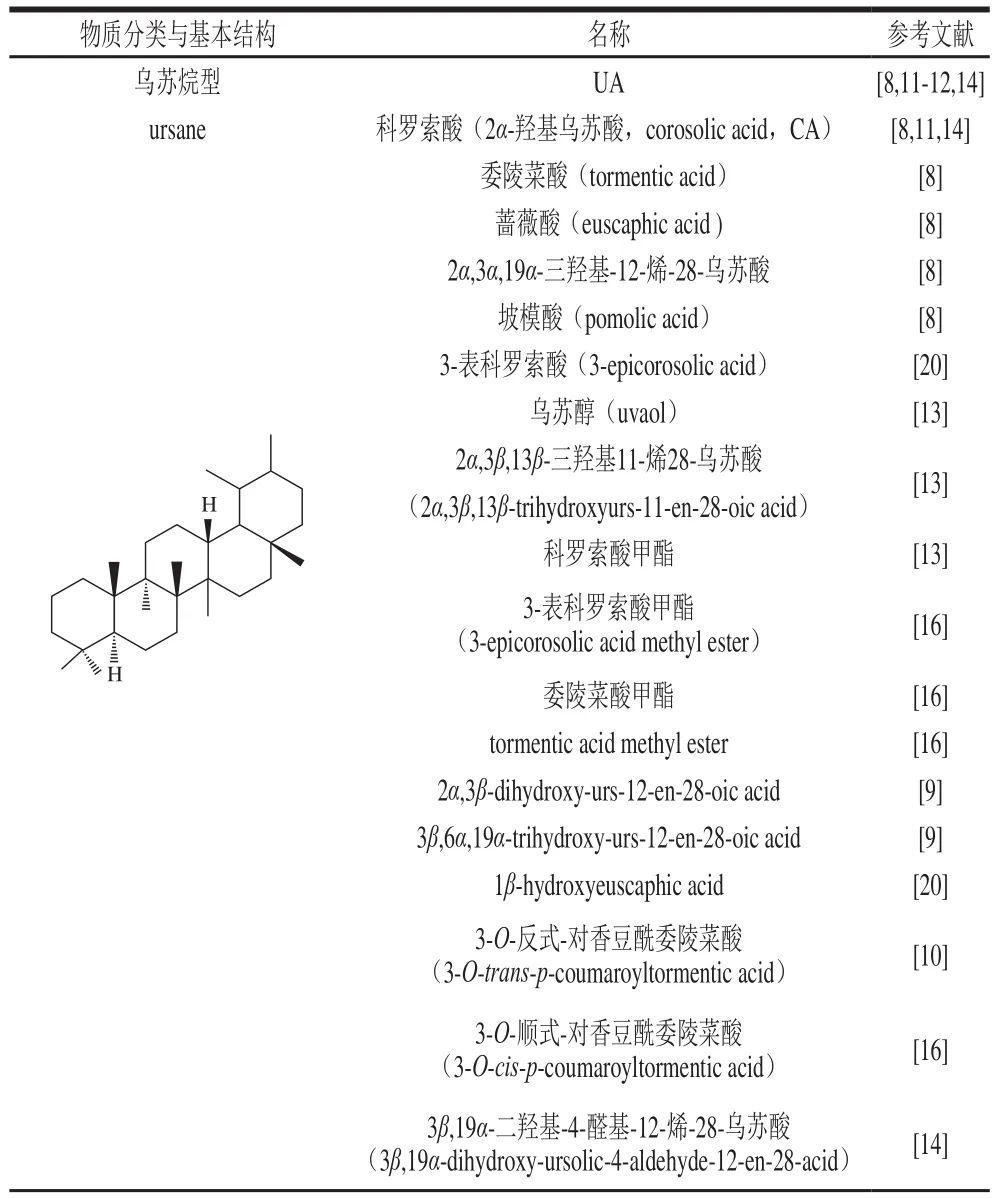
表 1 枇杷中萜类成分Table 1 Terpene compounds discovered in E. japonica

续表1
1.2 酚类和黄酮
酚类是羟基直接与芳环连接的化合物,包括简单酚类和多酚类物质。黄酮类是酚类化合物的一种,由两个芳香环(A和B)通过中央三碳链连接而成的色原烷或色原酮的2-或3-苯基衍生物,在植物体内常与糖结合成苷类或者以游离态存在[23]。枇杷果实、叶、花和种子中均含酚类物质[17,24-29]。据张文娜等[30]综述,目前枇杷中已鉴定酚酸(羟基肉桂酸和羟基苯甲酸)和黄酮类(黄酮醇、黄烷酮、黄烷醇和黄酮木脂素)等物质50余种,以下是近几年研究较多的枇杷酚类和黄酮物质(图1)。
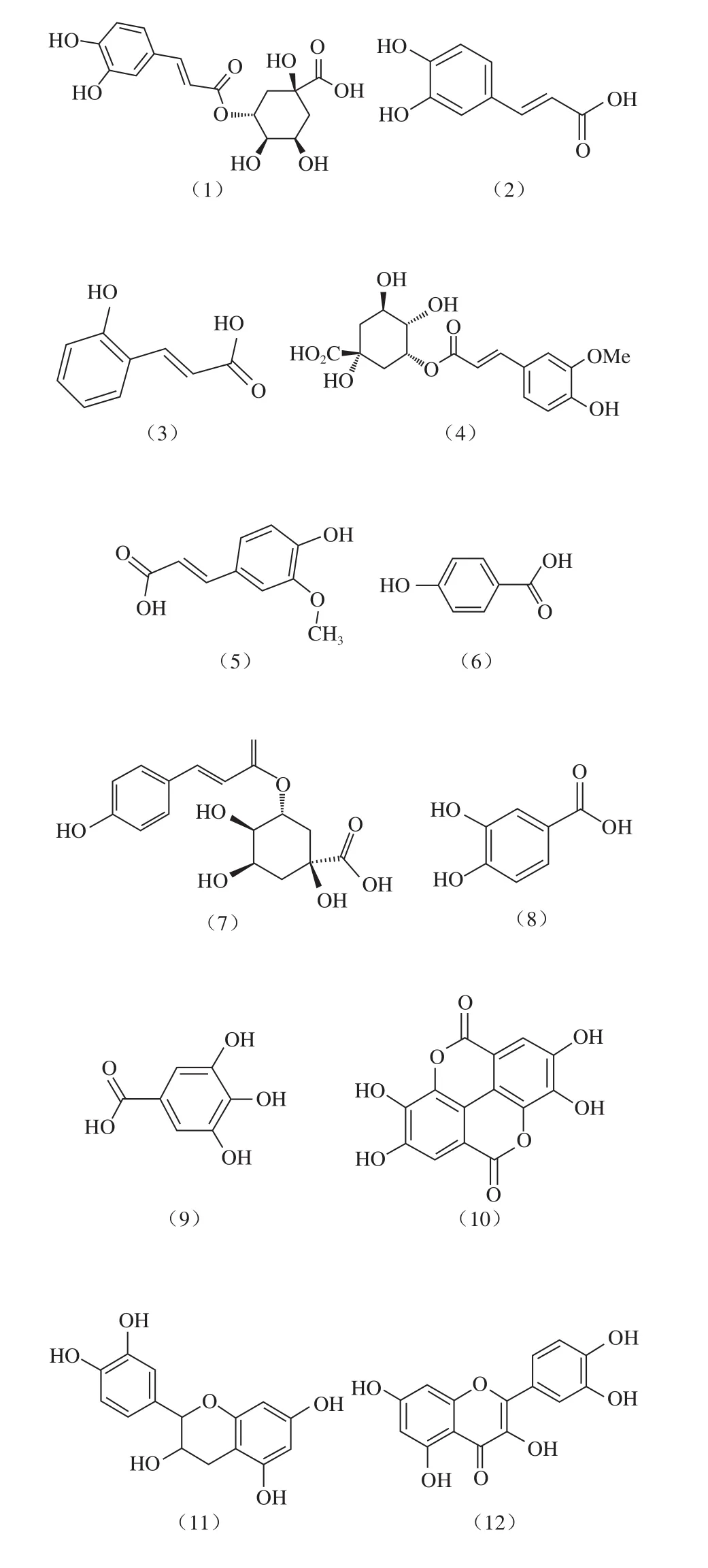
从枇杷中分离出的主要酚类物质有:绿原酸(1)、咖啡酸(2)、邻香豆酸(3)、5-阿魏酰奎宁酸(4)、阿魏酸(5)、对羟基苯甲酸(6)、3-对香豆酰奎宁酸(7)、原儿茶酸(8)、没食子酸(9)、鞣花酸(10)[25-27]。主要黄酮类化合物有:表儿茶素(11)[24]、槲皮素(12)[27]、槲皮素-3-O-半乳糖苷(13)、槲皮素-3-O-葡萄糖苷(14)、槲皮素-3-O-鼠李糖苷(15)、山柰酚-3-O-半乳糖苷(16)、山柰酚-3-O-鼠李糖苷(17)和山柰酚-3-O-葡萄糖苷(18)、芦丁(19)、原花青素B-2(20)、辛可耐因Ib(21)[17,25]。
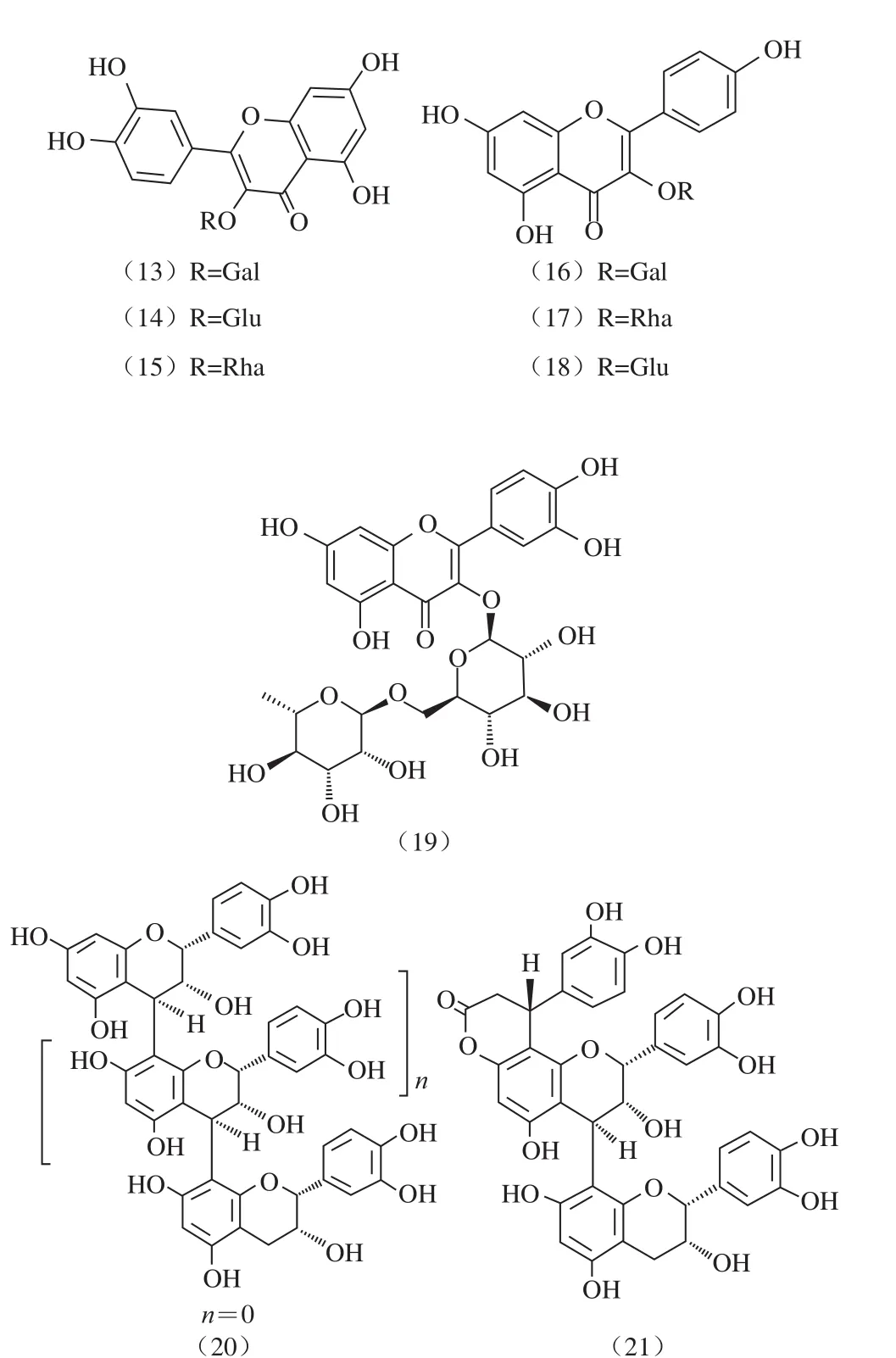
图 1 枇杷中主要黄酮和多酚化学结构式[17,22,31]Fig. 1 Chemical structures of major polyphenols and flavonoids in E. japonica[17,22,31]
1.3 挥发性成分
挥发油成分主要由萜类(倍半萜和单萜)、脂肪族或芳香族化合物组成[31]。枇杷花和种子中主要含苯甲醛、苯乙醇和苯甲酸等挥发性成分(表2)。
张丽华等[32]采用固相微萃取技术结合GC-MS分析,从枇杷花提取物中分离鉴定出49 种组分,包括酸(20.69%)、醛(16.86%)、醇(13.2%)、酯(8.18%)、萘(3.35%)和苯酚(0.95%)等,其中苯乙醇含量最高,其次为苯甲醛。不同品种、地域环境下的枇杷花香气成分有所差异。闫永芳[33]发现宁海枇杷花香气组分主要有32 种,苯甲醛相对含量最高,占20.86%,其次为二十八烷(14.94%)。Hong Yanping等[34]从香花、普通枇杷叶中共分离出109 种精油成分,植物醇含量均为最高,分别占相对含量的57.44%和17.81%。李长虹等[35]从枇杷核中分离出39 个化合物,鉴定出20 个,占挥发油总量的89.69%,其中苯甲醛(65.31%)和苯甲酸(20.42%)成分相对含量最高。
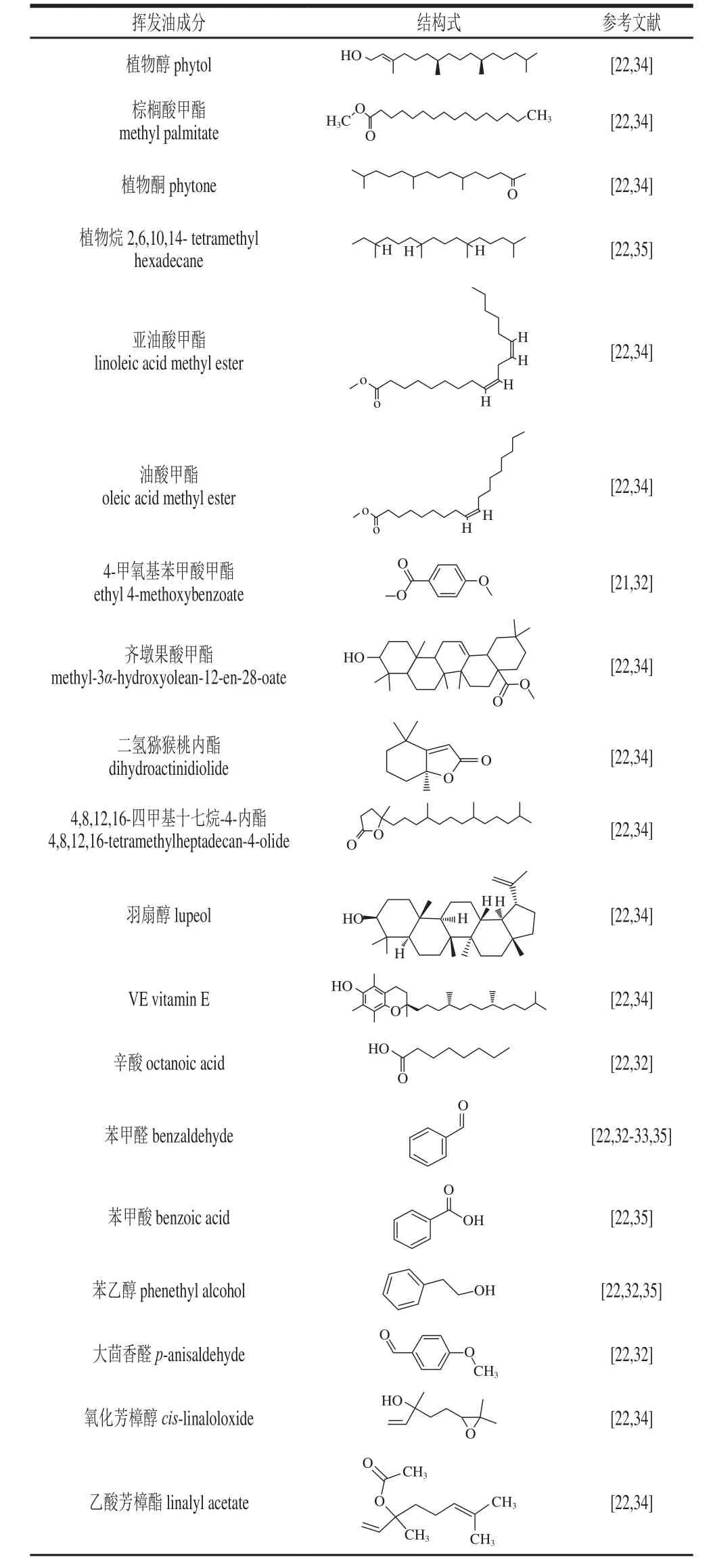
表 2 枇杷主要挥发油成分Table 2 Major volatile oils in E. japonica
1.4 苦杏仁苷
苦杏仁苷是芳香族氰苷(图2),其在苦杏仁苷酶、樱叶酶等β-葡萄糖苷酶作用下被水解,生成野樱皮苷和杏仁氰,后者遇热分解生成的带苦杏仁味的苯甲醛和氢氰酸有止咳平喘、抗炎等药理作用[36-37]。枇杷种子、花和果皮中都含有大量苦杏仁苷[29,38-40]。林国荣等[38]以高效液相色谱法测得解放钟枇杷核苦杏仁苷含量为2.11%。Wu Hui等[39]以同样的方法测定了24 种枇杷核中苦杏仁苷,其质量分数在0.22%~1.67%。目前医药用苦杏仁苷主要来自蔷薇科杏属(E. Prunus)植物的种子,枇杷种子还未被大量应用,这可能与含量低于标准3.0%有关[5]。

图 2 枇杷苦杏仁苷化学结构式[22]Fig. 2 Chemical structure of amygdalin in E. japonica[22]
2 影响功能性成分含量的因素
2.1 三萜酸含量的动态变化
OA、UA、CA和MA含量随器官、物候等变化。4 种三萜酸主要存在于叶部且会随着叶的发育进程积累增加;它们在叶、花、和果肉间质量分数不同,从高到低排序为落叶(23.2 mg/g)>成熟叶(21.7 mg/g)>嫩叶(17.5 mg/g)>果肉(7.36 mg/g)>花(6.40 mg/g)[11];季节变化也会对4 种三萜酸含量造成影响,OA、UA和CA含量随月份的变化较小;MA含量变化较大,最高在11月,质量分数为0.997%,8月份最低,为0.114%[41]。4 种三萜酸在同一生长阶段枇杷叶中,UA含量最高、OA最低[42]。枇杷果实和花中的三萜酸含量在不同品种和发育阶段表现出差异。周春华[29]研究24 种枇杷果皮中的OA和UA,发现含量范围分别在0.59~1.68 mg/g md和2.82~8.20 mg/g md;不同发育阶段的花和果实中OA和UA的变化规律在不同品种间不同。
2.2 黄酮和酚类含量的动态变化
枇杷叶不同部位、不同时期花的黄酮含量存在差异。叶尖黄酮含量最高,其次是叶中、全叶和叶柄,依次为(5.79±0.03)、(5.08±0.08)、(5.04±0.12)mg/g和(4.97±0.35)mg/g[43]。叶片不同发育阶段总黄酮含量不同,生长叶总黄酮含量高于落叶;叶片总黄酮得率受不同溶剂影响,水提取物中总黄酮含量高于乙醇提取物[44]。枇杷花从花蕾到盛开的整个过程(花蕾期、露白期、初放期和盛开期)黄酮和总酚含量总体上呈先上升后下降的趋势,其中露白期黄酮和总酚含量最高,分别是(13.39±0.45)mg/g和(76.06±1.18)mg/g[45];随着枇杷花发育阶段(早、中、晚期)不同,绿原酸和异槲皮苷含量先增加后降低,槲皮苷含量呈现上升趋势[33]。
不同品种间酚类物质含量以及不同提取溶剂和处理方式的提取效果存在差异。闫永芳[33]发现宁海白枇杷花的总酚、绿原酸和异槲皮苷的含量明显高于红枇杷花。周春华[29]发现大叶杨墩、软条白沙、大红袍、宝珠和夹脚5 个品种花的总酚含量差异显著(P<0.05),大叶杨墩含量最高,为9.15 mg/g,夹脚含量最低,为6.73 mg/g;以8 种有机溶剂对枇杷花类黄酮和总酚进行提取,表明甲醇和乙醇提取效率较高。陈翔等[40]发现50 ℃烘干处理可以较好的保留花中槲皮素等含量。
2.3 苦杏仁苷含量的动态变化
枇杷苦杏仁苷含量因发育阶段、品种特性、组织器官和处理方式而不同。Wu Hui等[39]发现中枇杷种子苦杏仁苷含量随着种子发育至果实成熟过程先上升后下降;比较24 个品种苦杏仁苷含量,发现早钟枇杷含量最高(1.67%),大红袍最低,为0.22%。大红袍枇杷果实中种仁苦杏仁苷含量最高,种皮和果皮次之,果实中含量最低;软条白沙枇杷花的花瓣、萼片,雌雄蕊和穗梗中苦杏仁苷含量差异显著(P<0.05),其中含量最高的是花瓣(0.37%)[29]。-20 ℃贮藏的鲜枇杷核在缓慢解冻(25 ℃)和快速解冻(100 ℃)条件下苦杏仁苷含量分别降为贮藏前的13.94%和72.27%;流通蒸气法灭酶长期贮藏的种子苦杏仁苷含量保持稳定[46]。陈翔等[40]发现,白枇杷在盛花期苦杏仁苷含量最高,晚花期较低;加工处理时以烘箱50 ℃干燥法可以保留较高的苦杏仁苷含量。
枇杷中三萜酸、黄酮、酚类物质和苦杏仁苷含量因部位、发育程度、品种特性、加工处理方法等的不同而有所差异,对其变化规律研究有利于选择最佳的采集利用时期。
3 生物活性研究
3.1 止咳平喘作用
枇杷叶在临床上主要用于止咳,其中起主要作用的是三萜类物质。实验中常以枸橼酸喷雾、辣椒素、浓氨水法和组胺、乙酰胆碱法和SO2法等建立小鼠、豚鼠咳嗽模型,以酚红排泌法建立生痰模型和小鼠耳肿胀法研究枇杷叶、花和种子提取物的止咳平喘祛痰活性。
鞠建华等[8]研究枇杷叶乙醇提取物的醋酸乙酯和正丁醇萃取物的镇咳作用,发现当UA剂量为240 mg/kg mb,总三萜酸剂量分别为400、200 mg/kg mb时可以显著缩短咳嗽潜伏期(P<0.05),减少咳嗽次数(P<0.05,P<0.01);枇杷叶醇提取物中乌苏酸、2-羟基齐墩果酸和总三萜酸对二甲苯引起的小鼠耳肿胀显示很强的抗炎活性。张娜等[47]研究发现枇杷叶水提取物有止咳活性的剂量为0.8~3.2 g/kg mb。陈晓芳[48]以辣椒素刺激C-纤维释放P物质、格列苯脲阻断ATPK离子通道研究枇杷花醇提取物(flower of Eriobotrya japonica,FEJ)的止咳机制,发现FEJ中、高剂量组(1.5、3.0 g/kg mb)可以极显著减少P物质生成(P<0.01),但格列苯脲抑制不会对FEJ的镇咳作用造成影响;止咳制剂机制可能是FEJ减少C-纤维P物质表达而非激动钾离子通道达到镇咳效果。林国荣等[37]发现醇提枇杷核苦杏仁苷在100~150 mg/kg mb(相当于生药量2~3 g)时与对照清肺糖浆表现相似的止咳效果;100 mg/kg mb剂量的核提取液对抗小鼠耳肿胀的效果优于150 mg/kg mb阿司匹林,枇杷核苦杏仁苷提取液有很好的止咳抗炎作用。
因加工方法及提取溶剂不同、枇杷叶提取物的化痰平喘作用也存在差异,蜜炙枇杷叶的止咳化痰平喘总体效果明显优于生枇杷叶,水提物优于醇提物[49]。枇杷落叶和生长叶的水、乙醇提取物的止咳平喘化痰作用也有差异,生长叶水提取物化痰作用较高、可能与高黄酮含量有关联;落叶乙醇提取物中较高的止咳作用可能与三萜酸含量较高有关[43]。
3.2 抗炎作用
三萜酸对关节炎、慢性支气管炎和呼吸系统疾病有明显的抑制。Zhang Jingxiao等[50]以系统药理学方法探究枇杷叶的抗炎活性,结果发现枇杷叶含有11 种抗炎成分,它们主要将前列腺素合成酶(prostaglandin G/H synthase 2,COX2)、花生四烯酸盐-脂氧合酶(arachidonate 5-lipoxygenase,ALOX5)、过氧化酶增殖因子活化受体(peroxisome proliferator-activated receptor gamma,PPARG)、肿瘤坏死因子(tumor necrosis factor,TNF)和转录因子p65(transcription factor p65,RELA)作为靶点,通过参与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、类风湿性关节炎途径和NF-κB信号通路调控相关基因表达控制炎症的发生。
葛金芳等[51-52]以气管注入脂多糖联合尾静脉注射卡介苗建立慢性支气管炎动物模型,研究发现枇杷叶三萜酸(triterpene acids of loquat leaf,TAL)可明显减少支气管腔内的分泌物和黏膜上皮细胞脱落,并抑制支气管黏膜上皮细胞增生,使支气管内径增大通气量增大;TAL灌胃给药对大鼠腹腔毛细血管渗出、肉芽肿和原发性、继发性佐剂性关节炎等炎症病变有明显的抑制作用。Takuma等[53]用5-氟尿嘧啶(5 fluorouracil,5-FU)给药制备仓鼠黏膜炎模型实验枇杷种子提取物(E. japonica seed extract,ESE)抗炎作用,发现ESE可能通过预防和控制黏膜炎部位细菌感染和使用抗癌药物后体内过度氧化应激,促进化疗引起的黏膜炎的愈合。Yang Yaru等[54]发现TAL对博莱霉素A5诱导大鼠肺纤维化有减缓作用,其机制可能与TAL能抑制肺巨噬细胞中肿瘤坏死因子-α(tumour necrosis,TNF-α)、转化生长因子-β1(transforming growth factor,TGF-β1)的表达有关。
3.3 抗氧化作用
枇杷黄酮提取物有抗油脂氧化活性。蒋企洲等[55]研究枇杷叶黄酮对芝麻油和猪油的抗氧化性能,结果显示10%枇杷叶黄酮提取物可以降低贮藏过程中芝麻油和猪油的过氧化值,其中对芝麻油抗氧化效果和0.05%叔丁基对苯二酚(tert-butyl hydroquinone,TBHQ)相近;枇杷叶黄酮与抗坏血酸有协同作用,可以显著抵抗猪油氧化。Delfanian等[56]以TBHQ为对照,过氧化值、游离脂肪酸值、共轭二烯和三烯值为指标,研究枇杷果皮多酚提取物在大豆油煎炸(24 h、180 ℃)和贮藏过程中的抗氧化作用(60 d、25 ℃),发现煎炸过程中400 mg/kg枇杷果皮多酚提取物的抗氧化活性高于TBHQ和其他处理,但贮藏过程中抗氧化活性稍低于TBHQ,枇杷果皮多酚是潜在的天然植物油抗氧化剂。
枇杷黄酮和酚类等提取物有清除体内外自由基的能力。林素英等[24]研究发现枇杷果实酚类物质对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基有清除作用,其中绿原酸、新绿原酸和隐绿原酸与抗氧化能力呈正相关。王建超[57]比较枇杷叶多酚纯样、茶多酚和抗坏血酸对DPPH自由基、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基、羟自由基、亚硝基自由基的清除能力,发现枇杷叶多酚抗氧化性高于茶多酚、与抗坏血酸相当。许丽旋[58]发现枇杷叶黄酮质量浓度为0.05~4.00 g/L时能减少小鼠肝线粒体及肝匀浆丙二醛(malondialdehyde,MDA)的生成,抑制H2O2诱导的小鼠红细胞溶血。枇杷核总黄酮提取液对羟自由基的清除率最高可达55%[28]。李长虹等[35]研究发现25%枇杷核挥发油的抗氧化性高于2.00 mg/mL的VC。
抗氧化性强弱受提取溶剂和方法的影响。Delfanian[56]采用DPPH法、β-胡萝卜素/亚油酸体系法和rancimat法,比较浸提法、超声辅助法和超临界CO2提取法对枇杷果皮提取物抗氧化性的影响,发现当剂量为400 mg/kg时,枇杷果皮抗氧化活性为浸提法>超声辅助>超临界CO2提取物。乙醇、水、乙醇-水(体积比1∶1)3 种溶剂对枇杷果肉、果皮中提取物及其抗氧化性的影响不同,以乙醇-水(体积比1∶1)法获得的提取率和抗氧化活性均较高,果皮的抗氧化性高于果肉,可能与果皮中酚类物质含量较高有关[59]。
3.4 抗菌免疫作用
枇杷三萜类、挥发性成分有抗菌、抗过敏活性。Tan Hui等[60]研究了枇杷叶中18 种三萜酸对皮肤痤疮丙酸杆菌(Propionibacterium acnes)的抑制作用,其中12 种三萜酸对P. acnes表现抑制作用,其中以乌苏酸、山楂酸、科罗索酸和蔷薇酸的抑制作用最强,4 种三萜酸的最小抑制(生长)浓度(minimum inhibitory concentration,MIC)均为50 μg/mL,最低杀菌(杀死)浓度分别为100、150、100、50 μg/mL。肖新生等[61]采用滤纸片法,研究发现枇杷叶水提取物、乙醇提取物、正己烷提取物对食品中常见污染菌大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)均有抑制作用,其中乙醇提取物抑菌效果最好,最低抑菌浓度分别为大肠杆菌100 μg/mL,金黄色葡萄球菌10 μg/mL,枯草芽孢杆菌1 000 μg/mL。Hong Yanping[34]发现香花、普通枇杷叶精油提取物对白色念珠菌(Canidia albicans)和木霉菌(Trichoderma spp.)有抑制作用。
Tan Hui等[60]以β-氨基己糖苷酶释放量为指标建立大鼠嗜碱性粒细胞系(rat basophilic leukemia,RBL-2H3)过敏性疾病模型,研究枇杷叶三萜酸提取物抗过敏性,结果发现乌苏酸(1 μg/mL(质量浓度,后同)、72.5%(抑制率,后同))、3-表科罗索酸(9 μg/mL、54.4%)、和蔷薇酸(12 μg/mL、74.5%)可以显著抑制β-氨基己糖苷酶释放,有很好的抗过敏活性。Onogawa等[62]探明枇杷种子醇提取物(E. japonica seed extract,ESE)含有抗组胺剂,能通过抑制豚鼠肥大细胞释放组胺而缓解I型过敏即时反应引发的背部血管扩张、通透性增加等过敏性症状;建立豚鼠过敏性鼻炎实验模型,发现ESE能减少豚鼠打喷嚏和抓鼻子的频率,增加鼻腔黏液的分泌。
3.5 保肝护肾作用
枇杷提取物对乙醇、病毒等所致肝肾损伤有保护作用。Wu Shaokang等[63]证明枇杷花黄酮提取物能通过降低丙氨酸氨基转移酶、天冬氨酸氨基转移酶、甘油三酯、丙二醛和肝脏指数,减少乙醇代谢对肝脏细胞的损害;通过促进脂肪型甘油三酯脂肪酶和血红素加氧酶-1(heme oxygenase-1,HO-1)mRNA的表达最终减轻肝细胞脂肪变性程度,对小鼠急性酒精性肝损伤有保护作用。何玉琴等[64]以尿素氮和肌酐为主要指标研究枇杷叶提取物对鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)人工感染鸡肝肾功能的影响,实验表明与阳性对照相比,枇杷叶提取物均能降低尿素氮和肌酐等生化指标含量,以质量分数0.8%效果最佳(P<0.05);0.8%和1.0%枇杷叶提取物能极显著增强血清IBV抗体水平(P<0.01),抑制IBV对鸡肝肾功能的破坏。以二甲基亚硝胺和CCl4建模,发现枇杷核提取物能改善二甲基亚硝胺和CCl4造成的大鼠肝损害,但对CCl4类型改善稍弱;进一步以不同时间给予不同剂量CCl4建立大鼠肝损害模型,发现建模8 周时枇杷核提取物对肌酐中的视黄醛类、TGF-β以及羟脯氨酸量呈改善状况,肝纤维化减弱,与对照组无明显差异[65]。
3.6 抗肿瘤作用
枇杷中的乌苏烷型、齐墩果烷型三萜和部分黄酮化合物对淋巴瘤、乳腺癌细胞、胰腺癌细胞和白血病细胞有抑制作用。Ito等[66]通过体外实验和小鼠皮肤致癌测试证明,从枇杷叶中分离出的玫瑰苷和原花青素B-2对淋巴瘤早期抗原细胞抑制作用强于(-)-表没食子儿茶素没食子酸酯。Kim等[67]发现枇杷叶、种子醇提取物可以通过抑制黏附蛋白的表达或活性、诱导组织重构、细胞外基质基底膜降解、血管生成和肿瘤侵袭转移相关酶(基质金属蛋白酶)的活性来控制人类乳腺癌细胞系(MDA-MB-231)的增殖。Lu Qingyi等[68]以13C追踪、流平衡分析,研究了枇杷叶提取物(loquat leaf extract,LLE)对人胰腺癌细胞(MIA PaCa-2)代谢的影响,发现LLE对MIA PaCa-2细胞活性呈剂量依赖性抑制,以质量浓度200 μg/mL效果较好;抑制机制可能为LLE通过改变肿瘤细胞氧化/非氧化戊糖和丙酮酸脱氢酶/异柠檬酸脱氢酶通量比抑制肿瘤细胞的核糖和脂肪酸的新合成。
研究证明三萜酸能诱导白血病细胞凋亡。李琪[69]发现齐墩果酸、乌苏酸和2α-羟基齐墩果酸对白血病细胞K562(人慢性白血病细胞)有抑制效果,其中乌苏酸质量浓度为20 μg/mL时对癌细胞生长抑制率达91.96%。Uto等[70]发现枇杷叶三萜酸提取物(UA、OA、CA、MA),尤其是CA能有效诱导HL-60(白血病原髓细胞)细胞凋亡,凋亡机制除线粒体通路外还涉及死亡受体通路,具体为CA能诱导凋亡蛋白酶Caspase-8和Caspase-9的活化,Caspase-8的活化通过诱导tBid介导的细胞凋亡相关基因Bax活化而触发线粒体功能障碍。Zar等[71]研究枇杷叶茶提取物(loquat tea extract,LTE)可以通过线粒体功能障碍途径抑制人早幼粒白血病(HL-60)细胞扩散并诱导其凋亡,LTE对HL-60细胞的抑制表现为剂量依赖性抑制,且24 h半抑制浓度为40 μg/mL。
3.7 降血糖作用
枇杷叶、果实和种子提取物有降血糖功能。Tommasi等[9]以糖尿病小鼠和正常小鼠进行实验,首次发现了倍半萜苷的降血糖作用,并指出乌苏烷型三萜酸3β,6α,19α-trihydroxy-urs-12-en-28-oic acid和2α,3βdihydroxy-urs-12-en-28-oic acid 2 种物质可以显著抑制糖尿病小鼠血糖并能降低正常小鼠血液中糖含量。
Shih等[72]探究了枇杷提取物(cell suspension culture of Eriobotrya japonica,TA)对高脂喂养小鼠的糖尿病和高血脂症状的调节作用机理,发现TA可以增加肝脏和脂肪组织中AMPK-α(Thr172)磷酸化蛋白的含量,有效预防高脂喂养引发的血糖、瘦素和胰岛素水平的增加。调节机理可能是通过抑制催化甘油三酯合成的酰基辅酶A和二酰基甘油酰基转移酶2的表达,而表现出降血脂作用;通过磷酸烯醇式丙酮酸羧激酶下调,改善胰岛素致敏和TA(1.0 g/kg剂量)降低肝脏和脂肪11-β-羟基类固醇脱氢酶的表达,减少肝葡萄糖产生,最终表现抗糖尿病特性。Shafi等[73]以四氧嘧啶建模,评价枇杷果实醇提物抗糖尿病和降血脂作用,发现200 mg/kg mb给药10 d能显著降低小鼠血糖血脂水平,其机制可能为果实醇提物刺激β细胞分泌胰岛素或增强组织对糖的吸收。
4 结 语
枇杷有很好的食用和医疗保健作用,包括治咳嗽、清肺祛痰、抗氧化、抗菌、抗炎、抗肿瘤、保肝护肾;各功能成分含量随枇杷部位、品种特性、物候特征、加工处理方式而呈现一定的规律性,对其成分、功能及其变化规律的研究有利于枇杷药品制剂、食品和保健品开发。
一直以来枇杷因果实美味营养、止咳抗炎作用明显而受到广泛欢迎。近年来对枇杷功能成分的研究取得了一定的成果,但是从整体上来看,枇杷功能成分的利用的研究还不够深入,还有一些方面需要进一步深入研究,比如:1)枇杷三萜酸含量丰富有止咳抗肿瘤的作用,而目前在临床上枇杷主要用来止咳,其多种抗癌功效并未得到有效发挥,因此对枇杷叶抗肿瘤药剂研发具有广泛前景;2)枇杷果实味美,但枇杷果实成熟期短、不耐贮藏,对可应用于生产的枇杷保鲜贮藏还有待深入研究;另外,目前市场上枇杷加工产品较少、还没有形成产业化,所以还需要对果实加工进行深入有效的研究。枇杷黄酮和挥发性成分天然、低毒,可作为美容产品、食品的添加剂、香料和精油进行开发;3)枇杷种子苦杏仁苷含量高,有祛痰止咳、抗氧化等功效。2015年中国的枇杷产量已达52.1万 t[74],按照种子约占果实总质量的12%~25%[3]计算,有极其可观的种子副产物,也为苦杏仁苷的提取以及应用提供了大量的原料,可进行枇杷核苦杏仁苷提取并开发医药制剂。
