微藻产叶黄素研究进展
2020-03-31陕梦迪张芳张怡王昭凯杨隆河胡凡
陕梦迪,张芳,,*,张怡,3,王昭凯,杨隆河,胡凡
(1.福建农林大学食品科学学院,福建福州350002;2.自然资源部第三海洋研究所,海洋生物资源综合利用工程技术研究中心,福建厦门361005;3.中爱国际合作食品物质学与结构设计研究中心,福建福州350002)
叶黄素(lutein),又名“植物黄体素”,普遍存在于植物的叶片、花朵中,目前工业提取主要来源于万寿菊等植物。万寿菊种植周期长,土地占用及人力成本较高,提取效率低,难以满足日益增长的市场需求,因此寻求新的叶黄素工业生产原料尤为紧迫。微藻生长周期短,采用反应器培养有效突破耕地占用和自然气候影响,更适于工业化生产管理及质量控制,是叶黄素生产的潜力来源之一[1]。本文从叶黄素高产藻种筛选、叶黄素合成代谢调控途径优化、叶黄素高效节能提取工艺探索及叶黄素功能活性发现等方面展开综述,期望对进一步推动微藻叶黄素的工业化生产提供理论参考。
1 叶黄素高产微藻种类
许多绿色植物和果蔬中都含有叶黄素,根据美国数据库显示,每100 g 绿色蔬菜中叶黄素含量最高可达40 mg 左右,但主要以纯结晶的形式存在,人体吸收利用率低[2]。小球藻、栅藻、衣藻等微藻中都含有叶黄素,但不同藻种生物量、叶黄素含量和产量也不尽相同,具体见表1。

表1 微藻及其它植物叶黄素含量比较Table 1 Comparison of lutein content in microalgae and other plants
相比而言,小球藻属叶黄素含量较高,其中选育的突变株Chlorella zofingiensis CZ-bkt1 叶黄素含量高达13.81 mg/g,是万寿菊的16 倍,具有良好的工业化应用前景。
2 提高叶黄素产量的代谢调控策略
2.1 基因工程改造
随着生物技术的发展,高等植物中叶黄素的合成途径及关键限速酶已比较清晰,如图1 所示[15]。
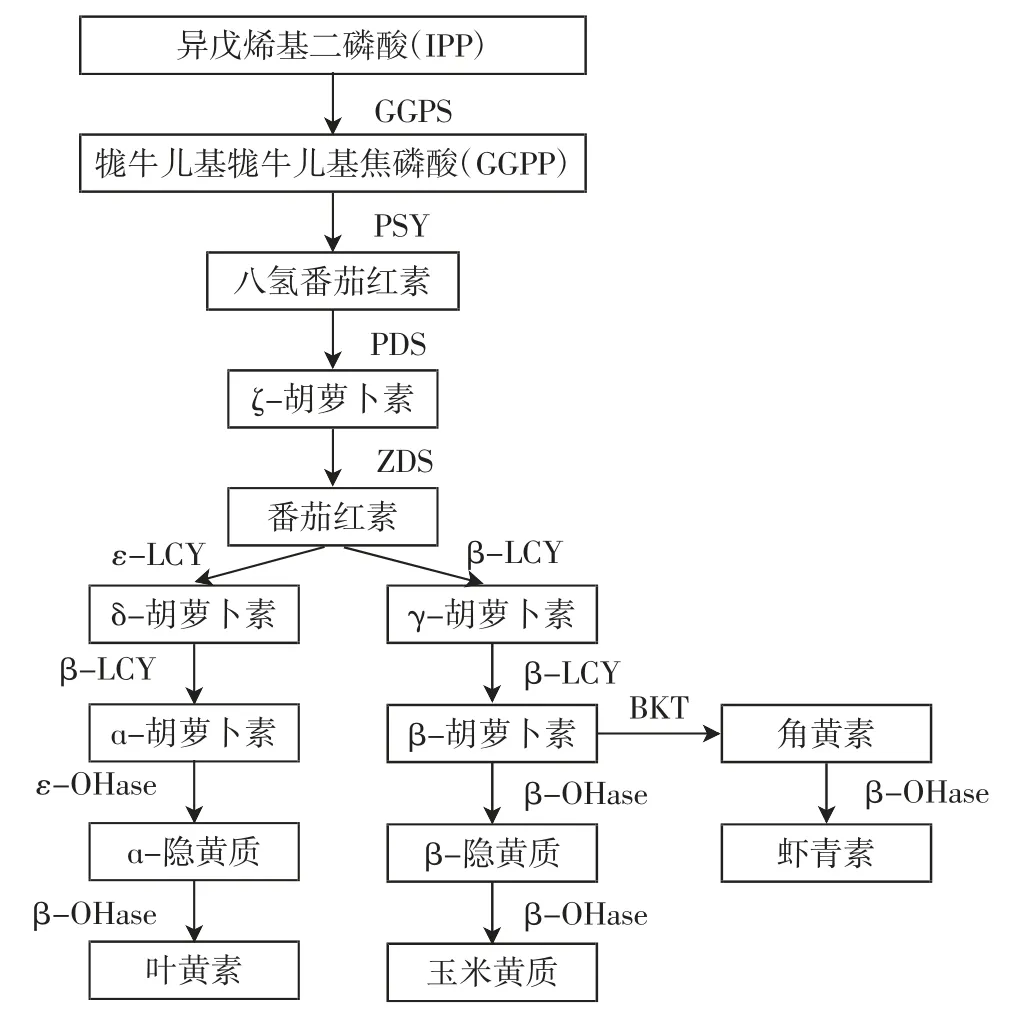
图1 高等植物中叶黄素的合成途径和关键酶的作用Fig.1 Synthetic pathway of lutein and the role of key enzymes in higher plants
目前利用分子生物学手段或诱变方式促进微藻叶黄素积累的主要途径有:(1)过量表达微藻叶黄素合成途径中的关键酶基因。如在Chlamydomonas reinhardtii中过量表达八氢番茄红素合成酶(phytoene synthase)基因,使叶黄素含量从1.95 mg/g 提高到4.29 mg/g[16]。(2)诱变筛选叶黄素高产藻种。如通过化学诱变剂甲基硝基亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)处理小球藻获得突变体藻株CZ-bkt1,叶黄素含量可达(13.81±1.23)mg/g[8]。(3)在叶黄素含量较低的微藻中,转入更高效率的功能基因。如建立根癌农杆菌介导普通小球藻的遗传转化体系,将IPP 异构酶基因(idi)转入普通小球藻中,叶黄素含量最高达0.84 mg/g,与野生型相比提高了30.95%,叶黄素产量最高达1.98 mg/L,提高了36.77%;将透明颤菌血红蛋白基因(vgb)转入普通小球藻中,叶黄素含量最高达0.88 mg/g,与野生型相比提高了5.93%,叶黄素产量最高达 2.91 mg/L,提高了 47.19%[17]。
2.2 培养方式及发酵条件优化
2.2.1 培养方式优化
除光能自养外,一些微藻还能通过异养或混养等多种营养方式培养,针对不同藻种探索最佳培养方式能有效提高叶黄素产量。通过比较不同培养方式对Scenedesmus obliquus 产叶黄素的影响,发现同时添加葡萄糖与光照混合培养时叶黄素产量最高,达6.45 mg/L,是自养的2.6 倍,异养的26.9 倍[18]。谢友坪等[12]通过脉冲式添加氮源(即根据氮源的消耗定时添加氮源)培养藻株F51,当初始氮源耗尽时,开始脉冲流加浓度为880 mmol/L 的硝酸钠溶液,使培养液中氮源浓度达到2.2 mmol/L,待氮源耗尽时,再次开始脉冲流加氮源,叶黄素的产率达3.56 mg/L/d。刘龙军[19]在1L 发酵罐中进行Chlorella protothecoides 的间歇流加培养时,叶黄素产量达40 mg/L,比分批培养提高了23.8%,实现了叶黄素的高效积累。Ho 等[20]用补偿率为10%的新鲜培养基半连续操作来培养微藻FSP-3,生物量达1 304.8 mg/L/d,叶黄素生产率达6.01 mg/L/d。
2.2.2 发酵条件优化
1)培养基碳、氮源优选。研究发现不同碳氮源对微藻生长及叶黄素合成有显著影响,有机碳源和无机氮源更有利于叶黄素合成。如在培养Prochlorococcus sp.时以尿素为氮源代替硝酸钠,叶黄素含量从2.54 mg/g增加到3.34 mg/g[21],以葡萄糖和硝酸钾为碳源和氮源培养小球藻,叶黄素产量可达3.07 mg/L/d[22],以醋酸钠和硝酸钠作碳氮源,叶黄素产量达3.97 mg/L/d[23]。
2)温度、光照和通气量等条件优化。不同藻种合成叶黄素的最佳温度有所差异,栅藻在30 ℃时叶黄素产量达3.6 mg/L/d[24],耐温微藻F51 在35 ℃时叶黄素产量达 3.05 mg/L/d[11]。其次,Ho 等[25]比较白、红、蓝、绿4 种单色光源对6 种微藻叶黄素产量的影响,结果表明白光更有利于叶黄素积累,其中S.obliquus FSP-3在白光下的叶黄素含量达(4.84±0.23)mg/g。另外,提供合适的增量光照(初始光强50 μmol/m2/s,每8 h 增加一次,直到最适光强260 μmol/m2/s)可使叶黄素产量达5.35 mg/L/d[26]。通入高浓度CO2,在形成酸性环境条件的同时增大碳源的供给,使新型酸性环境微藻Coccomyxa onubensis 的叶黄素产量高达5 mg/g~6 mg/g(干重)[27]。
3)胁迫条件促进色素积累。通常情况下,微藻细胞指数生长期与次级代谢产物积累期并不同步。微藻培养至稳定期后,由于营养物质的消耗和环境条件的改变,可能会导致叶黄素的产量上升缓慢甚至不再上升,这时可以改变原有条件,增加胁迫条件如饥饿、高温、高压、高渗、活性氧等来诱导叶黄素大量积累。研究发现氮胁迫(低氮可能诱导细胞启动叶黄素保护机制)、磷胁迫(磷是细胞膜磷脂和一些酶的重要组成元素,磷可以通过影响PSY 酶的活力进而影响叶黄素产量)和高温胁迫(栅藻对高温有一定的适应能力,生物量略有下降但有利于叶黄素的积累,然而温度过高可能会导致藻体大量死亡)对栅藻叶黄素积累影响较大,当 NaNO3浓度 1.5 g/L,K2HPO4浓度 0.01 g/L,45 ℃下胁迫4 h 时,叶黄素含量提高了38.9%[18]。此外,刘龙军[19]发现,低浓度的化学氧化剂对叶黄素的合成有利,在含有0.5 mmol/L Fe2+的培养基中加入0.1 mmol/L的H2O2,或加入0.01 mmol/LNaClO 时,叶黄素含量较不加氧化剂时均有显著提高。这可能是因为在外界环境中活性氧浓度较低时,自身抗氧化物不足以猝灭活性氧的微藻细胞受到攻击从而促使细胞内产生抗氧化物质如叶黄素,猝灭活性氧来保护细胞不被伤害;但当活性氧浓度过高时,细胞中的抗氧化物不足以清除活性氧,从而导致细胞损伤甚至死亡。
4)前体物质或稀土元素添加。如番茄汁在添加3 mL/L 时叶黄素含量和产量分别达2.18 mg/g 和21.89 mg/L,这可能是因为番茄汁中含有叶黄素合成的主要前体物质—番茄红素,能够使得叶黄素合成和积累增加;亮氨酸浓度在20 mg/L 时,叶黄素含量和产量都达到了最高值,分别为2.16 mg/g 和20.19 mg/L,这可能是因为亮氨酸可转化为甲羟戊酸的前体物,而甲羟戊酸是AcCoA 合成IPP 途径的中间代谢产物,间接促进叶黄素合成[28]。Franz 等[29]发现稀土元素能提高微藻细胞的生长速率,同时 Ce3+、Gd3+、La3+和 Sc3+的存在使叶黄素的含量增加,而Pr3+和Lu3+则使叶黄素含量降低,但是稀土元素促进叶黄素合成的机制尚未清楚。
3 叶黄素提取工艺
3.1 有机溶剂浸提法
有机溶剂浸提法是提取微藻叶黄素最简便有效的方法。桂林等[30]用甲醇-二氯甲烷(2 ∶1,体积比)为提取剂,对蛋白核小球藻中的叶黄素进行提取,提取率达87.1%;将甲醇变为95%乙醇,叶黄素含量达4.28 mg/g[31];若用乙醇代替水,同时用二氯甲烷提取小球藻中叶黄素,含量从(0.20±0.00)mg/g 增加到(0.69±0.08)mg/g,提高了约 3.5 倍[32]。
除上述常用的有机溶剂外,Chen 等[33]用四氢呋喃(tetrahydrofuran,THF)作萃取剂对小球藻MB-1 进行萃取,叶黄素回收率达99.5%,远高于乙醇作萃取剂时叶黄素回收率(86.2%)。
3.2 前处理与溶剂提取结合
因微藻细胞壁的存在,单纯使用有机溶剂提取叶黄素效率低,采用超声破碎、脉冲电场(PEF)穿孔或纤维素酶破坏微藻细胞壁的前处理工艺能有效提高叶黄素提取率。超声波提取技术主要是利用超声波的空化作用加速物质运动,提高溶剂透过率,超声波的热效应、机械效应也进一步促进叶黄素溶出。Deenu 等[34]优化了小球藻湿藻体超声提取叶黄素的工艺,在超声强度 56.58 W/cm2,超声频率 35 kHz,料液比(mg/mL)3 ∶1 时,37.7 ℃提取 5 h 后叶黄素得率为 (3.16±0.03)mg/g。郑伟[18]选择甲醇 ∶二氯甲烷(3 ∶1)为叶黄素的提取剂,当料液比(mg/mL)为 2 ∶1,超声功率为135 W,超声20 min 时,叶黄素的含量达到3.17 mg/g,这与Deenu 等的研究结果相近。25 ℃~30 ℃、电场强度25 kV/m 时,采用脉冲电场技术(pulsed electric fields,PEF)辅助提取小球藻叶黄素,提取率提高了3.5 倍~4.2 倍[35]。纤维素酶能破坏细胞壁结构,反应条件温和,不仅能提高提取效率,还可减少有机溶剂的使用。盖霞等[36]采用酶法对藻粉中的叶黄素进行提取,当纤维素酶∶木聚糖酶体积比为3 ∶2,酶添加量为5 mL,酶解2.5 h 时,叶黄素提取量为2.18 mg/g。
3.3 超临界CO2萃取法
超临界流体萃取是利用压力和温度变化对超临界流体溶解能力的影响而进行的。将超临界流体与叶黄素混合,然后通过减压、升温使超临界流体变成普通气体,而叶黄素则完全或基本析出。这项技术具有操作方便、工艺简单、能耗低、毒性无残留等特点,作为一种应用于微藻领域的新技术,具有很大的发展空间。Wu 等[37]对小球藻中叶黄素的超临界CO2萃取进行了初步研究,叶黄素提取率达到了87%,与溶剂法的提取率接近。Antonio 等[38]以超临界CO2为萃取剂,乙醇为共溶剂,得出在65 ℃、550 bar 时叶黄素回收率达7.15 mg/g,并且此时叶黄素的纯度最高。也有证据表明,叶黄素在乙醇改性CO2中的溶解度比在纯CO2中高两倍左右[39],这就说明在超临界CO2提取叶黄素时,可以通过添加乙醇来提高叶黄素的溶解度,进而获得更多的叶黄素产量。
3.4 双水相系统法
由于双水相萃取具有保持生物活性、目标产物收率较高、经济环保、易于连续化操作等优点,所以被广泛应用于工业实践中。在研究小球藻叶黄素在聚乙二醇-磷酸盐双水相系统中的分配行为时发现,22.9%的PEG8000 和10.3%的磷酸盐在pH 7.0 时形成的双水相系统中,大部分叶黄素分布于上相,而藻渣则分布于下相,叶黄素的收率达81.0%,在一定程度上有所提高[40]。
4 叶黄素功能活性
4.1 抗氧化作用
叶黄素作为一种重要的天然抗氧化剂,有很强的抗氧化活性。通过DPPH 自由基清除法计算叶黄素抗氧化值,并与维生素C 和2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)进行比较,证明叶黄素浓度在0.05 mg/mL~0.50 mg/mL 内,抗氧化活性能力较强[41]。为了进一步加强叶黄素的抗氧化活性,任丹丹等[42]探讨了叶黄素和玉米黄质之间的体外协同抗氧化活性效果,得出当叶黄素∶玉米黄质质量比为1 ∶2 时,体外协同抗氧化效果最佳。此外,叶黄素在不同浓度会表现出抗氧化-促氧化的双重作用[43],这使得叶黄素的抗氧化活性进一步提高。
此外,经试验证实,给瑞士白化小鼠口服叶黄素250 mg/kg BW 时,可缓解辐射诱导的氧化变化并维持小鼠体内抗氧化系统的稳定[44],所以叶黄素能作为辐射防护剂,来维护身体健康。同时,叶黄素降低阿霉素(doxorubicin,DXR)引起的心脏和肾毒性也是由于其抗氧化作用来实现的[45]。
4.2 视力保护作用
现在,越来越多的眼部疾病包括年龄相关性黄斑变性(age-related macular degeneration,AMD)、年龄相关性白内障(age-related cataract,ARC)、视网膜光损伤和视网膜色素变性等频繁出现,对人们的正常生活造成影响。研究发现叶黄素摄入量不足会增加AMD 的患病风险,而膳食中较高含量的叶黄素则可显著降低AMD 的患病风险,其原因可能是增加叶黄素和玉米黄质摄入后,提高了早期AMD 患者的黄斑部色素密度值(macular pigment optical density,MPOD),改善了视网膜功能,延缓了病情发展[46]。杨敏等[47]发现7.5 μg/mL的叶黄素干预可显著减缓H2O2诱导的氧化应激反应,提高人视网膜色素上皮细胞(retinal pigment epithelium,RPE)的生存率、抑制细胞内活性氧(reactive oxygen species,ROS)浓度,保护RPE 细胞免受氧化损伤,从而对AMD 等眼部退行性疾病起到预防和减缓作用。
高血脂、高血糖等病症的频发,也可能诱发视网膜病变,从而影响人的视力。叶黄素处理可显著抑制由高葡萄糖引发的RPE 细胞早衰和ROS 的产生,增加SIRT1mRNA 和蛋白水平,使得叶黄素通过上调SIRT1 的表达来抑制ROS 的产生而表现出抗衰老的特性,从而在细胞中发挥有益作用[48]。Mehmet 等[49]对啮齿动物高脂饮食(high fat diet,HFD)诱导的肥胖症中脂质代谢情况进行研究,发现HFD 可能破坏代谢特征并导致氧化损伤,而100 mg/kg BW 叶黄素/玉米黄质的补充调节可能有助于改善这种损伤,所以叶黄素干预作为辅助治疗手段可用以防止糖尿病患者视力丧失。
4.3 学习认知作用
除保护视力外,叶黄素在一定程度上还能改善人们的学习和认知能力。Billy 等[50]通过试验发现补充10 mg 叶黄素和2 mg 玉米黄质一年可改善健康成人(18 岁~30 岁)及老年人的认知功能,同时还可改善老年男性的记忆力。
叶黄素提高学习认知作用的机制可能是基于其抗氧化能力,包括减少氧化应激损伤,降低氧化应力等,进而提高学习、记忆以及认知能力。对5 月龄雄性快速老化痴呆模型小鼠(SAMP8)的研究发现,高剂量叶黄素组的潜伏期明显缩短,过氧化氢酶(catalase,CAT)、乙酰胆碱酯酶(acetylcholinesterase,AchE)活性明显升高,谷胱甘肽(glutathione,GSH)含量明显增加,丙二醛(malondialdehyde,MDA)含量明显降低,海马组织细胞异常明显减少,这说明叶黄素可以减缓小鼠的老化痴呆,进而提高认知能力,但具体剂量仍有待研究[51]。
4.4 抗癌作用
叶黄素对乳腺癌、前列腺癌、肝纤维化等也有一定的抑制作用。Chang 等[52]发现,叶黄素可通过诱导NrF2 的核易位和蛋白质表达,改善细胞抗氧化酶的表达并减弱活性氧水平,同时减少与NF-κB 信号通路相关的NF-κBp65 蛋白的表达,从而抑制乳腺癌细胞增殖。王丽平等[53]发现,叶黄素可抑制体外培养的人前列腺癌PC-3 细胞的增殖,并促进其凋亡,其机制可能与叶黄素增加PC-3 细胞caspase-3 的表达、阻滞细胞周期、抑制细胞迁移、侵袭以及调节凋亡相关基因和蛋白表达有关。
除了上述几大作用外,叶黄素还有其他生物功能。叶黄素可通过降低血清谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)及超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(MDA)水平,改善肝脏损伤小鼠的病理组织结构,对酒精所致的小鼠急性肝损伤具有保护作用[54]。同时,叶黄素在解决冠状动脉疾病(coronary artery disease,CAD)患者慢性炎症方面具有潜在的作用[55],通过口服叶黄素还可防止烧伤诱发的多器官损伤,充分体现了叶黄素的抗炎和抗细胞凋亡作用[56]。此外,叶黄素还能促进骨骼发育,增强成骨细胞培养物中矿化骨结节的形成[57],对人体骨骼健康有利。
5 叶黄素稳定性提升技术
叶黄素体外稳定性差,不耐强酸、强光和高温。叶黄素提取液在强太阳光下放置两周损失率达37.24%[58],在pH 值为2 酸性溶液中放置4 d 即损失52.01%[59],室温放置一个半月就降解50%[60]。因此,增加叶黄素的稳定性,减少损失,提高利用率是叶黄素产品化开发的关键。
微胶囊技术将叶黄素用天然或合成的高分子化合物薄膜包覆起来,对叶黄素性质不产生影响,而后通过外部刺激或缓释作用使叶黄素的功能再次展现出来。喷雾干燥是叶黄素微胶囊化较为简单的方法,对含有叶黄素的提取液进行干燥处理,并用麦芽糊精和阿拉伯胶作为包封物来提高喷雾干粉的稳定性,包封率可达 78.32%,叶黄素含量为(1.28±0.05)mg/g,并伴随有最高抗氧化活性和较好的稳定性,同时这种包封物还被用于设计一种富含叶黄素的即用型饮料,来满足人体对叶黄素的需求[61]。此外,用聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)基质包封叶黄素形成大小均匀的纳米粒子,有效提高叶黄素的水溶性(43 倍以上)和利用率,较低剂量就能提高小鼠记忆力而不引起任何炎症性损伤[62]。
除微胶囊化外,脂质体、纳米乳液等制备技术也用于提高叶黄素的稳定性。用超临界CO2制备载有叶黄素的脂质体,包封率达56.7%~97.0%[63];用乳化和溶剂蒸发法制备的纳米乳液,叶黄素包封率达80.7%,体外细胞实验表明纳米乳剂中叶黄素细胞摄入量比常规乳剂更高[64]。此外,Chang 等[65]首次合成了一种具有不同取代度(degrees of substitution,DS)的辛烯基琥珀酸酐改性短葡聚糖链(octenyl succinic anhydride modified short glucan chains,OSA-SGC)两亲聚合物,低取代度形成囊泡,高取代度形成胶束,用来帮助传递叶黄素,在保健食品、化妆品和医药领域有着潜在的应用前景。
6 展望
利用微藻生产叶黄素具有广阔的发展前景。目前人们在叶黄素高产藻种筛选、生物合成代谢调控、高效节能提取工艺、功效活性发现及稳定性提升等方面都取得了较大进展,但与真正实现工业化生产还有一定距离。今后,仍要坚持“提高产率,降低成本”的原则,重点研究优选或改良获取更有竞争力的生产藻株,基于代谢网络通量分析微藻叶黄素合成途径并优化发酵工艺,建立叶黄素低能耗提取与藻体综合利用成套技术,开发高稳定性和高利用率的叶黄素新剂型等方向。
