一株α-淀粉酶产生菌的分离、鉴定及产酶条件研究
2020-03-31曹丹彭浩兰阿峰解修超邓百万赵航轲
曹丹,彭浩,2,*,兰阿峰,2,解修超,2,邓百万,2,赵航轲,2
(1.陕西理工大学生物科学与工程学院,陕西汉中723000;2.陕西省食药用菌工程技术研究中心,陕西汉中723000)
淀粉酶能够水解淀粉生成葡萄糖、麦芽糖以及其它低聚糖,按结构的不同可以分为α-淀粉酶、β-淀粉酶、糖化酶以及异淀粉酶4 种[1]。其中,α-淀粉酶(液化酶)能够分解直链淀粉和支链淀粉分子内部的α-1,4糖苷键而产生葡萄糖和少量麦芽糖及麦芽三糖[2]。α-淀粉酶存在于自然界各种动植物以及微生物中,被广泛应用于食品工业、医药工业、纺织业、畜牧业以及环保领域[3]。
α-淀粉酶是我国工业生产中产量最高的酶制剂产品,产量约占我国整个酶制剂产品产能的一半以上[4]。近年来,虽然我国投产的淀粉酶品种和产能在不断增加,但在菌种及生产工艺上与国外相比尚有一定差距[5]。由于进行产酶基因工程菌株构建存在成本高,难度大等问题。因而,目前产酶菌株仍然以分离野生菌株后驯化为主,需要不断从自然界中分筛选性能优异的菌株,为淀粉酶的工业生产带来新的活力[6-7]。
随着制酶工业的发展,对高产淀粉酶产生菌的选育已经成为研究热点。土壤蕴含着大量的微生物资源,尤其富含产生各种酶类的细菌[8-9]。本文从富含淀粉酶产生菌的不同土壤环境中分离筛选高产淀粉酶菌株,并对其产酶条件进行初步研究,以期为相关工业生产奠定理论及应用基础。
1 材料与方法
1.1 样品采集
试验所用样品采集时间为2018 年3 月,采集地点为陕西省汉中市勉县天元面粉厂厂区、陕西理工大学食堂厨余垃圾倾倒处和陕西省汉中市康田农业园区菜园土壤样品,采集深度为5 cm~15 cm 共计9 份土壤样品于4 ℃保存。
1.2 培养基
1)初筛培养基:蛋白胨 10.0 g,牛肉膏 3.0 g,NaCl 5.0 g,可溶性淀粉2.0 g,琼脂粉20.0 g,加蒸馏水至1 000 mL,pH 值自然,121 ℃,灭菌 20 min[10];
2)种子培养基:蛋白胨 10.0 g,牛肉膏 3.0 g,NaCl 5.0 g,加蒸馏水至 1 000 mL,pH 值自然,121 ℃,灭菌20 min[11];
3)发酵培养基:无水氯化钙 8.0 g,可溶性淀粉10.0 g,磷酸氢二钠8.0 g,硫酸铵 8.0 g,加蒸馏水至1 000 mL,pH 值:7.0~7.2,121 ℃,灭菌 20 min[12];
1.3 菌株的分离和筛选
1)平板初筛:在无菌条件下,将采集的土壤样品称取25 g 加入到225 mL 装有若干玻璃珠的无菌水中制备菌悬液,80 ℃水浴锅中保持20 min,去除不耐热的非芽孢杆菌,水浴后静置5 min[13]。依次做10 倍梯度稀释液至 10-6,分别移取 10-4、10-5和 10-6的稀释液各200 μL,涂布于初筛培养基上,(36±1)℃培养 24 h~48 h 后,观察菌落生长情况,并滴加0.05%碘液测定菌落周围透明圈直径(H)以及菌落直径(C),计算其比值[14]。
2)摇瓶复筛:将初筛获得的菌株接种于100 mL 种子培养基中,(36±1)℃,130 r/min 振荡培养 48 h 后,以5%接种量将上述种子液接种于100 mL 液体发酵培养基中,相同的条件培养48 h,发酵液以5 000 r/min离心10 min 取上清,测定其酶活力[15]。
1.4 酶活力测定
1.4.1 麦芽糖标准曲线的绘制
以麦芽糖为参照物质,按3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法绘制标准曲线[16]。
1.4.2 淀粉酶酶活力测定
取1 mL 稀释后的酶液于试管中,加入1 mL 磷酸氢二钠-柠檬酸缓冲液配制含1%可溶性淀粉的底物溶液,40 ℃ 保温 10 min,加入 2 mL DNS 试剂,煮沸显色10 min,于540 nm 波长处测定吸光度值,根据标准曲线计算酶活力单位[17]。[酶活力单位定义:在40 ℃,pH 6.0 条件下,每分钟从1 mL 1 %的可溶性淀粉溶液中释放出1 mmol 麦芽糖的酶量定义为一个酶活力单位(U/mL)[18]]。
1.5 菌株鉴定
1.5.1 传统形态学和生理生化鉴定
通过平板培养观察其菌落形态,并进行革兰氏染色和芽孢染色观察其特征[19];参照文献[20]进行相关生理生化试验。
1.5.2 16S rDNA 序列分析
将提取的菌株总DNA 经琼脂糖凝胶电泳检测后,使用16S rDNA 通用引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[21]。引物由上海生工生物工程有限公司提供,其正向引物(27F):5'-AGTTTGATCCTGGTCAG-3';反向引物(1492R):5'-GGTTACCTTGTTACGACTT - 3';扩增程序为:94 ℃,5 min;94 ℃,30 s;55 ℃~65 ℃,30 s;72 ℃,2 min;共计30 个循环;72 ℃ 延伸 10min,扩增引物 4 ℃保存[22-24]。将产物送交上海生工生物工程有限公司测序,将测得序列提交NCBI 数据库进行Blast 同源比对,使用MEGA5.0 软件分析,Neighbor-Joining 法构建菌株系统进化树,确定菌株的分类地位[25]。
1.6 菌株的产酶条件优化
1.6.1 最佳产酶条件单因素试验设计
选择6 种碳源(可溶性淀粉、糊精、玉米淀粉、麸皮、蔗糖和葡萄糖),6 种氮源(蛋白胨、硝酸铵、牛肉粉、酵母膏、牛肉粉+蛋白胨和酵母膏+蛋白胨),6 种无机盐(硫酸锰、硝酸钾、硫酸镁、硝酸钠、无水氯化钙和硫酸亚铁),分别等量代替发酵培养基中的碳源、氮源和无机盐,配制不同发酵培养基发酵培养后测定发酵液酶活力,根据酶活力大小筛选出最佳碳源、氮源和无机盐。
1.6.2 正交试验设计
根据单因素试验筛选出的培养基成分,设计正交试验,见表1,确定最佳培养基配方。

表1 产淀粉酶菌株培养基组分优化的正交试验方案Table 1 Orthogonal test protocol for optimization of medium components for amylase producing strains
1.6.3 培养条件单因素试验设计
以优化后的培养基为基础进行单因素试验,分别分析不同初始 pH 值(5.5、6.0、6.5、7.0 和 7.5)、培养时间(24、48、72、96 h 和 120 h)、转速(100 、110、120、130 r/min 和 140 r/min)和培养温度(28、31、34、37 ℃和40 ℃)对菌株产酶能力的影响。
2 结果与分析
2.1 菌株的分离和初筛
将1.3 中的土壤稀释液涂布于初筛平板培养后,根据菌落形态和显微形态的差异,共获得产淀粉酶菌株173 株。分别测定菌株直径1 mm 时透明圈直径(H)与菌落的直径(C)比值,即H/C 值,筛选出1 株淀粉酶产生能力较强的菌株,编号MF04,具体见图1。其H/C值为4.37,酶活力值为32.5 U/mL。
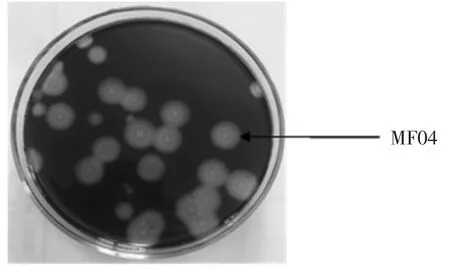
图1 菌株MF04Fig.1 Strain MF04
2.2 形态学观察及生理生化试验结果
革兰氏染色和芽孢染色形态如图2、图3 所示。
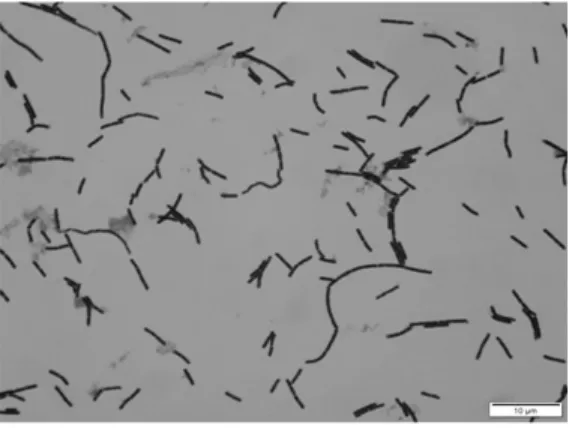
图2 革兰氏染色形态Fig.2 Gram staining morphology

图3 芽孢染色形态Fig.3 Spore staining morphology
通过平板培养后观察菌株MF04 菌落呈现乳白色,不透明,菌落大,表面粗糙,有褶皱,不规则,挑起呈丝状。菌体大小约(1.0~1.2)×(3.0~5.0)μm,长杆状。经革兰氏染色和芽孢染色,鉴定其为革兰氏阳性细菌,芽孢可见,长约1.5 μm,呈椭圆形。对菌株MF04 进行生理生化试验,菌株MF04 与枯草芽孢杆菌,蜡状芽孢杆菌的生理生化特征类似,结果如表2 所示。

表2 生理生化试验鉴定结果Table 2 Physiological and biochemical test identification results
2.3 分子生物学鉴定结果
菌株MF04 经16S rDNA 通用引物PCR 扩增后,用琼脂糖凝胶电泳检测结果见图4。

图4 菌株MF04 16S rDNA 电泳检测结果Fig.4 Results of strain MF04 16S rDNA electrophoresis
结果表明,菌株MF04 与蜡状芽孢杆菌,枯草芽孢杆菌,苏云金芽孢杆菌等的16S rDNA 都具有高度相似性,同源性均为99 %,构建系统发育树,如图5 所示,分析其与Bacillus cereus strain 亲缘关系最近。
2.4 产酶条件研究
2.4.1 单因素试验结果
碳源、氮源、无机盐离子对菌株MF04 产酶活力的影响见图6、图7 和图8。
培养基中不同碳源、氮源和无机盐对菌株产酶能力的影响较大,当碳源为2%糊精,氮源为0.5%蛋白胨,无机盐为0.4%硫酸锰时,菌株MF04 的产酶能力最强,酶活力最高,为48.2 U/mL。

图5 菌株MF04 16S rDNA 序列系统发育树Fig.5 Strain MF04 16S rDNA sequence phylogenetic tree

图6 不同碳源对菌株MF04 产酶活力的影响Fig.6 Effect of different carbon sources on enzyme activity of strain MF04

图7 不同氮源对菌株MF04 产酶活力的影响Fig.7 Effect of different nitrogen sources on enzyme activity of strain MF04

图8 无机盐离子对菌株MF04 产酶活力的影响Fig.8 Effect of inorganic salt ions on enzyme activity of strain MF04
2.4.2 正交试验结果
根据单因素试验结果进行四因素三水平正交试验,结果见表3。

表3 产淀粉酶菌株培养基组分优化的正交试验结果Table 3 Orthogonal test results of optimization of medium components for amylase producing strains
结果显示:碳源糊精(A)对菌株产酶能力的影响最大,其次为无机盐硫酸锰(C)、磷酸氢二钠浓度(D)以及氮源(B),即 A>C>D>B;对应的最佳组合为 A2B1C3D2,即配方为 20.0 g/L 糊精,4.0 g/L 蛋白胨,10.0 g/L 硫酸锰和4.0 g/L 磷酸氢二钠时,其产酶能力显著高于其他组合,酶活力最高为56.2 U/mL。
2.4.3 发酵条件的优化
初始pH 值、培养时间、培养温度、转速对菌株MF04产酶能力的影响结果见图9、图10、图11 和图12。
单因素结果显示在发酵液初始pH 6.0,发酵时间为72 h,发酵温度为37 ℃,转速为130 r/min 时产酶能力最佳,酶活力最高,达到60.2 U/mL。

图9 初始pH 值对菌株MF04 产酶能力的影响Fig.9 Effect of initial pH on enzyme production capacity of strain MF04

图10 培养时间对菌株MF04 产酶能力的影响Fig.10 Effect of culture time on enzyme production ability of strain MF04

图11 培养温度对菌株MF04 产酶能力的影响Fig.11 Effect of culture temperature on enzyme production ability of strain MF04

图12 转速对菌株MF04 产酶能力的影响Fig.12 Effect of rotation speed on enzyme production ability of strain MF04
2.4.4 验证试验
将菌株MF04 接种于优化后的发酵培养基中,37 ℃,130 r/min,发酵培养72 h,测定发酵液酶活力为58.5 U/mL,与理论值接近。
3 结论
对从面粉厂、菜园以及食堂附近采集的土壤样品中产淀粉酶的菌株通过平板初筛和摇瓶复筛,分离纯化获得173 株产淀粉酶菌株。根据H/C 比值和淀粉酶活力测定初步筛选出产淀粉酶能力较强的菌株1株,命名为MF04。通过形态学、生理生化试验以及16S rDNA 鉴定,将其归为芽孢杆菌属蜡状芽孢杆菌(Bacillus cereus)。目前,淀粉酶工业生产中选用的菌株主要以枯草芽孢杆菌和蜡状芽孢杆菌为主,还包括解淀粉芽孢杆菌和地衣芽孢杆菌等[26]。利用L3(94)正交试验对该菌株的最适产酶培养基及培养条件进行初步优化,确定最佳培养基为:2%糊精,0.6%磷酸氢二钠,0.5%蛋白胨和0.5%硫酸锰;最适培养条件为:初始pH 6.0,发酵温度为37 ℃,转速130 r/min,发酵时间72 h。在上述培养基及培养条件下,使菌株MF04 的产淀粉酶能力较优化前提高了85.2%。
以土壤为材料进行产淀粉酶菌株的分离筛选一直被研究人员关注。张丽靖等[27]从富含淀粉的土壤中筛选得到一株酸性α-淀粉酶产生菌B6,原始菌株产α-淀粉酶的酶活力达到30.2 U/mL,经优化后其产α-淀粉酶酶活力为33.4 U/mL,提高了10.6%;赵淑琴等[28]对土壤中产淀粉酶菌株的研究中筛选得到1 株高产淀粉酶菌株LZ-10,经优化后酶活力达到41.6 U/mL;马晓梅等[29]对土壤中产淀粉酶菌株的研究中筛选得到高产淀粉酶菌株MSP13,经优化后α-淀粉酶酶活力为45.02 U/mL。而在本研究中对产淀粉酶菌株MF04 进行产酶培养基及培养条件的优化试验后,可使该菌株的产酶活力达到60.2 U/mL,较优化前提高了85.2%,产酶活力均高于同类研究。
本研究对不同土壤中的产淀粉酶菌株进行分离筛选,对其中1 株产α-淀粉酶的菌株进行产酶条件的优化研究,使其产酶能力有了大幅提高,这可为淀粉酶的工业生产提供一定支撑。
