水稻花器官发育基因DPS2的鉴定和精细定位
2020-03-31王昌健陈龙代丽萍路雪丽贺金立杨龙胡江朱丽董国军张光恒高振宇任德勇陈光沈兰张强郭龙彪钱前曾大力
王昌健 陈龙 代丽萍 路雪丽 贺金立 杨龙 胡江 朱丽 董国军 张光恒 高振宇 任德勇 陈光 沈兰 张强 郭龙彪 钱前 曾大力
水稻花器官发育基因的鉴定和精细定位
王昌健#陈龙#代丽萍 路雪丽 贺金立 杨龙 胡江 朱丽 董国军 张光恒 高振宇 任德勇 陈光 沈兰 张强 郭龙彪 钱前*曾大力*
(中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;#共同第一作者;*通信联系人, E-mail: qianqian188@hotmail.com; dalizeng@126.com)
【】鉴定和克隆花器官发育相关基因,为进一步研究水稻花发育的分子机制奠定基础。在大田常规种植条件下比较了突变体()和野生型春江06的主要农艺性状及花器官形态特征差异;扫描电镜及石蜡切片观察花药结构并用染色法观察花粉和胚囊的育性;利用图位克隆方法进行基因精细定位;qRT-PCR分析了花发育相关基因在野生型和突变体中的表达水平。突变体抽穗期变长,不能正常扬花,雄蕊和雌蕊皱缩且花药和柱头数目增多;进一步研究发现,突变体花药腔室塌陷,内无可见小孢子,即使部分花药形成腔室,花粉粒也无淀粉积累呈干瘪状。此外,突变体胚囊育性也受到影响;遗传分析表明该突变性状受一对隐性核基因控制,该基因位于第4染色体短臂上91.2 kb的区间内,区间内未见花器官发育相关基因的报道。qRT-PCR检测发现,水稻ABCDE模型中的B类、C类和E类基因的表达在突变体中显著升高。突变体的雄蕊及雌蕊均发育异常,最终导致完全不育,推测可能在水稻第3轮雄蕊发育和第4轮雌蕊发育调控中发挥重要作用。
水稻;;花器官发育;基因定位
水稻是重要的粮食作物之一,也是单子叶模式植物,其花器官的形成发育直接影响水稻产量。因此,对水稻花器官发育相关基因的克隆和功能分析不仅有助于进一步认识水稻花发育的调控机理,也具有重要的实践意义。20世纪90年代初期,学者们通过对金鱼草()和双子叶模式植物拟南芥()大量花器官突变体的研究,提出了经典的花器官发育ABC模型[1, 2]。在ABC模型中,A、B、C三类基因单独或协同调控萼片、花瓣、雄蕊和雌蕊四轮花器官发育。其中,A类基因()和()单独调控萼片发育;A类和B类基因()和()协同调控花瓣的发育;B类和C类基因()协同调控雄蕊发育;C类基因单独调控心皮发育[3]。随着研究的深入,ABC模型进一步完善并发展成ABCDE模型,其中,D类基因()与C类基因互为冗余地调控胚珠发育;而E类()基因参与调控所有花器官的发育[3, 4]。
研究表明双子叶植物的ABCDE模型也部分适用于单子叶植物。对于模式植物水稻而言,其小穗由2枚护颖、2朵退化的不育花和1朵可育花构成;可育花由外到内依次由1枚外稃、1枚内稃、2枚浆片、6枚雄蕊和1枚雌蕊共四轮花器官构成。与双子叶植物相比,水稻B类、C类基因和D类基因在功能上具有一定保守性,但也有部分基因发生了复制和功能分化。在水稻B类基因中,的RNA干涉株系中,其浆片变大,但不影响雄蕊发育[5-6];主要在花粉、绒毡层及柱头中表达,其RNA干涉株系表现为浆片变成內稃和外稃状结构,雄蕊变成心皮状结构,说明主要调控水稻浆片和雄蕊的发育[7];()主要在浆片和雄蕊中表达,在雌蕊中也能检测到表达,该基因突变导致浆片向内稃状结构转变,雄蕊向心皮结构转变[8],研究表明与、协同调控花器官的形态[9],可能通过介导的调控途径来参与水稻第2轮浆片和第3轮雄蕊发育[10]。目前在水稻中发现2个C类基因,分别是和,二者都是拟南芥同源基因;其中,只在雄蕊、雌蕊和胚珠原基中表达,该基因突变导致雄蕊向浆片转变,形成异位浆片,但心皮发育正常[11-12]。在的RNA干涉株系中,其花器官由重复的浆片、雄蕊和心皮状组织构成,说明主要参与调控花分生组织的决定和心皮的发育[12]。水稻中存在2个D类同源基因,即和。主要在胚珠中表达,特异调控胚珠的发育,该基因突变导致雌性不育[13-14];主要在发育的种子中表达,在胚珠中不表达,突变后其胚珠发育正常,说明可能不参与胚珠的发育调控[14]。此外,水稻中可能的E类基因有、、、、和。突变导致小穗内、外稃呈叶状,浆片伸长,雄蕊数目减少,心皮数目增加[15]。突变后小穗内稃结构和心皮发育异常,花分生组织特征缺失。和双突变体植株的突变表型更加严重,二者协同调控水稻花器官形态[16]。另外,和都可以与互作,这两个基因在花分生组织、雄蕊和雌蕊中都有表达,在功能上具有冗余性,突变后雄蕊数目增加,心皮发育异常[17]。
除了用ABCDE模型来解释花器官发育的机制外,有研究表明其它基因也能影响花器官的发育,如花器官发育过程中参与调控花器官数目的基因(),包括[18]、[19]、[20]、[21]和[22],在水稻中这些基因的突变导致雄蕊或雌蕊数目不同程度的增加。而且,这5类基因的上游或下游调控因子也在花器官发育过程中发挥着重要的作用[23]。研究并克隆这类基因将有助于阐明水稻花器官发育的分子机理,为提高水稻产量、品质和挖掘水稻潜在的种质资源奠定基础。
本实验室从春江06和TN1构建的代换系中获得了一个能稳定遗传的、花器官发育异常并完全不育的突变体。该突变体表现为小穗雄蕊和雌蕊结构发育异常,且部分小穗的花药和柱头数目增加。为明确导致突变体表型特征和花器官发育异常的分子机制,我们对突变体进行了形态学观察和组织学分析;通过图位克隆的策略精细定位了水稻基因;结合实时荧光定量PCR分析了花器官发育相关基因在野生型和突变体中的表达差异。
1 材料与方法
1.1 试验材料
在春江06和TN1的代换系中发现一个能稳定遗传的不育株系,将该突变体命名为。由于突变体完全不育,以杂合体形式保存种质资源。供试材料种植于中国水稻研究所杭州富阳和海南陵水实验基地。
1.2 植株和颖花形态观察、花粉育性鉴定
抽穗期开始在田间观察鉴定并标记不育植株,取突变体及其野生型的成熟小穗,在解剖镜下观察花器官形态和数目并做统计。在当日开花前,取突变体和野生型的颖花,每株3个重复,体视镜下剥离花药,1% I2-KI染色镜检,拍照并统计花粉败育数目。
1.3 爱氏苏木精染色法观察胚囊育性
在水稻胚囊成熟期取植株小穗,FAA固定液固定24 h后,用50%乙醇冲洗2次,体式镜下分离出子房,并以梯度酒精(50%、30%)和蒸馏水复水,然后用2%的硫酸铝钾染色20 min,爱氏苏木精染液染色30 min,水洗3次,梯度酒精(30%、50%、70%、80%、90%、无水乙醇)脱水。用无水乙醇和水杨酸甲酯等体积混合液浸泡4 h,水杨酸甲酯透明20 h,最后将子房置于载玻片上,并用LEICA荧光显微镜观察、拍照。
1.4 花药和花粉粒的扫描电镜观察
用尖头镊子剥出野生型和突变体花药,立刻置于2.5%戊二醛固定液中,使用真空抽气泵抽真空使材料沉到固定液底部,室温下固定2 h,4℃下固定24 h。0.2 mol/L磷酸缓冲液(pH=7.0)漂洗3次,依次经过30%、50%、70%、80%、90%的梯度酒精脱水各10 min,无水乙醇脱水两次,每次20 min。于乙酸异戊酯中置换25分钟后CO2临界点干燥,真空镀膜后在扫描电镜上选用不同倍数观察、拍照。
1.5 花药的石蜡切片观察
取野生型和突变体幼穗和成熟小穗,立即置于FAA固定液中4℃下固定24 h,5%氢氟酸软化7 d,经乙醇梯度脱水、二甲苯透明、浸蜡、包埋、脱蜡、切片(厚度为10 μm),1%番红和1%固绿染色,梯度乙醇复水,中性树脂封片后,在LEICA荧光显微镜下观察和拍照。
1.6 遗传分析和定位群体构建
用杂合体分别与日本晴和9311配制杂交组合,杂交获得F1种子并分单株全部收种,将F1种子按单株播种,每株系种约100株,构成数个小F2群体。于成熟期调查每个小群体,观察并统计是否出现育性分离,把育性分离株系的F1种子全部播种得到大的F2群体,观察并分别统计F2分离群体中正常表型个数和表型个数,计算分离比。所有实验材料于2018年及2019年种植在中国水稻研究所杭州试验基地和海南陵水试验基地。用杂合体和日本晴杂交产生的能分离的F2株系作为定位群体,从F2群体中选取成熟期表现不育性状的单株(共2353个)进行基因定位。
1.7 DPS2的基因定位
利用本实验室保存的250对均匀分布于12条染色体上的InDel标记,根据混合分析法,对野生型、突变体、F1及混池(30个突变体表型单株等量混合)进行基因型鉴定及连锁分析。参考初定位区间内日本晴和CJ06的全基因组序列,用Primer premier 3.0 在线网站设计新的InDel和dCAPS标记进行精细定位(表1),PCR产物用4%琼脂糖凝胶电泳和8%聚丙烯酰胺凝胶电泳检测。
1.8 花器官发育相关基因的表达分析
用AXYGEN公司的植物RNA小量提取试剂盒,按照说明书步骤分别提取野生型和突变体0.5 ~1 cm幼穗的总RNA。反转录使用TOYOBO公司的ReverTra Ace quantitative PCR RT Master Mix试剂盒,步骤参照试剂盒说明书。qPCR体系(20 μL)为包括cDNA 2 μL,正、反向引物(10 μmol/L)各1 μL,SYBR qPCR Mix 10 μL,蒸馏水6 μL。反应在Bio-Rad PCR仪上进行,反应程序如下:95℃下4 min,95℃下30 s,60℃下1 min,40个循环,12℃下保存。水稻(LOC_Os01g22493)基因作为内参,正向引物序列为5′-CTCGCCGACTACAACAT CCA-3′,反向引物序列为5′-TCTTGGGCTTGGTGT ACGTCTT-3′。每个样品设3次重复,采用2-法分析基因相对表达量[24]。

表1 部分实验引物
2 结果与分析
2.1 dps2突变体的表型鉴定
突变体在营养生长期与野生型春江06相比在植株形态上没有明显差异(图1-A、B),但其抽穗期比野生型晚约5.5 d(图1-E),野生型开花时突变体未能正常开花(图1-C~D)。在成熟期,野生型春江06能正常灌浆结实,而突变体小穗颖壳颜色逐渐变黄但无籽粒形成(图1-F~I),自然结实率为0%,显著低于春江06(92.7%,图1-J)。
2.2 dps2突变体雄蕊发育异常
观察野生型和突变体的成熟颖花,发现野生型小穗花药数目为正常的6枚,花药饱满呈黄色,花丝正常伸长(图2-A),而突变体的6枚花药全部皱缩(图2-B)或表现出不同程度的皱缩(图2-C),花药透明呈浅黄色,约10%突变体小穗花药数目增多,多至7~12枚(图2-D)。利用扫描电镜观察野生型和成熟花药及其外壁,发现野生型花药具有4个花药室,表皮细胞均匀分布且结构规则(图2-E),而花药短小皱缩,花药腔室发育不完整,表皮细胞褶皱(图2-F),野生型花药外壁表面饱满并由线状物质构成(图2-G),而突变体外表面光滑且没有蜡质和角质等线状物质分布(图2-H)。进一步用碘染法观察野生型和突变体的花粉活性,结果显示,野生型98%的花粉粒能被染成深色,育性正常(图2-I),而突变体以典败型花粉为主,只有约5%的花粉能正常染色(图2-J)。
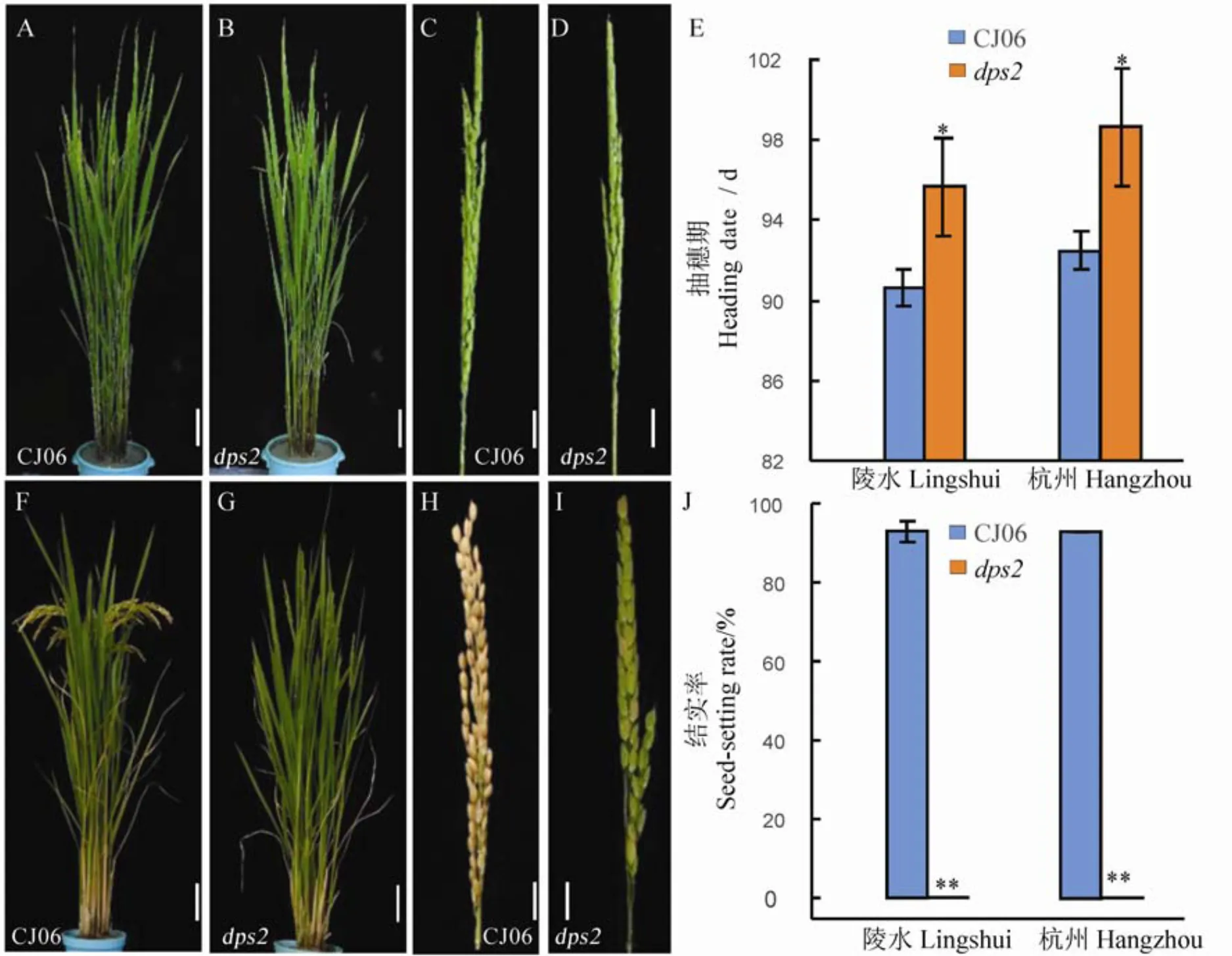
A, B−抽穗期植株; C, D−抽穗期穗部表型; E−在海南陵水和浙江杭州的抽穗期; F, G−成熟期植株; H, I−成熟期穗部表型, J−在海南陵水和浙江杭州的结实率。误差线表示3次独立实验的标准差。*和**分别表示野生型与突变体间差异达0.05和0.01显著水平(t检验)。在A, B, F, G图中,标尺为10 cm; C, D, H, I标尺为2 cm。CJ06−春江06。
Fig. 1. Phenotypic comparison ofmutant and wild type CJ06 at heading and maturity stage.

A−野生型去除内外稃的颖花; B~D−突变体dps2去除内外稃的颖花; E−野生型花药; F−dps2花药; G−野生型花药外壁; H−dps2花药外壁; I−野生型花粉镜检; J−dps2花粉镜检。lo−浆片; An−花药; F−花丝。A~D图中标尺为1 mm, E, F标尺为100 μm, G, H标尺为10 μm, I, J标尺为50 μm。
Fig. 2. Stamens phenotypic observation of wild type Chunjiang 06(CJ06) andmutant.

A到C为野生型; D到I为突变体dps2。A, D和G−花药发育第9时期花药横切面; B, E和H−第10时期花药横切面; C, F和I−第12时期花药横切面。Ep−表皮层; En−内皮层; T−绒毡层; DT−退化绒毡层; Ms−小孢子母细胞; Msp−小孢子; Mp−成熟花粉。标尺为10 μm。
Fig. 3. Transverse section of anthers ofmutant and wild type Chunjiang 06(CJ06) at different stages.
2.3 dps2突变体花药及花粉的发育过程
通过花药横切来比较野生型和突变体花药及花粉粒发育过程。张大兵等[25]将花药发育过程分为14个时期。结果表明,在花药发育第9时期,野生型药室饱满呈圆形,小孢子正常被释放到药室中,绒毡层浓缩,中间层完全消失(图3-A);而在相同时期的突变体花药中,药室发育成椭圆形,绒毡层不规则分散且包裹了小孢子(图3-D)。在第10时期,野生型小孢子液泡化成圆形,绒毡层细胞基本降解呈带状(图3-B),而突变体花药空腔进一步缩小,内部无可见小孢子(图3-E)。第12时期,野生型的花粉粒发育成熟,绒毡层完全消失(图3-C),而突变体花药室完全塌陷(图3-F)。此外,我们观察到未完全皱缩的花药在第9时期具有正常的花药腔室,内含小孢子母细胞(图3-G),在第10时期小孢子液泡化后呈圆形,到第12时期,即使花药外表皮细胞皱缩,腔室内部分花粉粒发育饱满呈圆形,多数花粉粒干瘪内无淀粉积累(图3-I)。

A−野生型春江06的雌蕊形态; B, C−突变体dps2的雌蕊形态; D−春江06胚囊镜检; E, F−突变体dps2胚囊镜检。Sti−柱头; ov−子房。在A~C图中,标尺为1 mm;在D~F图中,标尺为50 μm。
Fig. 4. Pistils phenotypic observation of wild type Chunjiang 06(CJ06) andmutant.

表2 dps2突变位点的遗传分析
2.4 dps2突变体雌蕊发育异常
突变体有育性正常的花粉粒却表现为完全不育,因此,我们观察突变体雌蕊发育是否受到影响。结果表明,野生型雌蕊有2枚柱头和1个子房,二者发育正常(图4-A),但突变体柱头和子房皱缩(图4-B),部分突变体雌蕊的柱头数目增至2~4枚(图2-C)。透明法观察胚囊育性发现,野生型发育成四核胚囊,胚囊壁正常加厚,助细胞和反足细胞消失(图2-D),而突变体内胚囊中央无极核结构并出现细胞退化的痕迹(图2-E)。此外,我们在突变体中观察到胚囊中央有两个细胞核组成的极核结构,助细胞和反足细胞均消失(图2-F)。这说明突变体具有胚囊败育的特征,但也可能存在育性正常的胚囊。
2.5 突变体遗传分析
由于突变体植株雄蕊和雌蕊都发育异常,且突变体完全不育,以代换系中分离出的杂合体和常规粳稻日本晴及籼稻9311配制杂交组合,育性调查结果表明,所有组合的F1植株均表现为可育,在F2群体中发生育性分离。经卡方检验,育性性状的分离符合3∶1的分离规律(χ2<3.84, 表2)。这表明该突变性状由单基因隐性核基因控制。
2.6 DPS2基因的初定位和精细定位
利用均匀分布于12条染色体上的250对多态性标记,对野生型、突变体、F1及混池(30个突变体表型单株等量混合)进行基因型鉴定,将基因界定在位于第4染色体上的BY4和BY19标记之间(图5-A)。进一步扩大定位群体,用DNASTAR和Primer 3.0在该连锁区间里开发InDel和dCAPS标记,最终利用F2群体中的2353个突变体表型植株将目的基因定位在BY6-2和BY7-3标记之间,物理距离为91.2 kb(图5-B)。根据水稻基因组数据库(Rice Genome Annotation Project)中的基因注释,该区间内共有12个基因,包含有表达蛋白、转座子蛋白、C2H2锌指蛋白等(表3)。
2.7 花药发育相关基因的表达分析
突变体的雄蕊和雌蕊发育异常,利用实时定量PCR比较了野生型和突变体中花器官发育相关基因的表达量。这些基因包括花器官数目相关的、、基因,生长素调控相关的、基因,以及MADS-Box家族中参与雄蕊和心皮发育的3类基因。结果表明,与花器官数目相关的基因和在野生型和突变体中均未检测到表达,基因在突变体中的表达量显著升高;与生长素调控相关的基因、在野生型和突变体中同样未检测到;与野生型相比,MADS-Box家族中的B类基因、、,C类基因、和除了、外的E类基因、、、在中均显著上调表达(图6)。结果表明,以上花药发育相关基因的表达量在中上调,这很可能导致花器官发育缺陷。

A−突变基因的初步定位; B−突变基因的精细定位; C−标记BY6-2和BY7-3区间内开发阅读框。
Fig. 5. Location ofon rice chromosome 4.

表3 第4染色体候选区间内注释的12个基因
3 讨论
水稻花器官发育是一个非常复杂的过程,每一步都涉及严格的遗传调控,而水稻颖花的异常发育往往导致育性下降、千粒重减少、结实率降低等,从而致使水稻大幅减产[26]。Ikeda等[27]根据花器官原基形成起始顺序将水稻小穗发育分成8个时期,Sp6、Sp7和Sp8分别对应雄蕊原基形成期、心皮原基形成期及胚珠和花粉形成期。在Sp6时期形成6枚雄蕊原基并呈环状排列。在()突变体中,雄蕊的数目增加,药室发育异常,雌蕊无柱头或柱头毛,胚囊发育正常[28]。突变体和突变体具有部分相似的表型,颖花雄蕊数目为6枚,部分小穗雄蕊数目增至7到12枚,说明突变体在雄蕊原基形成期就开始出现异常。突变体在花药发育过程中花药室塌陷,内无可见小孢子,即使部分花药能够形成腔室,内部花粉也发育异常导致大部分花粉败育。但是约5%的花粉粒具有活性,而突变体植株在成熟期表现为完全不育。突变体雌蕊的柱头数目增至2到4枚,胚囊育性异常。此外,突变体呈晚花表型。说明突变体的不育性状可能由雄蕊和雌蕊发育异常及开花异常共同造成。

误差线表示3次生物学重复试验的标准差。*和**分别表示野生型春江06和突变体dps2间差异达0.05和0.01显著水平(t检验)。
Fig. 6. Expression profile of the genes involved in the number and development of flower organs ofmutant and wild type Chunjiang 06.
在水稻中,已被报道主要调控第2轮浆片和第3轮雄蕊发育[8],能和、相互作用,参与调控花器官的形态[9],和在雄蕊原基中有部分重叠的表达模式[29]。在突变体中,这3个基因的表达水平都显著升高,说明突变体中B类和C类基因的转录都受到影响。水稻中可能通过介导的调控途径影响浆片和雄蕊发育。另外,和、互作来调控花分生组织活性[10]。和也能与形成相互作用,影响雄蕊和雌蕊发育[17]。在突变体中,、、和表达水平都显著升高了。因此,我们推测基因在水稻B、C和E这3类基因调控途径中发挥作用。
遗传分析及基因定位表明基因是一个单隐性核基因,位于第4染色体短臂的BY6-2和BY7-3两个标记之间,物理距离约91.2 kb,该区间内共有12个注释基因,包括编码C2H2型的锌指蛋白、表达蛋白、含有ELM2结构域蛋白等。许多含有MYB[30]、锌指[31]、碱性螺旋-环-螺旋[32]、MADS[33]和其他DNA结合结构域的转录调节因子被认定为具有调控花器官发育的功能。其中C2H2型锌指蛋白可以和DNA、RNA和蛋白质结合,它们不仅参与转录调控,还通过独特的位点修饰参与染色质调控和RNA代谢[34]。在拟南芥中,基因编码一个具有C2H2锌指DNA结合域和EAR抑制域的转录抑制因子[35],在花发育过程中参与控制雄蕊原基、心皮原基和胚珠[36, 37]。通过调节生长素和细胞分裂素这两个途径来抑制B类基因和的表达,从而实现其平衡花发育第3轮和第4轮之间边界的功能[31, 38]。、和在部分冗余的途径调控花分生组织活性[39]。结合突变体的表型及突变体中B、C和E这3类基因的表达量变化,推测基因功能可能与拟南芥的类似,候选基因LOC_Os04g08290编码C2H2型锌指蛋白,但通过测序分析并未发现该基因和其余11个基因有碱基突变。因此,推测基因可能受表观遗传调控,这有待于下一步转基因实验验证。
[1] Pelaz S, Ditta G S, Baumann E, Wisman E, Yanofsky M F. B and C floral organ identity functions requireMADS-box genes[J].,2000, 405(6783): 200-203.
[2] Coen E S, Meyerowitz E M. The war of the whorls genetic interactions controlling flower development[J].,1991, 353(6339): 31-37.
[3] Ditta G, Pinyopich A, Robles P, Pelaz S, Yanofsky M F. Thegene offunctions in floral organ and meristem identity[J].,2004, 14(21): 1935-1940.
[4] Causier B, Schwarz-Sommer Z, Davies B. Floral organ identity: 20 years of ABCs[J].,2010, 21(1): 73-79.
[5] Kalika P, Usha V. Double-stranded RNA interference of a rice PI/GLO paralog, OsMADS2, uncovers its second-whorl-specific function in floral organ patterning[J].2003, 165(4): 2301-2305.
[6] Shri R Y, Kalika P, Usha V. Divergent regulatoryfunctions control size, shape and differentiation of the highly derived rice floret second-whorl organ.,2007, 176(1): 283.
[7] Shan G Y, Shinnosuke O, Mayumi K, Hitoshi Y. Unequal genetic redundancy of riceorthologs,and, in lodicule and stamen development[J].,2008, 49(5): 853.
[8] Nagasawa M, Miyoshi M, Sano Y, Satoh H, Hirano H, Sakai H, Nagato Y.andgenes control floral organ identify in rice[J]., 2003, (130): 708-718
[9] Yun D P, Liang W Q, Dreni L D, Yin C S, Zhou Z G, Kater M M, Zhang D B.genetically interacts withandin specifying floral patterning in rice[J].,2013, 6(3): 743-756.
[10] Hu Y, Liang W Q, Yin C S, Yang X L, Ping B Z, Li A X, Jia R, Chen M J, Luo Z J, Cai Q, Zhao X X, Zhang D B, Yuan Z. Interactions ofwith floral homeotic genes in rice flower development[J].,2015, 8(9): 1366-1384.
[11] Hu L F, Liang W Q, Yin C S, Cui X, Zong J, Wang X, Hu J P, Zhang D B. Rice MADS3 regulates ROS homeostasis during late anther development[J].,2011, 23(2): 515-533.
[12] Yamaguchi T, Nagasawa N, Kawasaki S, Matsuoka M, Nagato Y, Hirano H Y. Thegeneregulates carpel specification and midrib development in[J].,2004, 16(2): 500-509.
[13] Lopez-Dee ZP, Wittich P, Enrico P M, Rigola D, Del B I, Gorla M S, Kater M M, Colombo L., a novel rice MADS-box gene expressed during ovule development[J].,2015, 25(3): 237-244.
[14] Dreni L, Jacchia S, Fornara F, Fornari M, Ouwerkerk P B, An G, Colombo L, Kater M M. The D-lineage MADS-box genecontrols ovule identity in rice[J].,2007, 52(4): 690-699.
[15] Prasad K, Sriram P, Kumar C S, Kushalappa K, Vijayraghavan U. Ectopic expression of ricereveals a role in specifying the lemma and palea, grass floral organs analogous to sepals[J].,2001, 211(6): 281-290.
[16] Li H F, Liang W Q, Rui D J, Yin C S, Zong J, Kong H Z, Zhang D B. The AGL6-like generegulates floral organ and meristem identities in rice[J].,2010, 20(3): 299.
[17] Cui R F, Han J K, Zhao S Z, Su K M, Feng W, Du X Q, Xu Q J, Kang C, Theissen G, Zheng M. Functional conservation and diversification of class E floral homeotic genes in rice () [J].,2010, 61(5): 767-781.
[18] Suzaki T, Sato M, Ashikari M, Miyoshi M, Nagato Y, Hirano H Y. The generegulates floral meristern size in rice and encodes a leucine-rich repeat receptor kinase orthologous toCLAVATA1[J].,2004, 131(22): 5649-5657.
[19] Suzaki T, Toriba T, Fujimoto M, Tsutsumi N, Kitano H, Hirano H Y. Conservation and diversification of meristem maintenance mechanism in: Function of thegene[J].,2006, 47(12): 1591-1602.
[20] Li J, Zhang W L, Xia Z H, Jiang G H, Qian Q, Li A L, Cheng Z K, Zhu L H, Long M, Zhai W X. A paracentric inversion suppresses genetic recombination at thelocus with breakpoints corresponding to sequence gaps on rice chromosome 11L[J].2007, 277(3): 263-272.
[21] 张向前, 邹金松, 朱海涛, 李晓燕, 曾瑞珍. 水稻早熟多子房突变体的遗传分析和基因定位[J]. 遗传, 2008, 30(10): 1349-1355.
Zhang X Q, Zou J S, Zhu H T, Li X Y, Zeng R Z. Genetic analysis and gene mapping of an early flowering and multi-ovary mutant in rice (L) [J].,2008, 30(10): 1349-1355.
[22] 赵福永,王洁雅, 黄显波, 邓则勤, 林成豹, 严寒, 田志宏. 水稻花器官数目突变体的研究初报[J]. 杂交水稻, 2011, 26(2): 52-57.
Zhao F Y, Wang J Y, Huang X B, Deng Z Q, Lin C B, Han Y, Tian Z H. A preliminary study on the floral organ number mutantin rice[J].,2011, 26(2): 52-57.
[23] Thomson B, Zheng B, Wellmer F. Floral organogenesis: When knowing your ABCs is not enough[J].,2017, 173(1): 56-64.
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].,2001, 25(4): 402-408.
[25] Zhang D B, Wilson Z A. Stamen specification and anther development in rice[J].,2009, 54(14): 2342-2353.
[26] Xing Y Z, Zhang Q F. Genetic and molecular bases of rice yield[J].,2010, 61(1): 421-442.
[27] Ikeda K, Sunohara H, Nagato Y. Development course of inflorescence and spikelet in rice[J].,2004, 54: 147-156.
[28] 吴华茂. 水稻穗粒数相关QTL分析及水稻花器官发育突变体的鉴定[D]. 中国科学院大学,2018.
Wu H M. Studies on rice QTL of grain number per panicle and mutantdefective in floral organ development[D]. University of Chinese Academy of Science, 2018.
[29] Yamaguchi T, Lee D Y, Miyao A, Hirochika H, An G, Hirano H Y. Functional diversification of the two C-class MADS box genesandin[J].,2006, 18(1): 15-28.
[30] Moreau F, Thévenon E, Blanvillain R, Lopezvidriero I, Francozorrilla J M, Dumas R, Parcy F, Morel P, Trehin C, Carles C C. The Myb-domain protein ULTRAPETALA1 INTERACTING FACTOR 1 controls floral meristem activities in[J].,2016, 143(7): 1108-1119.
[31] Prunet N, Yang W B, Das P, Meyerowitz E M, Jack T P.prevents class B gene expression and promotes stem cell termination in the fourth whorl offlowers[J].,2017, 114(27): 7166.
[32] Sharma N, Xin R J, Kim D H, Sung S, Lange T, Huq E. NO FLOWERING IN SHORT DAY (NFL) is a bHLH transcription factor that promotes flowering specifically under short-day conditions in[J].,2016, 143(4): 682.
[33] Hugouvieux V, Silva C S, Jourdain A, Stigliani A, Charras Q, Conn V, Conn S J, Carles C C, Parcy F, Zubieta C. Tetramerization of MADS family transcription factorsandis required for floral meristem determinacy in[J].,2018.
[34] Sommer R J, Retzlaff M, Goerlich K, Sander K, Tautz D. Evolutionary conservation pattern of zinc-finger domains of Drosophila segmentation genes[J].,1992, 89(22): 10782-10786.
[35] Hiratsu K, Ohta M, Matsui K, Ohme-Takagi M. The SUPERMAN protein is an active repressor whose carboxy-terminal repression domain is required for the development of normal flowers[J].,2002, 514(2): 351-354.
[36] Sakai H, Medrano LJ, Meyerowitz E M. Role ofin maintainingfloral whorl boundaries[J].,1995, 378(6553): 199-203.
[37] Gaiser J C, Robinson-Beers K, Gasser C S. Thegene mediates asymmetric growth of the outer integument of ovules[J].,1995, 7(3): 333-345.
[38] Nibau C, Stilio V S D, Wu H M, Cheung A Y. Arabidopsis and Tobaccoregulate hormone signalling and mediate cell proliferation and differentiation[J]., 2011, 62(3): 949-961.
[39] Uemura A, Yamaguchi N, Xu Y, Wee W Y, Ichihashi Y, Suzuki T, Shibata A, Shirasu K, Ito T. Regulation of floral meristem activity through the interaction of,, andin[J].,2017, 31(1): 89-105.
Identification and Fine Mapping ofin Rice
WANG Changjian#, CHEN Long#, DAI Liping, LU Xueli, HE Jinli, YANG Long, HU Jiang, ZHU Li, DONG Guojun, ZHANG Guangheng, GAO Zhenyu, REN Deyong, CHEN Guang, SHEN Lan, ZHANG Qiang, GUO Longbiao, QIAN Qian*, ZENG Dali*
(State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006, China;#These authors contributed equally to this work;*Corresponding auther,E-mail: qianqian188@ hotmail.com; dalizeng@126.com)
【】 Identification and cloning of organ development-related genes can lay a foundation for further study on the molecular mechanism of rice flower development.【】The main agronomic traits and morphological characteristics of floral organs of wild type Chunjing 06 and() mutant were compared under conventional planting conditions in field. The structure of anther was observed under a scanning electronic microscope by paraffin sectioning, and the fertility of pollen and embryo sac was observed by staining. Map-based cloning was used for the gene localization. Quantitative RT-PCR was performed to analyze the relative expression of genes associated with flower development in the wild type and the mutant. 【】Longer heading date, abnormal flowering, shriveled pistils and stamens, increased anthers and stigmas were presented in themutant. Further study revealed that the anther chamber of themutantcollapsed, and no microspores were found. Though some anthers had their chambers, there was no starch accumulation in the shriveled pollen grains, and the embryo sac fertility ofwas also affected. Genetic analysis indicated that the mutant’s phenotype ofwas controlled by a single recessive nuclear gene. Thegene was mapped to a 91.2 kb region on the short arm of chromosome 4. The expression levels of some genes associated with class B, C and E genes in ABCDE model were up-regulated in the mutant. 【】 The abnormal development of stamens and pistils attributed to the complete infertility of themutant, which indicated thatplay an important role in third round of stamen development and the fourth round of pistil development.
rice;; floral organ development; gene mapping
Q755; S511.01
A
1001-7216(2020)02-0115-10
10.16819/j.1001-7216.2020.9122
2019-11-15;
2019-12-27。
国家自然科学基金资助项目(31971872, 31661143006);中国农业科学院科技创新工程项目。
