不同年代鸡源沙门菌的流行性及耐药性研究
2020-03-30张纯萍李伟杰徐锦涛
张 璐 , 张纯萍 , 李伟杰 , 赵 琪 , 徐锦涛
(1. 中国兽医药品监察所 , 北京 海淀 100081 ; 2. 青岛初心动物医院管理有限公司 , 山东 青岛 266109)
沙门菌(Salmonella)属肠杆菌科中的人兽共患病原菌,其宿主广泛,既可以水平传播又可以垂直传播,对畜禽产业和人类食品的安全危害严重[1]。被沙门菌污染的鸡肉制品是人感染沙门菌最主要的来源之一。沙门菌血清型种类众多,不同血清型对家禽和人类所引起的临床症状及造成的危害程度也不同[2]。鸡感染沙门菌后可引起鸡白痢、禽伤寒和输卵管感染等疾病,人感染后会导致伤寒样发热、恶心、呕吐、腹部绞痛和腹泻等感染性疾病。
目前我国已经发现300多种血清型[3]。研究表明,我国的鸡源沙门菌血清型以鸡白痢、肠炎、鼠伤寒为主[4],但不同年代的优势血清型差异较大[5]。研究血清型的变化对了解沙门菌流行情况和监测公共卫生数据具有重要意义。随着抗菌药物在家禽中的预防性和治疗性的应用,鸡源沙门菌的耐药性也越来越严重[6]。鉴于此,文章对1970—2015年鸡源沙门菌进行了血清分型和药敏试验,旨在比较不同年代沙门菌的流行趋势和对抗菌药物的耐药性变化,为家禽沙门菌的防控和公共卫生安全提供基础数据。
1 材料与方法
1.1 菌株来源 共收集到菌株412株,其中1970—1980年菌株(38株)、1981—2000年菌株(12株)为兽医微生物菌种保藏管理中心保存,2001—2010年菌株(169株)为中国兽医药品监察所动物源细菌耐药监测实验室保存,2011—2015年菌株(193株)为中国兽医药品监察所动物源细菌耐药监测实验室和兽医微生物菌种保藏管理中心保存。血清型鉴定的阳性菌株来自中国兽医药品监察所安全评价室已鉴定出的沙门菌。药敏试验的质控菌株大肠杆菌ATCC25922和ATCC35218,均购自中国兽医药品监察所。
1.2 培养基、材料 SWARM半固体琼脂,购自北京陆桥技术有限责任公司;普通营养琼脂、沙门菌显色培养基,均购自青岛海博生物有限公司;沙门菌分型(180种)血清,购自丹麦血清研究所;革兰阴性需氧菌药敏板、药敏接种培养液、5 mL生理盐水,均购自上海星佰生物技术有限公司;DNA marker DL-2 000,购自宝生物工程(大连)有限公司;2× GoTaqGreen Master Mix试剂,购自天根生化科技(北京)有限公司。
1.3 菌株鉴定 菌株通过营养琼脂进行复苏,复苏后提取单菌落接种于沙门菌显色培养基上,(36±1) ℃培养24 h,典型的沙门菌在沙门菌显色培养基上呈紫色。对初步纯化后为沙门菌的菌株通过 PCR 检测沙门菌持家基因invA。根据是否检出invA基因来鉴定沙门菌[7]。PCR反应体系为25 μL:2×Mix 12.5 μL;上下游引物(50 μmol/L)各0.25 μL;模板2 μL; 加ddH2O 10 μL补足25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s, 60 ℃退火30 s,72 ℃延伸30 s,30 个循环;最后72 ℃延伸10 min。1.2%的琼脂糖凝胶中进行电泳,必要时进行测序判定是否为沙门菌。
1.4 血清型鉴定 用无菌枪头挑取营养琼脂上的菌落与菌体(O)抗原多价血清充分混匀,30 s内观看凝集反应,若凝集则说明具有对应的O抗原,鞭毛(H)抗原的检测需要在SWARM半固体琼脂上培养,并以已知沙门菌的菌株为阳性对照,生理盐水为阴性对照,即检验菌株在生理盐水中无自凝现象。根据O抗原和H抗原的检测结果对照沙门菌属抗原表[8]确定血清型。
1.5 药敏试验 试验选择临床常用的具有代表性的12种抗菌药物进行药敏试验,并根据美国临床实验室标准化委员会(CLSI)标准[9],采用微量肉汤稀释法对不同年代沙门菌进行耐药性特征分析:挑取2~3个单菌落置5 mL灭菌生理盐水中,用0.5麦氏比浊管进行比浊,调制菌液浓度为1×108~2×108CFU/mL;取菌液60 μL加入12 mL的药敏接种培养液中,进行混匀稀释,利用微生物自动加样仪加入96孔革兰阴性需氧菌药敏板中,每孔100 μL,阴性对照孔单独加入100 μL药敏接种培养液,37 ℃ 恒温培养箱培养18~20 h。在阴性对照孔清澈,阳性对照孔浑浊以及质控菌株的最低抑菌浓度符合规定范围的前提下,根据CLSI药敏判定标准[9]进行被检菌株的敏感性:敏感(S)、中度敏感(I)或耐药(R),未有菌生长的最低浓度即为该菌株对此抗菌药物的最低抑菌浓度(MIC)值,若所有浓度下均见菌生长,则该菌株对此抗菌药物的MIC值为大于其最高稀释浓度。
2 结果
2.1 沙门菌的鉴定 412株菌株通过沙门菌显色培养基和PCR方法共纯化鉴定出鸡源沙门菌共328株,其中1970—1980年38株,1981—2000年12株,2001—2010年143株,2011—2015年135株。
2.2 血清型鉴定 对不同年代的328株沙门菌进行血清分型,其中255株为可分型沙门菌,22株为Ⅱ型菌株并有51株未鉴定出血清型。由表1所示,255株沙门菌共分为10种不同的血清型,鸡源沙门菌在1970—2000年的优势血清型为鸡白痢,2000年以后肠炎沙门菌为主要血清型,其次为鸡白痢,并且出现山夫登堡等多种的血清型。

表1 不同年代沙门菌的血清型分布Table 1 Serotypes distribution of Salmonella in different ages
2.3 MIC检测 试验对不同时期的沙门菌进行了12种抗菌药物的耐药性检测,所有菌株对阿莫西林/克拉维酸、庆大霉素、美罗培南、阿奇霉素、恩诺沙星敏感,对其他7种抗菌药物耐药性结果如表2所示。1970—2000年分离的鸡白痢沙门菌仅对头孢噻呋、黏菌素、磺胺异噁唑出现低水平的耐药,2001—2010年分离的鸡白痢沙门菌对黏菌素、磺胺异噁唑的耐药率升高,并对氨苄西林、四环素、复方新诺明、氟苯尼考出现耐药,但对头孢噻呋的耐药率为0。2011—2015年分离的鸡白痢沙门菌对氨苄西林、四环素、氟苯尼考、磺胺异噁唑的耐药率有所下降。从2001—2010年开始,肠炎沙门菌对氨苄西林、四环素、黏菌素、复方新诺明、磺胺异噁唑出现耐药,2011—2015年肠炎沙门菌对氨苄西林、磺胺异噁唑耐药率大幅度上升。鸡白痢沙门菌的总体耐药水平以及多重耐药率明显高于肠炎沙门菌。
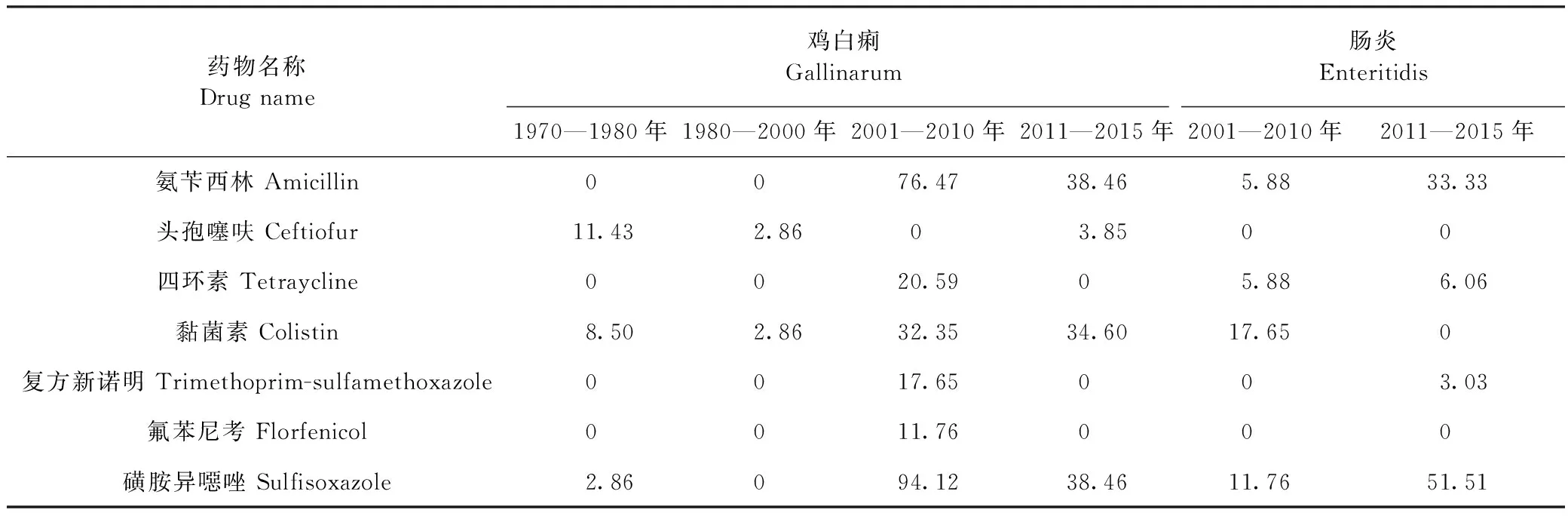
表2 不同年代沙门菌对不同抗菌药物耐药率Table 2 The resistance rate of Salmonella to different antimicrobial agents in different ages (%)
3 讨论
试验菌株来源广泛,所用的血清型为系统的丹麦血清型,分型结果准确。从1970—2015年分离的鸡源沙门菌主要血清型为鸡白痢和肠炎。鸡白痢沙门菌从20世纪70年代到2015年间一直是贯穿我国家禽养殖业的重要血清型之一。这一结果与王建舫等[10]在2009年对禽源沙门菌研究的血清型以及施开创等[11]在2015年对鸡源沙门菌研究的血清型结果一致。鸡白痢是导致家禽高发病率和高死亡率的主要血清型,加强对鸡白痢的净化工作尤为重要。
肠炎沙门菌在2000年以后大量出现,并逐渐成为沙门菌的优势血清型之一。张秀英等[12]2007年鉴定的鸡源沙门菌血清型主要为肠炎。赵建梅等[13]2008—2017年鉴定的鸡源沙门菌血清型主要为肠炎。其比例的增多可能与鸡场鸡白痢的净化有关,其次,肠炎沙门菌感染成年禽的死亡率较低,临床症状不明显,可长期定植于肠道和生殖道中并长期排菌传播,导致肠炎沙门菌菌株不断增多[14]。近几年,肠炎沙门菌的比例也明显超过了鸡白痢[4,15]。自2000年后试验鉴定出了山夫登堡、哈达尔等多种血清型,这可能是由于进出口贸易的增长,国内外沙门菌的交叉感染以及抗原的变异导致血清型的种类逐渐增多。
本试验发现,鸡白痢在20世纪70—80年代的耐药率较低,在2000—2010年对氨苄西林、四环素、氟苯尼考、黏菌素、磺胺异噁唑的耐药率急剧升高,但在2011—2015年有所下降。我国从20世纪60年代开始就有研究发现,鸡白痢沙门菌对磺胺类药物、四环素、庆大霉素等药物的耐药性呈现出显著增强的趋势[16]。代娟娟等[17]研究2002—2007年鸡白痢对四环素的耐药率逐渐增强,且对磺胺类药物一直具有很高的耐药率,与本试验结果一致。沈欣悦等[18]研究2013—2017年鸡白痢对四环素的耐药率呈下降趋势,与本试验中四环素的耐药趋势一致。
肠炎沙门菌随时间的变化对氨苄西林、四环素、复方新诺明、磺胺异噁唑的耐药率逐渐增强。崔苗苗[19]等研究的2017年肠炎沙门菌对氨苄西林、磺胺异噁唑等耐药性较强,而对头孢噻呋、恩诺沙星等药物的耐药性较弱与试验中肠炎沙门菌的耐药结果一致。本试验在2011—2015年间鸡白痢对复方新诺明和氟苯尼考的耐药率为0,肠炎沙门菌对黏菌素的耐药率也为0,这可能与菌株来源以及抗菌药物的使用情况有关。也有相似研究结果表明,2014年江苏地区鸡白痢对氟苯尼考的耐药率为0,山东地区肠炎沙门菌对多黏菌素敏感[20-21]。
根据鸡白痢和肠炎沙门菌对不同抗菌药物的耐药率分析,不同时期不同血清型对抗菌药物的耐药性差异较大。2001—2010年分离的沙门菌中,鸡白痢对氨苄西林、磺胺异噁唑、四环素的耐药率明显高于肠炎,且多重耐药情况也较为严重。研究发现,这可能与不同血清型的耐受程度有关[22]。
