4种肉类成分多重PCR的鉴定方法
2020-03-30袁淑辉王忠才王建昌王素华
袁淑辉 , 蔡 军 , 王忠才 , 李 舟 , 王建昌 , 王素华
(1.温州海关综合技术服务中心 , 浙江温州325027 ; 2. 石家庄海关技术中心 , 河北石家庄050051)
肉类食品安全是世界范围内面临的共同问题,2014年欧洲暴发的“马肉风波”揭露了多国肉制品的掺假现象。不法商家在利益驱使下,在肉制品生产和消费过程中,利用以假乱真、以次充好等手段欺骗消费者而牟取暴利的事件屡屡出现,严重扰乱了市场秩序,侵害了生产者和消费者的合法利益,并涉及少数民族的宗教信仰,同时带来了严重的食品安全隐患。传统的肉种类鉴定主要依靠感官和经验,通过辨别肉制品的味道和色泽,在显微镜下观察肉的纹理等方法对肉类进行鉴别。但是传统的鉴别方法只适用于生鲜肉类,且需要丰富的经验,鉴别过程极具主观性,已无法满足对肉制品掺假现象进行控制与监管的需要[1]。因此,对于居民消费量大、肉制品市场占有率较高的牛肉、猪肉、鸡肉以及曾被掺假使用的马肉,建立准确、快速、高通量的鉴定方法已十分必要[2]。
以基因组DNA为研究对象的PCR扩增技术已经成为肉类种属鉴定的核心方法[3-5]。许多国内外学者根据不同物种的基因序列设计特异性引物,利用PCR反应实现特异性基因片段的指数级扩增,通过凝胶电泳条带或荧光曲线鉴别食品中可能的物种来源[6-8]。本试验基于牛、猪、鸡和马线粒体细胞色素b基因设计了1条通用正向引物F ; 以牛、猪、鸡和马的特定DNA序列为研究对象,设计了4条特异性反向引物,建立了牛、猪、鸡和马4种肉类成分通用引物的多重PCR方法。
1 材料与方法
1.1 材料 以市售合格的牛、猪、鸡、马、羊、鸭、鸽、鹌鹑以及兔肉为试验材料,各物种肉样分别搅碎后-20 ℃ 保存,避免交叉污染。
1.2 主要试剂 Quick-DNATM提取和纯化试剂盒,购自Zymo Research公司;TaqDNA聚合酶(5 U/μL)、dNTPs(10.0 mmol/L)、MgCl2(25 mmol/L)、DL-5 000 DNA Marker,均购自宝生物工程(大连)有限公司。
1.3 方法
1.3.1 DNA提取 用Quick-DNATM提取和纯化试剂盒提取1.1中的肉类总DNA,总DNA样品溶于TE缓冲液中,于-20 ℃保存备用。
1.3.2 引物设计与合成 依照Matsunaga等[9]推荐的方法设计牛、猪、鸡和马线粒体细胞色素b基因的特异性引物,根据牛、猪、鸡和马线粒体细胞色素b基因序列设计正向通用引物CF;根据牛、猪、鸡、马的种属特异性DNA序列设计专属的反向引物。引物扩增长度和序列见表1。引物由上海华大基因科技有限公司合成。
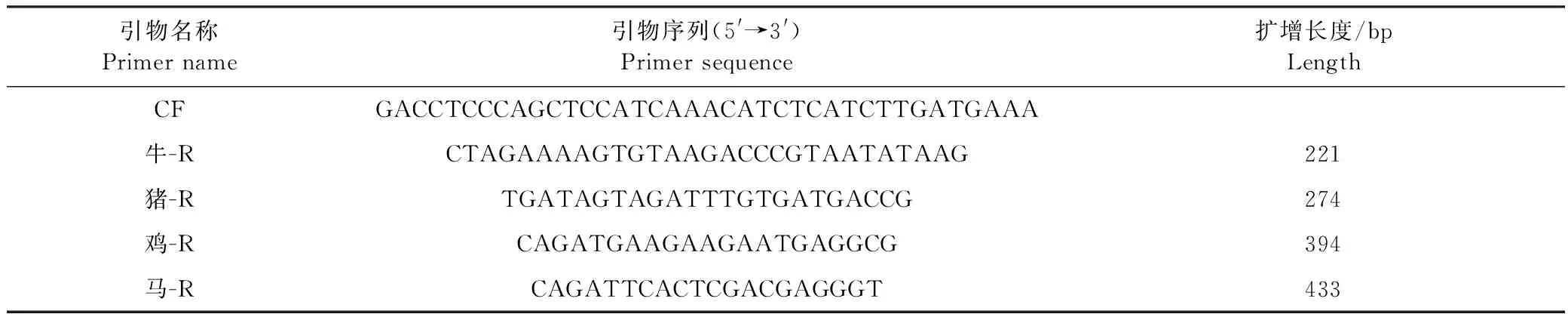
表1 引物序列及扩增片段长度Table 1 Primer sequence and amplification length
1.3.3 多重PCR的反应条件及优化 在50 μL多重PCR反应体系中分别进行牛肉、猪肉、鸡肉和马肉4种肉类的鉴别。反应体系:10×PCR Buffer 5.0 μL, dNTPs(10.0 mmol/L)1.0 μL,MgCl2(25 mmol/L)2.0 μL,CF、牛-R、猪-R、鸡-R、马-R(10 mmol/L)各1.0 μL,稀释至10 ng/μL的DNA模板2.0 μL,加灭菌去离子水至50.0 μL。反应条件:95 ℃ 2 min;95 ℃ 30 s,55~60 ℃ 30 s,72 ℃ 30 s, 35个循环;72 ℃ 10 min;4 ℃结束反应。用2%琼脂糖凝胶电泳检测扩增结果。
1.3.4 特异性试验 按照1.3.3中的反应体系及优化的反应条件,分别使用牛肉、猪肉、鸡肉和马肉4种肉类DNA及两两等比例混合DNA和羊肉、鸭肉、鸽肉、鹌鹑肉和兔肉的DNA对引物的检测特异性进行验证。
1.3.5 敏感性试验 将浓度为10 ng/μL的4种目标肉类DNA 10倍梯度稀释,使用1.3.3的反应体系及优化的反应条件,分别针对牛肉、猪肉、鸡肉和马肉4种肉类验证多重PCR方法的灵敏度。
1.3.6 多重PCR方法检测混合样品 应用1.3.3中建立的方法对混合肉样进行PCR扩增,反应时分别加入1种、2种、3种和4种肉样DNA的混合物,进行多重PCR检测。
1.3.7 市售样本的检测 应用建立的多重PCR检测方法对市场采购的8类共80个不同的牛肉制品进行鉴定,并与实验室常用的荧光定量PCR试剂盒鉴定结果进行比较,验证方法的准确性应用价值,并了解市场上肉类掺假的真实情况。
2 结果
2.1 模板DNA质量 用核酸蛋白分析仪测定提取的基因组DNA的浓度和纯度,所测OD260 mm/OD280 mm值在1.8~2.1,浓度为130~180 ng/μL,从样品中提取的DNA无论是浓度还是纯度都较高,能满足后续PCR扩增试验的需要。
2.2 多重PCR反应条件优化 通过退火温度的梯度PCR试验,结合PCR扩增的特异性与产物量,确定最佳退火温度为60 ℃。使用1.3.3中的方法扩增的牛肉、猪肉、鸡肉和马肉4种肉类DNA片段长度分别为274 bp,394 bp,221 bp和433 bp,结果见图1。
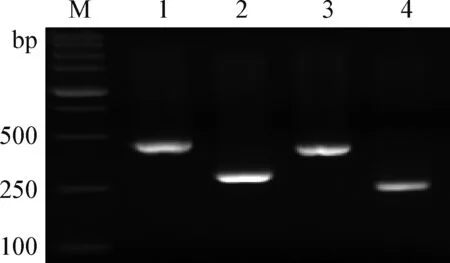
图1 4种肉类PCR产物凝胶电泳图Fig.1 Gel electrophores is of PCR products of four kinds of meatM: DL-5 000 DNA marker; 1:马肉; 2:牛肉; 3:猪肉; 4:鸡肉M: DL-5 000 DNA marker; 1:Horse; 2:Beef; 3:Pork; 4: Chicken
2.3 引物特异性验证 分别使用4种目标肉类的单一种类DNA和两两等比例混合DNA及羊肉、鸭肉、鸽肉、鹌鹑肉和兔肉的DNA对引物的检测特异性进行验证与比较,结果见图2。对牛肉、猪肉、鸡肉和马肉4种肉类的单一种类和两两混合DNA进行检测,均能在设计位置观察到特异性条带,未见非特异性扩增,且与羊肉、鸭肉、鸽肉、鹌鹑肉和兔肉的DNA均无交叉反应。
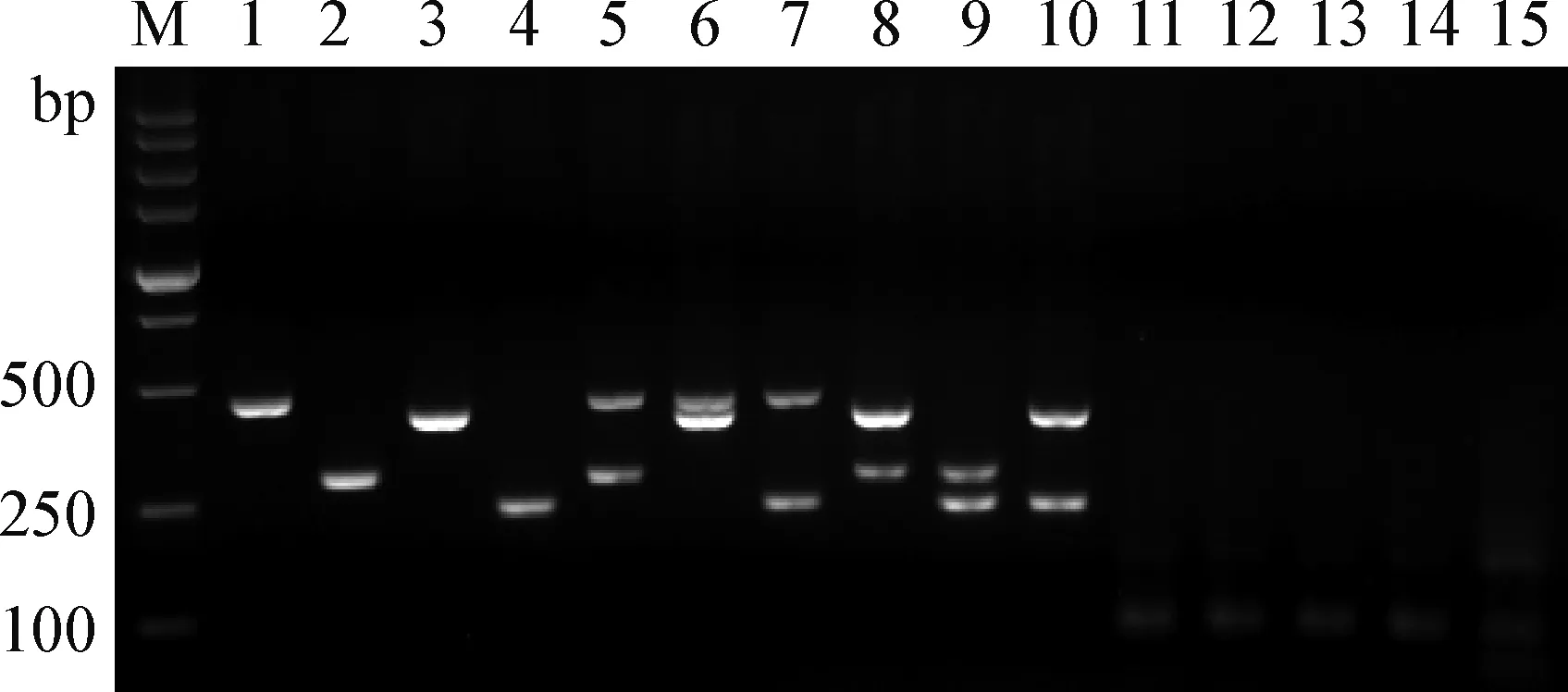
图2 多重PCR特异性试验Fig.2 Specificity results of multiplex PCRM: DL-5 000 DNA marker; 1:马肉; 2:牛肉; 3:猪肉; 4:鸡肉; 5:马肉和牛肉; 6:马肉和猪肉; 7:马肉和鸡肉; 8:牛肉和猪肉; 9:牛肉和鸡肉; 10:猪肉和鸡肉; 11:羊肉; 12:马肉、牛肉和鸡肉;13:马肉、猪肉和鸡肉; 14:鹌鹑肉; 15:兔肉M: DL-5 000 DNA marker; 1:Horse; 2:Beef; 3:Pork; 4:Chicken;5:Horse and beef; 6:Horse and pork; 7:Horse and chicken; 8:Beef and pork; 9:Beef and chicken; 10:Pork and chicken; 11:Ovine; 12:horse, beef and chicken; 13:horse, pork and chicken; 14:Quail; 15:Rabbit
2.4 敏感性试验 将10 ng/μL的牛、猪、鸡和马肉DNA模板进行10倍梯度稀释,使用1.3.3中的反应体系及优化的反应条件,针对上述4种肉类DNA验证多重PCR方法的灵敏度,结果见图3。由图3可见,4种肉类DNA各至稀释10-3后,使用多重PCR方法进行检测,仍能观察到微弱的特异性条带;目标DNA稀释至10-4后进行多重PCR扩增,不能观察到特异性条带。因此,检测的灵敏度可达到10×10-3ng/μL。

图3 多重PCR敏感性试验Fig.3 Specificity results of multiplex PCRM: DL-5 000 DNA marker; H:马肉; B:牛肉; P:猪肉; C:鸡肉M: DL-5 000 DNA marker; H:Horse; B:Beef; P:Pork; C:Chicken
2.5 混合肉样检测 用建立的多重PCR快速检测方法,分别以牛、猪、鸡和马肉的DNA为模板,按照1.3.3中优化的反应条件进行多重PCR检测,4种肉类的单一种类DNA、2种、3种及4种DNA等比混合物均能得到有效鉴别,结果见图4。
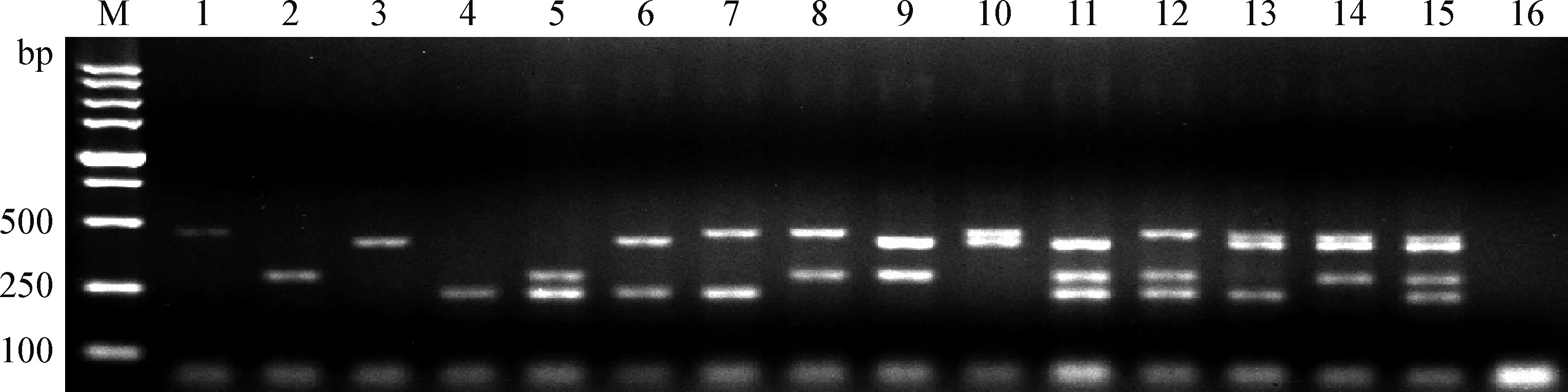
图4 混合肉样检测结果Fig.4 Results of mixed meat samplesM: DL-5 000 DNA marker; 1:马肉; 2:牛肉; 3:猪肉; 4:鸡肉; 5:牛肉和鸡肉; 6:猪肉和鸡肉; 7:马肉和鸡肉; 8:马肉和牛肉; 9:猪肉和牛肉; 10:马肉和猪肉; 11:牛肉、猪肉和鸡肉; 12:马肉、牛肉和鸡肉; 13:马肉、猪肉和鸡肉;14:马肉、牛肉和猪肉; 15:马肉、牛肉、猪肉和鸡肉; 16:阴性对照M: DL-5 000 DNA marker; 1:Horse; 2:Beef; 3:Pork; 4:Chicken; 5:Beef and chicken; 6:Pork and chicken; 7:Horse and chicken;8:Horse and beef; 9:Pork and beef; 10:Horse and pork; 11: Pork, beef and chicken; 12:Horse, beef and chicken; 13:Horse, pork and chicken; 14:Horse, pork and beef; 15:Horse, pork, beef and chicken; 16:Negative control
2.6 市售肉制品检测 应用建立的多重PCR方法对市场采购的8种80个不同牛肉制品进行掺假鉴定,判定与所贴标签是否相符,同时验证所建立的多重PCR检测方法推广使用的可行性。鉴别结果见表2,由表2可知,部分牛肉产品存在一定的掺假和食品安全问题。混合引物能够扩增出多种肉类相应的特异性条带,能准确鉴定出几种常见的动物源性成分,经过热加工的肉制品扩增条带仍然十分清晰。多重PCR与商品化荧光定量PCR检测试剂盒对80个不同牛肉制品掺假的检测结果基本吻合,只对一组10个样品的盒装牛肉片检测结果有差异,荧光定量PCR检测试剂盒比多重PCR的检出率高10%,这可能是由于掺入量少,多重PCR未能检出。牛、猪、鸡、马肉等常见肉食品的种类在日常检测鉴定中占很大比重,此方法可作为政府检验部门对肉制品的常规检测,用于肉类真伪鉴别和掺假成分的判断。
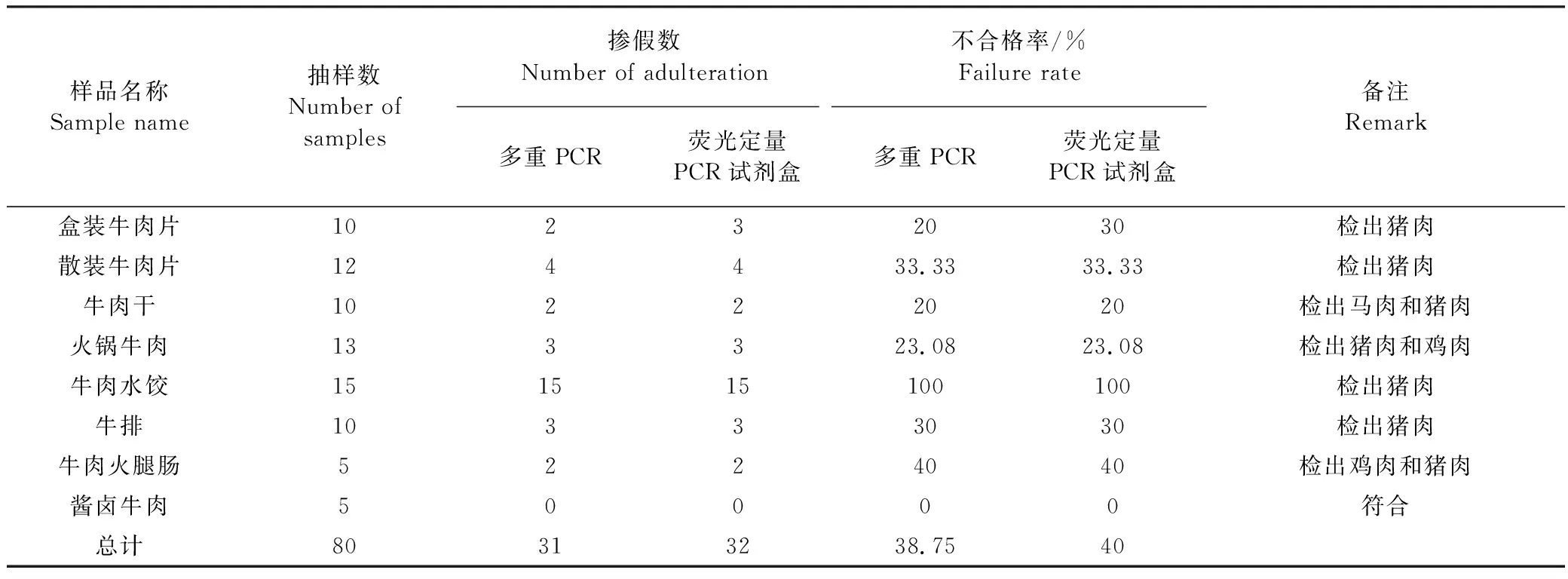
表2 实际样品检测结果Table 2 Results for market samples
3 讨论
近年来,随着分子生物学检测技术的不断发展,逐步形成了以核酸检测为基础的鉴定体系。在鉴定动物源性成分的过程中,多重PCR技术可通过一次扩增同时检测多个靶标基因,弥补了普通PCR在肉制品掺假检测中的不足,成为常见的鉴定方法之一。本试验在参考前人研究的基础上[10-11],基于牛、猪、鸡和马的特定基因,建立了快速检测4种肉类成分的多重PCR方法。采用正向引物通用、反向引物特异的设计策略,应用包含5条引物的多重PCR体系实现4个物种的鉴定,尽量控制引物数量过多引起的交叉干扰。经引物序列和反应体系优化,建立的多重PCR具有较高的敏感性和特异性。相比于普通PCR和实时荧光定量PCR技术对动物源性成分的鉴定,本试验具有检测仪器简单、检测成本低、检测通量高等优点,更适合于对大量肉制品掺假的鉴别筛选。
近年来曝光的肉制品掺假主要是使用售价较低的猪肉、鸡肉和马肉等掺入到售价较高的牛肉和羊肉中。本试验针对可能出现的掺假肉类种类,筛选出保守性强的在牛、猪、鸡、马物种特异性基因,并验证了其特异性和敏感性。建立的多重PCR反应体系对于同时鉴定目标肉类中的2种、3种或4种成分都具备良好的效果。对80份以牛肉为主的市售样品进行掺假鉴别,可敏感、特异、准确的检出牛肉制品中掺入的猪、马、鸡成分。
本试验建立了敏感性高、特异性强的4种肉类成分多重PCR鉴定方法,该方法可有效缩短和简化肉制品掺假鉴定的步骤,比普通PCR技术提高了检测通量,比实时荧光PCR技术节约了检测成本。
