代料栽培金耳出耳期易感染真菌病害多样性初探
2020-03-30威田云霞童江云
田 霄 汪 威田云霞 童江云
(昆明市农业科学研究院,云南昆明650000)
金耳(Tremella aurantialba),也称脑型银耳、金银耳,隶属担子菌门(Basidiomycota)银耳科(Tremella)银耳属(Tremella),是一种珍贵的食药同源真菌。金耳子实体外观呈脑状,色泽金黄,富含胶质,食用口感爽滑;临床研究发现金耳多糖具有降低血糖、血脂,增强免疫力[1],抗凝血[2]和抗肿瘤[3]等效果。金耳是食用菌中珍品,也是保健美容佳品,有着广阔的发展前景。
早在1982―1996年,刘正南等[4]成功引种驯化了野生金耳,并进行大面积推广,取得了良好的经济和社会效益。由于金耳自身特殊的生理特性和制种特性,金耳菌种尚不稳定。代料栽培金耳在原基形成初期容易遭到杂菌感染,导致烂耳和出耳不整齐,严重影响金耳产量和生物转化率[5],阻碍了代料栽培金耳的大规模推广。研究金耳出耳期的病害发生原因,是降低金耳污染率,提高金耳产量和经济效益的重要环节。
真菌的ITS基因相比18SrRNA基因(其进化速率为18SrDNA的10倍)或28SrRNA基因而言整体的变异性更强,因而物种间的序列差异会更大,分类信息会更加详尽,具有高通量、高精度、极佳重现性和测序成本低等特点,被广泛应用于微生物生态学研究[6]。ITS包含ITS1和ITS2两个区域。ITS1位于真核生物18S和5.8S基因之间,ITS2位于真核生物5.8S和28S基因之间,其序列更长且包含信息更多。笔者选取代料栽培金耳出耳期受感染部位,进行ITS2高通量测序和菌种分离,分析其主要的真菌群落,为代料栽培金耳出耳期杂菌防控提供理论依据。
1 材料与方法
1.1 供试材料
(1)供试菌种:从云南省农业科学研究院引进金耳与毛韧革菌混合菌种。将混合菌种扩繁,待出耳且耳块长至5 cm左右后置于-4℃冰箱保存。(2)供试配方:栽培料配方为粗木屑79%,麸皮15%,硫酸钙1%,碳酸钙1%。(3)主要试剂和仪器。PCR采用KOD-401B:TOYOBO KOD-Plus-Neo DNA Polymerase;PCR 仪 :Applied Biosystems®Gene Amp®PCR System 9700。
1.2 试验方法
1.2.1 代料培养
按配方制备栽培袋(121℃高压灭菌3 h)。将保藏的菌种从冰箱取出置于室温下,在无菌条件下,在栽培袋侧面部位打孔(直径约2 cm,深度约2 cm),挑取子实体1~2 cm和子实体下方少许混合菌丝接入栽培袋孔内,用透气密封条密封口,放置温度20~23℃,黑暗环境中培养30 d左右,至袋内长满白色粗壮的菌丝。此后10 d左右,接种块附近出现黄色分泌物,逐渐形成脑状原基。
1.2.2 取材
在原基形成后10 d内,选取受到杂菌感染的菌包,分别挑取三个样本:被感染的接种部位的培养料、菌包中间和底部的培养料,编号为TA-ZJ、TA1和TA2(图1)。每个样本5重复。
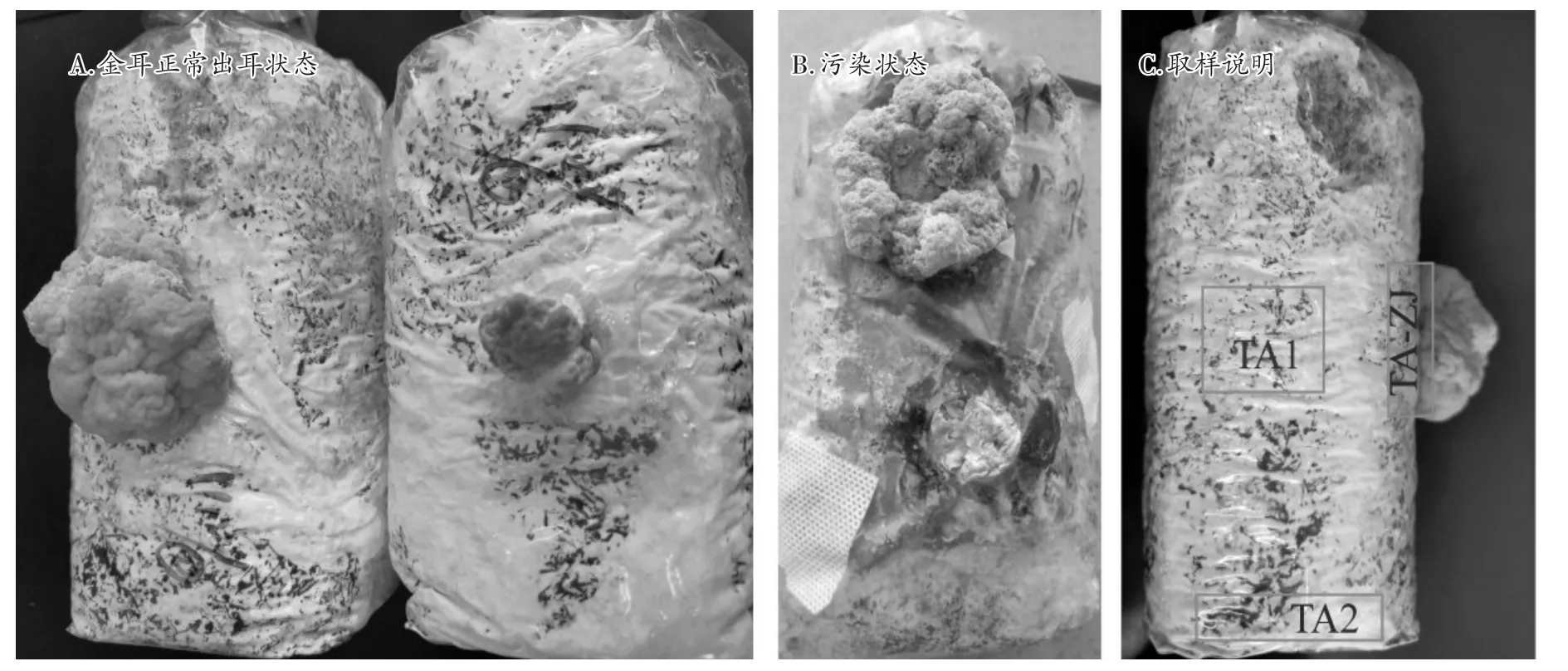
图1 金耳正常出耳、污染状态及采样处
1.2.3 样本DNA的提取与纯化
利用DNA提取试剂盒(Zymo Research BIOMICS DNA Microprep Kit D4301)对3个样本进行基因组DNA抽提。0.8%琼脂糖凝胶电泳对所提DNA进行检测。
1.2.4 ITS片段高通量测序鉴定
1.2.4.1 PCR扩增
利 用 特 异 引 物(ITS3_KYO2:5’-GATGAAGAACGYAGYRAA-3’和 ITS4:5’-TCCTCC GCTTATTGATATGC-3’)对样本DNA的ITS2区域进行扩增[7]:每个样本进行3次PCR重复。
1.2.4.2 PCR产物检测、纯化和定量
利用2%琼脂糖凝胶对PCR产物进行电泳检测。切胶回收(QIAquick Gel Extraction Kit QIAGEN)。
1.2.4.3 文库构建
文库构建用Illumina公司TruSeq DNA PCRFree Sample Prep Kit(FC-121-3001/3003)。
1.2.4.4 测序和生物信息分析及统计
用FLASH拼接双端序列。基于Barcode从reads中拆分出各样本序列。截去Barcode序列得到原始数据,然后用Trimmomatic进行质控。得到有效数据Clean Reads。
使用UCLUST分类法与UNITE数据库(https://unite.ut.ee/)进行注释分析。用MAFFT version 7的FFT-NS-2算法将代表性序列进行多重比对。对各样本做均一化处理,以样本中数据量最少的为标准进行重抽样。
采用R语言进行各种数据转换,ggplot2构建热图。
1.2.5 真菌形态学鉴定
1.2.5.1 感染真菌的分离与纯化
采集的3个样本无菌条件下放置在PDF平板上,25℃培养至菌落形成。挑取平板上不同菌落的边缘部位进行多次纯化分离。
1.2.5.2 真菌的形态学鉴定
将纯化的菌株接种到PDA平板上,采用插片培养法,在接种平板边缘以45°斜插入3片盖玻片,25℃培养至菌丝长满平板。取出盖玻片制作成临时片,在电子显微镜下做镜检并拍照。参照文献将各真菌进行形态学鉴定[8-10]。
2 结果与分析
2.1 真菌群落组成分析
根据测序结果分析,3个样本相对丰度水平最高的菌群均为子囊菌门(Ascomycota)木霉属(Trichoderma);同时在3个样本中相对丰度水平较高的菌群有担子菌门(Basidiomycota)考克娃酵母属(Kockovaella)、子囊菌门(Ascomycota)镰刀霉属(Fusarium)、青霉属(Penicillium)、曲霉属(Aspergillus)、拟青霉 属(Simplicillium)和 头 束 霉 属(Cephalotrichum)(图2)。
3个样本中,在TA1和TA2中发现的被孢霉门(Mortierellomycota)被孢霉属(Mortierella)群落相对丰度水平比样本TA-ZJ高,而担子菌门(Basidiomycota)柄环菌属(Podoscypha)、壶菌门(Chytridiomycota)小壶菌属(Spizellomyces)在TA-ZJ样本中未能鉴定到。
木霉属在整个序列相对丰度水平中,样本TA1达35%,TA2达19%,TA-ZJ高达63%。毛韧革菌所在的韧革菌属(Stereum)占据了较高的比例,相对丰度值分别为29%、38%和10%。金耳所在的银耳属(Tremella)占比较低,3个样本平均不到5%。

图2 各样本的感染真菌群落(属)
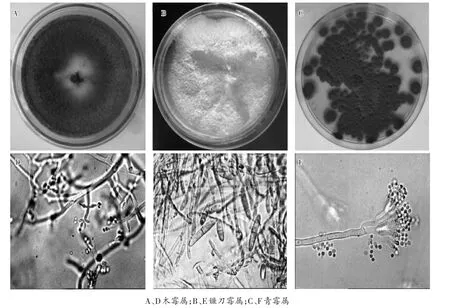
图3 感染真菌纯化菌株及其显微结构
2.2 形态学鉴定
经多次分离纯化后总共获得了100个菌株,形态学分析主要属于木霉属(分离菌株数75个)、镰刀霉属(分离菌株数7个)和青霉属(分离菌株数8个)其他菌株10个(图3A、B、C),经显微结构鉴定进一步证明其确实属于木霉属(图3A)、镰刀霉属(图3E)和青霉属(图3F)真菌。
3 小结与讨论
食用菌病害根据病害发生的原因分为三种类型:侵染性病害、竞争性病害和生理性病害。侵染性病害主要是病原菌侵染食用菌本身,导致菌丝死亡或者子实体出现斑点、畸形甚至腐烂;竞争性病害则是病原菌侵染栽培基质,与菌丝体争夺养分和生存空间导致食用菌凋亡[11]。金耳子实体是由金耳和毛韧革菌组成的异质复合体[12],两者的关系目前还不够清晰[13],关于金耳的主要病害研究目前鲜有报道。金耳出耳期发生病害的原因:接种栽培场地和栽培料因素,环境因素、水源因素,料袋灭菌因素,袋的质量因素,出耳期的湿度和通风管理因素等。金耳生长前期以毛韧革菌菌丝生长为主,到一定程度后金耳菌丝才开始生长[14],两者比例失调会导致出耳率下降[15],金耳幼耳本身抗病性差,且对不良环境敏感[1],在开袋后容易受到来自外界空气和水中广泛存在的木霉、青霉等真菌病原菌的侵染而发生病害。
ITS2高通量测序结果表明,取样点主要感染菌群落属于子囊菌门木霉属,按丰度水平依次为孢霉属、镰刀霉属、考克娃酵母属、曲霉属、青霉属、拟青霉属和头束霉属。金耳出耳初期容易分泌黄水[5],开袋后与外界空气接触,容易受到杂菌侵染。试验出菇房曾多年栽培香菇和平菇等菇类,杂菌孢子基数高,而金耳出耳期需要较高的空气相对湿度,若通风控制不当,易造成木霉感染。试验取样的菌袋前期菌丝生长正常,开袋出耳后出现感染,因此病原菌来自袋外可能性较高。形态学分析仅鉴定到三种真菌:木霉属、镰刀霉属和青霉属,其中分离木霉属菌株数最高,这一结果与高通量测序结果一致。另外从高通量测序结果可以看出,除了木霉属,其余杂菌属相对丰度水平都很低。肉眼观测取样的菌袋大部分为绿色木霉污染(图1),因受试验方法限制,仅能分离和提纯得到少量的属种。
自然界中各种微生物的种类和数量非常多,而木霉是感染食用菌培养料和子实体最严重的一种杂菌,笔者试验得出同样结果。为此,笔者对金耳出耳期的管理提出几点建议:首先,控制病原菌。木霉孢子及菌丝体广泛分布在自然界中,木霉等多数杂菌生长适温为22~28℃,与金耳菌丝生长适温相近,木霉菌丝很容易在金耳菌丝生长期大量繁殖,出耳期爆发。预防原则:一是源头把控,降低环境中杂菌基数、用水洁净,培养料灭菌彻底;其次,优化管理。木霉、青霉等杂菌喜欢高湿环境,其菌丝较耐二氧化碳,而金耳子实体的展开和转色也需要一定的氧气量,因此要协调好金耳出耳期的湿度与通气,保持空气相对湿度在85%~95%,随时监测出菇房内二氧化碳浓度,做到每天定时通风换气;第三,选择优良的金耳菌种及适宜代料配方,培养出高质量金耳出菇菌袋[11,16]。
