HMGB1/RAGE信号通路参与尼古丁调控支气管上皮细胞TGF-β1和FGF-2的分泌
2020-03-28邹威凤王晓茜盛青周晓婷黎希
邹威凤 王晓茜 盛青 周晓婷 黎希
广州市胸科医院呼吸科510000
COPD主要的病理改变包括气道慢性炎症和气道重塑,其中,小气道重塑是引起COPD患者持续存在的气流受限的主要原因。既往研究表明高迁移率族蛋白1(high mobility group protein B1,HMGB1)/晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)信号通路参与了COPD气道炎症和重塑,且与气道阻塞程度呈正相关[1-2]。HMGB1/RAGE信号通路可通过调节促纤维因子转化生长因子-β1(transforming growth factor-β1,TGF-β1)和成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2)的分泌从而参与肺纤维化形成[3]。吸烟作为影响COPD发生、发展的重要危险因素,研究表明香烟烟雾可诱导大鼠肺和气道HMGB1/RAGE的表达[4-5],体外研究显示香烟烟雾提取物可促进肺上皮细胞A549和R3/1细胞株中RAGE及其配体的表达[6]。我们前期研究已证实香烟烟雾主要成分之一尼古丁可诱导气道上皮细胞中HMGB1[7]的分泌。本研究旨在探讨尼古丁是否通过HMGB1/RAGE信号通路调控气道上皮细胞TGF-β1和FGF-2的分泌。
1 材料与方法
1.1 材料 人气道上皮细胞株16HBE(广州医科大学提供),DMEM培养基(美国GIBCO公司),尼古丁(美国SanDiego公司),HMGB1 siRNA、RAGE抗体、RAGE中和抗体、IgG抗体(美国R&D公司),HMGB1、TGF-β1和FGF-2酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(美国R&D公司)。
1.2 正常人支气管上皮细胞株HBE培养及处理 10%小牛血清的DMEM培养液,按2×10-5细胞/瓶将细胞接种于6孔板中,使细胞生长再次达到60%~70%融合。空白对照组换为无血清DMEM培养基,尼古丁(6×10-6mol/L)刺激细胞24 h后收集细胞。其中HMGB1 siRNA处理组分组:空白对照组、尼古丁组、阴性对照siRNA+尼 古 丁 组、HMGB1 siRNA+尼 古 丁 组、HMGB1 siRNA+空白对照组;RAGE中和抗体处理组分组:空白对照组、尼古丁组、IgG+尼古丁组、RAGE中和抗体+尼古丁组(每组设3个复孔)。
根据实验时间取出培养板,各孔的培养上清液离心,取上清液于小离心管中-70℃保存,备用。
1.3 HMGB1 siRNA转染 细胞干预前24 h将细胞接种于6孔培养板,使得次日进行干预时细胞融合达60%。将脂质体与HMGB1 siRNA和阴性对照siRNA均按6μl∶6μl分别加入100 ml DMEM培养基,二者混合后室温下放置20 min。分别加入干扰组、阴性对照组,常规体外培养5 h。再加入1 ml DMEM培养基,继续培养19 h。
1.4 RAGE中和抗体转染 细胞干预前24 h将细胞接种于6孔培养板,2 ml含FBS的无抗生素基础培养基,接种密度为2×10-5/孔,使得次日进行干预时细胞融合达60%。将RAGE中和抗体和阴性对照IgG抗体分别加入干扰组、阴性对照组,预先培养1 h。再继续加入尼古丁刺激培养24 h。
1.5 ELISA检测 ELISA检测人支气管上皮细胞HMGB1、TGF-β1和FGF-2的分泌采用ELISA试剂盒测定培养液HMGB1、TGF-β1和FGF-2含量,检测方法按试剂盒说明书进行。
1.6 统计学分析 用SPSS 21.0软件进行统计学分析。实验数据以表示,两个样本均数的比较采用t检验;多个样本均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同处理组中HMGB1蛋白分泌的比较ELISA检测显示,尼古丁刺激24 h后HMGB1蛋白的分泌量较未给予尼古丁刺激的正常对照组明显增加,经HMGB1 siRNA预处理后再给予尼古丁干预24 h,HMGB1蛋白在干扰组的分泌量比单纯的尼古丁干预组明显减少,差异有统计学意义(P<0.05)。而给予阴性对照siRNA预处理后再给予尼古丁干预,HMGB1蛋白分泌量与单纯尼古丁干预组比较,差异无统计学意义(图1)。
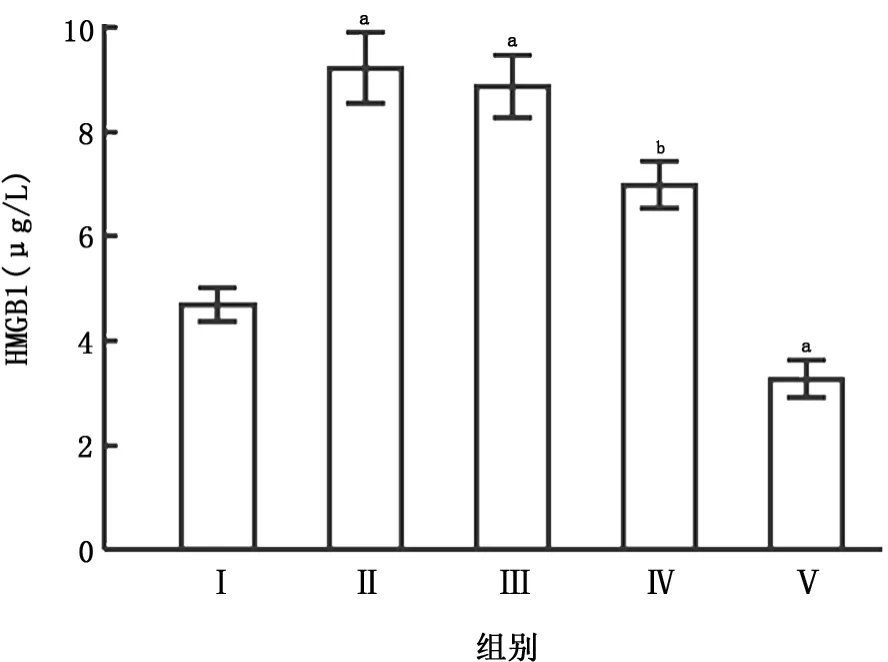
图1 ELISA显示经HMGB1 siRNA预处理后HMGB1蛋白在干扰组的分泌量比单纯的尼古丁组明显减少
2.2 不同处理组中RAGE蛋白表达的比较Western blotting检测显示,尼古丁刺激24 h后RAGE蛋白的表达量较未给予尼古丁刺激的正常对照组明显增加,经HMGB1 siRNA预处理后再给予尼古丁干预24 h,RAGE蛋白在干扰组的表达量比单纯的尼古丁干预组明显减少,差异有统计学意义(P<0.05)。而给予阴性对照siRNA预处理后再给予尼古丁干预,RAGE蛋白表达量与单纯尼古丁干预组比较,差异无统计学意义(图2)。
Western blotting检测显示,经RAGE中和抗体预处理后再给予尼古丁干预,RAGE蛋白在干扰组的分泌量比单纯的尼古丁干预组明显减少,差异有统计学意义(P<0.05);给予阴性对照IgG预处理后再给予尼古丁干预24 h,RAGE的蛋白分泌与单纯尼古丁干预组比较,差异无统计学意义(图3)。
2.3 不同处理组中TGF-β1和FGF-2蛋白分泌的比较结果 见图4。ELISA检测显示,尼古丁刺激24 h后TGF-β1和FGF-2蛋白的分泌量较未予尼古丁刺激的空白对照组明显增加,经HMGB1 siRNA或RAGE中和抗体预处理后再给予尼古丁干预24 h,TGF-β1和FGF-2蛋白在干扰组的分泌量比单纯的尼古丁干预组明显减少,差异有统计学意义(P<0.05)。而给予阴性对照siRNA或IgG预处理后再给予尼古丁干预,TGF-β1和FGF-2蛋白分泌量与单纯尼古丁干预组比较,差异无统计学意义(图4)。
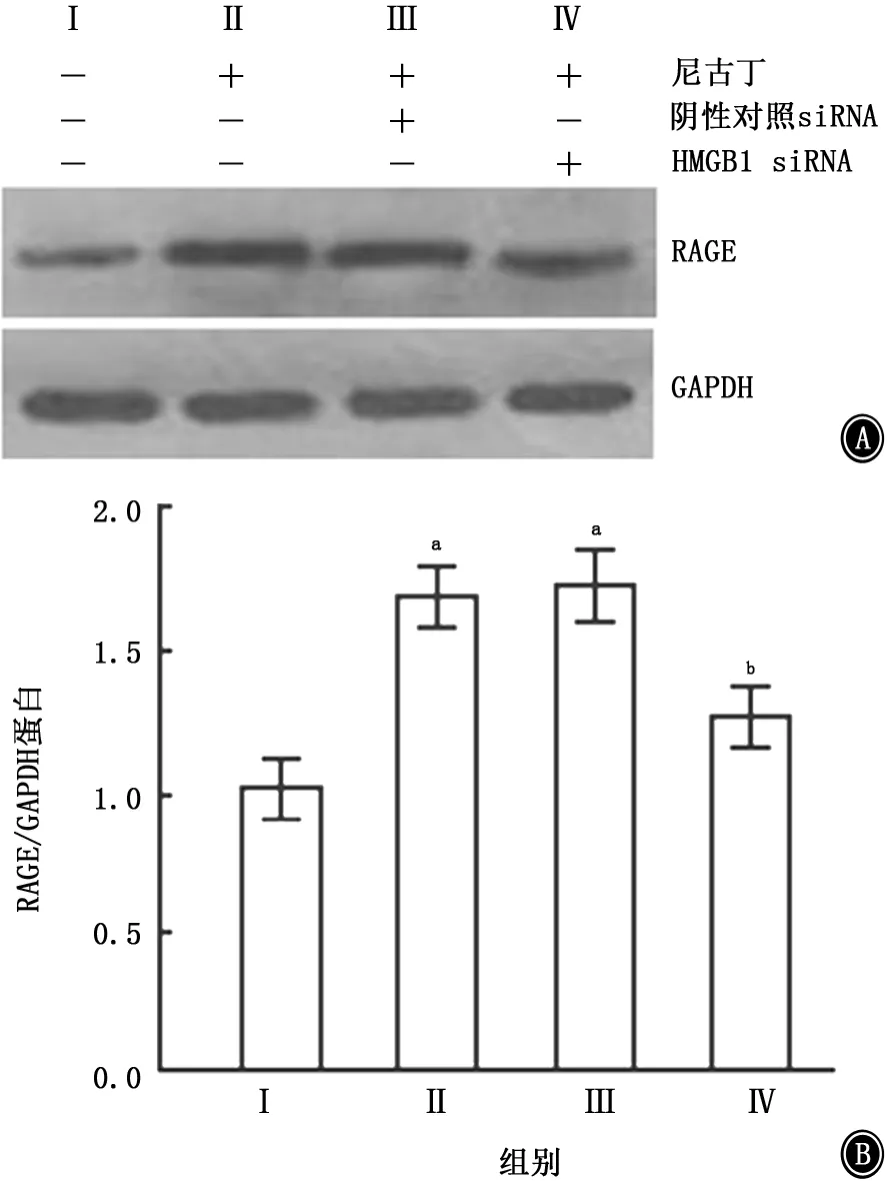
图2 Western blotting显示经HMGB1 siRNA预处理后RAGE蛋白表达的比较
3 讨论
吸烟是公认的导致COPD发病和不可逆气流受限进展的最为重要的致病因素,其中主要成分之一尼古丁可能会通过上调促纤维化因子而参与COPD中的气道重塑,气道重塑是COPD发生、发展最主要的机制之一。我们在研究中发现尼古丁可诱导HMGB1和TGF-β1的分泌。研究报道损伤的上皮细胞可分泌各种促纤维化因子,其中包括TGF-β1[8]和FGF-2[9]。HMGB1/RAGE信 号 通 路可进一步通过调节促纤维因子TGF-β1和FGF-2的分泌从而参与气道重塑形成[10]。
HMGB1是广泛存在于真核细胞核中重要的非组蛋白之一,具有多种核外的生物学功能,与诱导炎症反应、细胞分化、细胞迁移等密切相关。并在多种组织和细胞中广泛分布。病理状态下,细胞破坏可引起HMGB1释放到细胞间隙并结合相应的受体如RAGE、Toll样受体2(toll-like receptor 2,TLR-2)、TLR-4,从而合成并释放细胞因子[11]。其中RAGE属于免疫球蛋白的一种,是一种跨膜信号转导受体。释放到细胞间隙的HMGB1可上调RAGE的表达。RAGE高水平表达于正常肺组织,尤其是肺内皮细胞、支气管上皮细胞、肺泡巨噬细胞和Ⅰ型肺泡上皮细胞。体外研究显示香烟烟雾提取物可促进肺上皮细胞A549和R3/1细胞株中RAGE及其配体的表达。
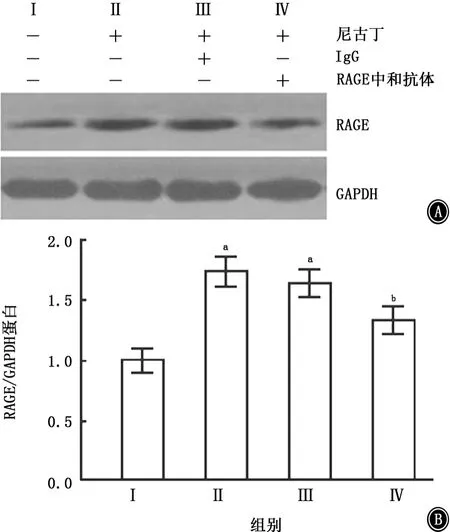
图3 Western blotting显示经RAGE中和抗体预处理后RAGE蛋白表达的比较
我们前期研究已证实香烟烟雾主要成分之一尼古丁可诱导气道上皮细胞中HMGB1的分泌。结合我们前期实验结果,我们推测尼古丁可能通过HMGB1/RAGE信号通路调控气道上皮细胞TGF-β1和FGF-2分泌,从而参与了吸烟所致的COPD气道重塑。为此我们观察了HMGB1/RAGE信号通路在尼古丁调控16HBE细胞TGF-β1和FGF-2分泌中的作用,结果显示尼古丁可诱导16HBE细胞HMGB1、TGF-β1和FGF-2的分泌和RAGE表达。既往研究报道HMGB1可主要通过RAGE配体诱导支气管上皮细胞中各种细胞因子的分泌[11-12]。因此我们在各实验组加入HMGB1 siRNA后,检 测RAGE的 表 达 量 及TGF-β1和FGF-2的分泌量。实验表明经HMGB1 siRNA干预后,HMGB1的分泌量较单纯尼古丁刺激组明显减少,RAGE的表达量显著减少。同时TGF-β1和FGF-2的分泌量较单纯尼古丁刺激组显著减少。这说明HMGB1/RAGE可能在尼古丁诱导支气管上皮细胞TGF-β1和FGF-2的分泌中起重要作用。
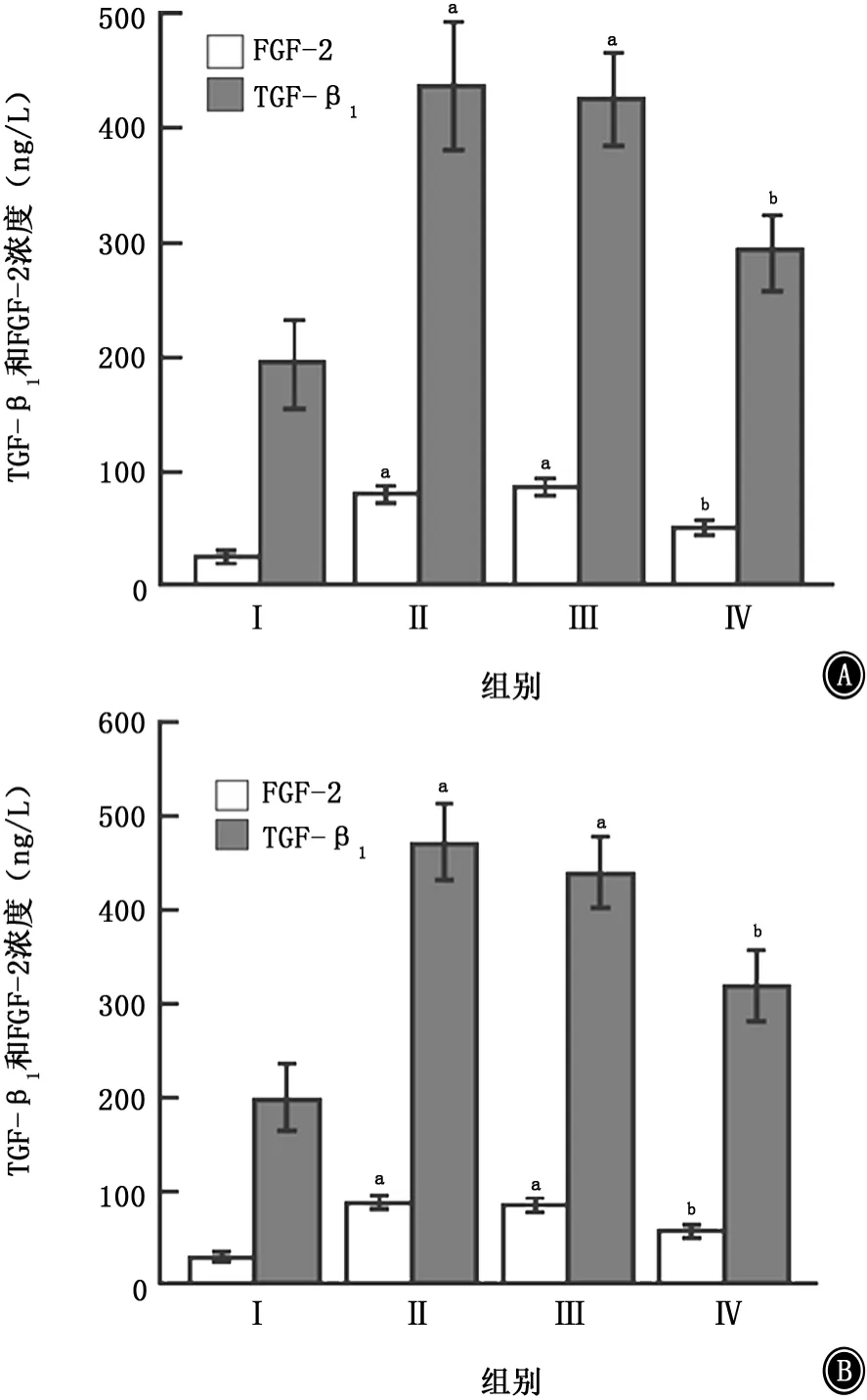
图4 ELISA显示TGF-β1和FGF-2蛋白在干扰组的分泌量比尼古丁组明显减少 A:HMGB1siRNA干扰后TGF-β1和FGF-2蛋白表达量;B:RAGE中和抗体干扰后TGF-β1和FGF-2蛋白表达量
也有研究报道HMGB1可通过配体TLR-2和TLR-4诱导巨噬细胞中各种细胞因子的分泌[13]。基于此,我们在各实验组进一步加入RAGE中和抗体预处理后,检测TGF-β1和FGF-2的分泌量。实验表明经RAGE中和抗体预处理后,TGF-β1和FGF-2的分泌量较单纯尼古丁刺激组显著减少。通过分析我们的实验结果与既往的文献,提示HMGB1可能通过促进RAGE的表达参与了尼古丁调控人支气管上皮细胞TGF-β1和FGF-2的分泌,从而促进了吸烟所致COPD患者气道的重塑。该研究为寻找更有针对性的治疗吸烟相关的COPD的新靶点提供了理论依据。
利益冲突所有作者均声明不存在利益冲突
