烟草烟雾诱导的慢性阻塞性肺疾病模型大鼠消化道的病理特点
2020-03-28李狄非李德富郑则广卢文菊胡杰英陈荣昌
李狄非 李德富 郑则广 卢文菊 胡杰英 陈荣昌
1广州医科大学附属第一医院呼吸内科 广州呼吸健康研究院 呼吸疾病国家重点实验室 国家呼吸系统疾病临床医学研究中心510120;2广州医科大学附属第五医院呼吸内科510799
COPD是一种以气流受限不完全可逆为特征的呼吸系统疾病。有文献报道,COPD患者较健康人群更易出现营养不良的表现,且患者体质量指数与预后呈负相关[1]。国内外关于COPD患者营养不良的研究表明,COPD患者营养不良的发生率约为24%~60%[2],表现为体质量减轻[3],营养不良患者将同时出现肺功能下降[4]、活动能力减低[5]等,严重影响患者的生存质量和寿命;改善COPD营养不良有利于改善预后。为了帮助COPD患者提高营养状况,需明确COPD患者营养不良的发生机制。
人体的消化系统包含肝、脾、胃、小肠、大肠等脏器,它们具有消化、吸收营养物质的作用[6]。人体的消化系统功能紊乱会引起消化和吸收营养物质的能力减弱,从而引起营养不良。Beloborodova等[7]发现,在中、重度COPD患者中,小肠对脂肪、蛋白质和碳水化合物的吸收能力下降,随着病情的进展,吸收能力的下降进一步加重,且其功能恢复的潜能也降低。传统的中医学也指出,肺与大肠相表里,肺部的疾患可以影响到正常的消化吸收功能[8]。消化和吸收功能障碍影响COPD患者的营养状态。
COPD患者消化和吸收功能障碍的机制尚不清楚,除了呼吸困难通过交感神经兴奋-内脏血管收缩、血流供应减少影响消化吸收功能障碍外,本课题组认为全身炎症反应可以导致消化道结构的改变,进而导致消化吸收功能障碍[9]。本研究拟通过建立COPD大鼠模型,观察大鼠消化道的病理改变,探索COPD患者营养不良的治疗方法。
1 材料与方法
1.1 动物与试剂 SPF级SD大鼠(雄性,4~5周龄,体质量约100 g),购自广东省实验动物中心,饲养于广州医科大学呼吸疾病国家重点实验室SPF级动物房,2周后待体质量达到200 g左右,开始进行实验。所有动物的使用、处理操作规范等均经广州医科大学附属第一医院动物伦理委员会审查通过。烟草烟雾暴露箱(自制),小动物有创肺功能仪(美国BUXCO公司),GEM3000血气分析仪(中国德昌科技有限公司),波长多功能酶标仪(美国Thermo公司);红枚牌香烟(1.0 mg烟碱,11 mg焦油,13 mg一氧化碳)购于广东中烟工业有限公司;大鼠IL-6酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购于美国R&D systems公司;大鼠IL-10、单核细胞趋化蛋白1(monocyte chemo-attractant protein-1,MCP-1)ELISA试剂盒购于美国eBioscience公司。
1.2 建立动物模型 选取雄性SD大鼠20只,按随机数字表法分为对照组和模型组,每组10只。模型组大鼠每日熏烟。具体流程为将模型组大鼠置于自制熏烟箱内,上、下午各熏烟一次,每次2 h,熏烟开始1 h后换气15 min(即9支烟1 h,换气15 min,再换9支烟,继续熏烟1 h)。2次熏烟之间间隔4 h(将大鼠从熏烟箱中取出)。每周熏烟6 d,共5个月。暴露期间氧浓度控制为(20.5±0.5)%,空气湿度控制为(80±5)%。同期对照组以相同条件置于上述系统中,进行正常空气暴露。熏烟结束后,将模型组大鼠和对照组大鼠置于相同的清洁环境中喂养。在全部熏烟处理结束后次日,检测大鼠肺功能,取材进行进一步分析。
1.3 鼠肺功能的测定 参照人的COPD诊断方法及诊断标准,并结合文献,对熏烟大鼠进行肺功能测定是诊断大鼠COPD的唯一可行、可信的金标准。使用大鼠肺功能仪(美国BUXCO公司PFT系统)测定肺功能。即应用3%苯戊巴比妥钠(3 ml/kg体质量)麻醉大鼠后,于颈部甲状腺处切开气管,插入气管插管,深度适当,放入体描箱,连接大动物肺功能仪并进行机械通气。实验前,将仪器参数设定为:呼吸机的压力为±20 cm H2O(1 cm H2O=0.098 kPa),吸气气流流速为4 ml/s、慢速呼气气流流速为2 ml/s,吸气与呼气最大压力为±50 cm H2O,呼吸频率为60次/min。待大鼠与呼吸机完全协调、各参数变化趋于稳定后,开始测定肺功能,同时记录吸气阻力、肺总量(total lung capacity,TLC)、功能残气量(functional residual capacity,FRC)、肺静态顺应性(Chord Compliance,Cchord)、FVC、50毫秒用力呼气量(forced expiratory volume in 50 ms,FEV50)等指标。
1.4 动脉血气参数检测 使用肝素钠处理过的1 ml注射器插入大鼠腹主动脉取血0.5 ml,通过GEM3000血气分析仪器分析迅速检测动脉血参数:PaCO2、PaO2、 红 细 胞 压 积(hematocrit,HCT)、 乳 酸、SaO2及 总 血 红 蛋 白(total hemoglobin count,THbc)。
1.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)相关炎症指标测定 使用5 ml生理盐水灌洗大鼠单侧侧肺组织的肺泡,离心后BALF的上清液,使用IL-6(R6000B,美国R&D systems公司)和MCP-1试剂盒(KRC1012,美国eBioscience公司)及IL-10(BMS629FIVE,美国eBioscience公司)ELISA试剂盒检测。同时收集BALF底部的细胞,经Giemsa染色,中性树脂封片后在光学显微镜上进行细胞分类计数,高倍视野下计数200个细胞,统计其中巨噬细胞、中性粒细胞和淋巴细胞的百分比。
1.6 肺组织、肝脏、脾、胃、小肠病理学观察大鼠肺组织、肝脏、脾、胃、小肠在10%中性甲醛溶液中固定24 h,经PBS和双蒸水漂洗干净后,经梯度乙醇脱水,二甲苯透明,石蜡包埋,常规切片(厚度4μm)和HE染色后,封片镜检。
1.7 统计学分析 使用SPSS 13.0统计学软件进行数据分析,所有数据用表示。对照组和模型组样本之间差异性比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况观察 模型组大鼠初次烟草烟雾暴露结束时即出现倦怠,饮水增加,易激惹,随建模时间延长,大鼠行动逐渐迟缓,皮毛失去光泽,进食减少,大小便量及次数增加;建模结束时,模型组大鼠皮毛粗糙发黄,体型偏瘦,呼吸频率较正常大鼠为快,对照组大鼠行动敏捷,皮毛光滑,膘肥体壮。建模前,模型组的平均体质量为(275.63±4.20)g,与对照组的(269±7.68)g相比,差异无统计学意义(t=0.76,P>0.05);建模5个月后,模型组平均体质量为(457.12±20.75)g,显著低于对照组的(610.62±26.38)g,差异有统计学意义(t=4.57,P<0.01)。
2.2 大鼠肺功能比较 模型组大鼠FEV50/FVC显著低于对照组,差异有统计学意义(t=6.44,P<0.01),而FRC、TLC和Cchord显著高于对照组,差异有统计学意义(t=6.52、7.29、2.83,P值均<0.05)。见表1。
表1 对照组与模型组大鼠肺功能指标比较()

表1 对照组与模型组大鼠肺功能指标比较()
注:FRC为功能残气量;TLC为肺总量;Cchord为静态肺顺应性;FEV 50/FVC为50毫秒用力呼气量/用力肺活量
组别 鼠数FRC(ml) TLC(ml)Cchord(ml)FEV50/FVC对照组10 4.23±0.06 18.61±0.22 1.06±0.04 0.48±0.01模型组10 5.11±0.12 22.34±0.50 1.23±0.04 0.37±0.01 t值 6.52 7.29 2.83 6.43 P值 <0.01 <0.01 <0.05 <0.01
2.3 动脉血气分析 与对照组比较,模型组大鼠的PaO2、PaCO2和Sa O2差异无统计学意义(t=2.27、1.11、0.88,P值均>0.05);而乳酸、HCT和THbc差异有统计学意义(t=2.56、4.19、3.69,P值均<0.05)。见表2。
2.4 大鼠肺部炎症指标比较 与对照组比较,模型组大鼠的BALF的总细胞数、中性粒细胞、巨噬细胞、淋巴细胞数量显著增多,差异有统计学意义(t=12.57、17.83、5.93、5.94,P值均<0.01),BALF促炎介质IL-6、MCP-1显著增加,而抗炎介质IL-10显著减少,差异均有统计学意义(t=11.49、3.24、4.54,P值均<0.01)。见表3。
2.5 组织病理学改变 对照组大鼠肺组织肺泡结构完整连续,未见明显炎症细胞浸润。模型组大鼠肺泡结构紊乱,肺泡壁变薄甚至断裂,肺泡腔扩大,部分肺泡融合成肺大疱,呈现典型的肺气肿病理改变(图1)。与正常对照组相比,模型组大鼠消化道的病理改变为:肝脏肝小叶中央小静脉稍充血,伴炎症细胞浸润,肝细胞轻度水肿(图2)、脾脏出现少量淤血(图3)、胃黏膜出现轻度糜烂(图4)、小肠黏膜萎缩伴少量炎症细胞浸润(图5)。
表2 对照组与模型组大鼠动脉血气指标比较()
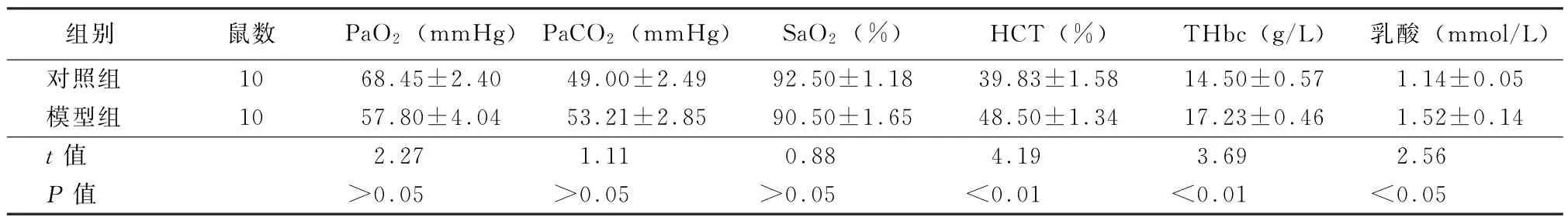
表2 对照组与模型组大鼠动脉血气指标比较()
注:1 mm Hg=0.133 kPa;HCT为红细胞压积;THbc为总血红蛋白
组别 鼠数 PaO2(mm Hg)PaCO2(mm Hg)SaO2(%) HCT(%) THbc(g/L)乳酸(mmol/L)对照组 10 68.45±2.40 49.00±2.49 92.50±1.18 39.83±1.58 14.50±0.57 1.14±0.05模型组 10 57.80±4.04 53.21±2.85 90.50±1.65 48.50±1.34 17.23±0.46 1.52±0.14 t值 2.27 1.11 0.88 4.19 3.69 2.56 P值 >0.05 >0.05 >0.05 <0.01 <0.01 <0.05
表3 对照组与模型组大鼠肺部炎症指标比较()
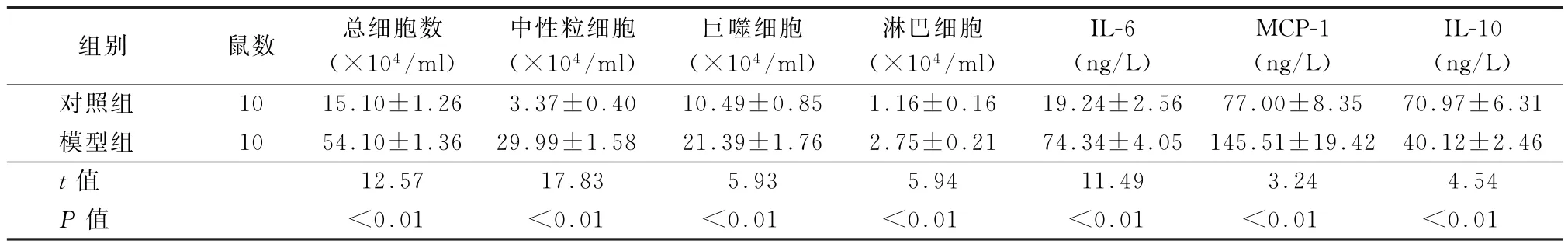
表3 对照组与模型组大鼠肺部炎症指标比较()
注:MCP-1为单核细胞趋化蛋白1
组别 鼠数 总细胞数(×104/ml)中性粒细胞(×104/ml)巨噬细胞(×104/ml)淋巴细胞(×104/ml)IL-6(ng/L)MCP-1(ng/L)IL-10(ng/L)对照组 10 15.10±1.26 3.37±0.40 10.49±0.85 1.16±0.16 19.24±2.56 77.00±8.35 70.97±6.31模型组 10 54.10±1.36 29.99±1.58 21.39±1.76 2.75±0.21 74.34±4.05 145.51±19.42 40.12±2.46 t值 12.57 17.83 5.93 5.94 11.49 3.24 4.54 P值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01
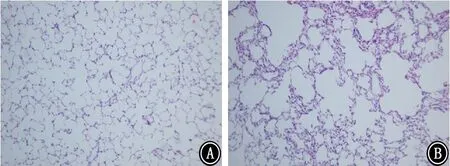
图1 2组大鼠肺组织病理学表现 HE ×100 A:对照组;B:模型组
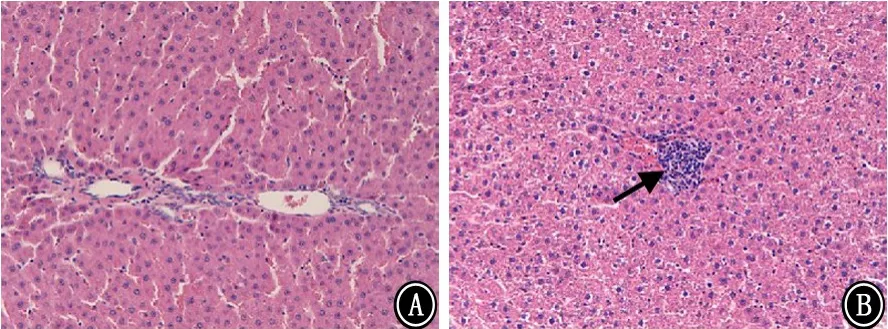
图2 2组大鼠肝脏病理学表现 HE ×200 A:对照组;B:模型组

图3 2组大鼠脾脏病理学表现 HE ×200 A:对照组;B:模型组

图4 2组大鼠胃病理学表现 HE ×200 A:对照组;B:模型组

图5 2组大鼠小肠病理学表现 HE ×200 A:对照组;B:模型组
3 讨论
COPD是一种全身性疾病,存在肌肉萎缩和体质量下降的营养不良等肺外表现[10],且患者体质量指数不但与炎症因子水平有相关性[11],且与生活质量[12]和预后相关[13],改善患者营养状态、提高体质量是COPD的治疗目标之一。但改善COPD营养不良的方法及其效果均有限,目前主要通过提供高热量、低碳水化合物和适当维生素等补充营养[14-16],饭前避免活动诱发呼吸困难和进食期间吸氧治疗,可以预防呼吸困难诱发内脏血管收缩减少血流供应和进食过程低氧血症所致的消化吸收能力下降[17-18],但饭后腹胀、甚至腹泻等消化吸收能力障碍影响了患者对摄取营养的高需求。既往对COPD消化道结构改变的研究缺乏,本研究组通过建立COPD模型,探讨影响COPD患者消化吸收功能的消化道病理改变。
本实验采用单纯烟草烟雾暴露的方法来建立COPD大鼠模型。结果显示模型组肺组织肺泡腔扩大、破裂或形成大疱,可见大量炎症细胞浸润;模型组大鼠FEV50/FVC下降、FRC和TLC增加。提示模型组大鼠的病理和肺功能均支持COPD大鼠模型造模成功。其他包括血气分析、HCT、THbc、乳酸、BALF总细胞数及其分类计数、BALF促炎介质和抗炎介质也支持造模成功。
造模前,模型组的平均体质量与对照组的相似,但建模5个月后,模型组平均体质量显著低于对照组的平均体质量(P<0.05),提示该COPD模型也满足体质量减轻营养不良的肺外表现。因此,模型大鼠的整体外观和消化道病理改变可以作为了解COPD营养和消化道消化吸收功能状态的模型。
模型组大鼠初次暴露烟草烟雾后,出现倦怠、饮水增加、易激惹,随暴露烟草时间增多,行动迟缓、皮毛失去光泽、进食减少、大小便量及次数增加;完成建模时,皮毛粗糙发黄,体型偏瘦,呼吸频率较正常大鼠为快,而对照组大鼠行动敏捷,皮毛光滑,膘肥体壮。除体质量减轻外,大鼠COPD模型也有营养不良的外观肤色,进食减少和大便次数增加提示消化吸收功能的下降。大鼠模型与对照组比较,两者的PaO2差异无统计学意义,而BALF总细胞数及其分类计数、BALF促炎介质和抗炎介质的炎症指标差异均有统计学意义,提示这种大鼠COPD模型的消化吸收功能障碍与炎症水平有关,与低氧血症无关。
COPD是全身性炎症性疾病,消化道也存在炎症反应。本研究结果显示,大鼠COPD模型的消化道中,与消化吸收功能有关的肝脏、脾脏、胃、小肠均存在炎症相关性的病理改变。其中,模型组大鼠肝脏肝小叶中央静脉稍充血伴炎症细胞浸润、肝细胞轻度水肿;脾脏存在淤血改变;胃黏膜出现轻度糜烂等情况;小肠黏膜萎缩且伴有少量炎症细胞浸润。提示大鼠COPD模型的消化吸收功能障碍与消化道的炎症病理改变有关。
肝脏是人体重要的消化器官,肝脏疾病通常与非特异性临床症状相关,包括厌食、呕吐、腹泻和体质量减轻等[19];大鼠脾脏出现淤血改变,持续淤血可引起局部脾脏组织的萎缩、变性、坏死,影响脾脏的消化功能[20];人体摄取蛋白质、脂肪、维生素等营养物质都需要首先经过胃的消化,才可以被吸收[21-22],胃黏膜出现炎症细胞浸润和糜烂将直接损伤胃黏膜的壁细胞及主细胞,引起消化营养物质的胃酸和胃蛋白酶等内分泌物质的分泌减少,导致食物消化障碍,引起营养不良;小肠是人体几乎所有营养物质的主要吸收场所,小肠黏膜萎缩且炎症细胞浸润将影响吸收功能,导致大便次数增多和营养不良。
综上所述,长期烟草烟雾暴露可导致大鼠肺部慢性炎症、肺气肿和肺功能下降的COPD肺部表现以及体质量降低的肺外表现,也引起肝脏、脾脏、胃和小肠等与消化吸收功能有关的消化道炎症反应,我们推测COPD的营养不良与消化道炎症所致病理改变有关,为了改善COPD的营养状态,不但要提供合适的营养物质,更重要的是防治消化道的炎症反应。这都需要进一步的探讨。
利益冲突所有作者均声明不存在利益冲突
