基于Nrf2-ARE信号通路探析己酮可可碱对癫痫大鼠脑内氧化应激的影响
2020-03-28孙光涛戚询中邹春颖王克健黄作义
孙光涛,戚询中,邹春颖,王克健,黄作义
0 引 言
癫痫属于慢性发作性神经系统功能障碍性病症,主要由于神经元突然、无序、过度放电导致反复发作的大脑功能障碍,即以脑正常电活动自发性周期性破坏导致病情反复发作为主要特征[1]。据国外数据统计,全球每年约有5000万癫痫患者被明确诊断,我国约占18%,其已成为国内继脑卒中后的第二大中枢神经系统病症[2]。现阶段氧化应激已明确为癫痫发生及持续发作的主要机制之一;而抗氧化剂被认为是降低结构损害、减少癫痫发作次数、缓解认知退化的重要途径[3]。核因子E2相关因子2(nuclear factor e2-related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)信号通路属于内源性抗氧化应答机制信号通路的一种,特别是Nrf2为细胞调节氧化应激反应的核心因子[4]。该因子已被证实可调节多种抗氧化酶的转录而控制脑损伤引起的氧化应激反应,继而发挥保护大脑及认知功能的作用[5]。作为强抗氧化剂,己酮可可碱(pentoxifylline,PTX)在近期国内外实验中皆已论证可缓解大鼠脑组织氧化损伤[6-7];但其对癫痫大鼠的抗氧化作用及是否影响Nrf2-ARE信号通路尚未确定。本研究基于Nrf2-ARE信号通路探析PTX对癫痫大鼠脑内氧化应激的影响。
1 材料与方法
1.1 实验动物实验纳入健康、成年雄性Wistar大鼠36只,体重(250±20)g,由佳木斯大学实验动物中心提供(批准号:20160627001)。获得实验大鼠后,将其置于动物饲养室内[温度(23±2)℃,湿度控制50%~60%,保持通风换气、每12小时黑白循环]适应饲养4 d,满足食物、水供给。实验符合动物实验伦理的相关规定。
1.2实验材料丙二醛(malondialdehyde,MDA)检测试剂盒及谷胱甘肽(glutathione,GSH)、超氧化物岐化酶(super oxide dismutase,SOD)酶活试剂盒产自南京建成公司,兔抗大鼠Nrf2多克隆抗体、HO-1多克隆抗体、NQO-1多克隆抗体产自美国Abcom公司,小鼠抗大鼠H3单克隆抗体、抗β-actin单克隆抗体购自美国Santa Cruz公司,辣根酶标记羊抗小鼠IgG购自北京中山公司。盒超净工作台来自江苏苏净公司,台式离心机来自北京雷勃尔公司,Odyssey红外成像系统来自美国Gene公司。
1.3分组、建模及处理大鼠按照完全随机法被分为3组,即空白对照组、EP对照组、PTX组,各12只。其中空白对照组腹腔注射等渗盐水,EP对照组、PTX组以氯化锂-匹罗卡品诱发癫痫发作,参考文献[8]PTX给药方式与使用剂量操作。首先供给氯化锂(127 mg/kg)腹腔注射,20 h后给予匹罗卡品(15 mg/kg)皮下注射;另PTX组在注射匹罗卡品前30 min提供腹腔注射PTX(60 mg/kg)。
1.4一般情况观察各组大鼠给药后即刻观察其行为学变化,主要涉及缩瞳、流涎、立毛、腹泻、肌阵挛与震颤等外周胆碱能体征,记录癫痫发作率、发作潜伏期,并评估癫痫发作等级,分级标准依据Racine评分标准:无任何发作为0级;凝视、须动,有口、鼻或面肌阵挛为1级;1级基础上有点头或频繁抖动为2级;2级基础上四肢局限性阵挛,或伴后肢站立的全身强直性发作为3级;有站立并跌倒的全身强直阵挛发作为4级[9]。
1.5氧化应激指标及Western blot检测各组大鼠给药后24 h断头处死,迅速取脑,在显微镜辅助下于冰板上小心分离黑质、海马于-80 ℃冰箱冻存。左侧组织进行氧化应激指标检测,右侧组织进行Western blot检测。氧化应激指标测定:黑质、海马组织称重、剪碎后置入匀浆器,组织重量、冷等渗盐水体积按1∶9比例配置10%的组织匀浆,以分光光度法、参照说明书检测组织中氧化应激产物MDA含量和抗氧化酶GSH、SOD活性。Western blot检测:将黑质、海马组织剪碎,加入裂解缓冲液,研磨后破碎处理,冰浴静置1 h,离心取上清分装。然后进行蛋白质定量(Bradford法)、电泳、常规转膜操作。完成转膜后将PVDF膜置于TTBS中浸泡5 min,5%脱脂奶粉的封闭液处理2 h,随后以5%脱脂奶粉稀释抗体兔抗大鼠Nrf2多克隆抗体(1∶300)、兔抗大鼠HO-1多克隆抗体(1∶300)、兔抗大鼠NQO-1多克隆抗体(1∶500)、小鼠抗大鼠H3单克隆抗体(1∶2000)和小鼠抗β-actin单克隆抗体(1∶6000),4 ℃过夜孵育PVDF膜,反复冲洗,置于含辣根过氧化物酶标记的羊抗兔IgG(1∶6000)抗体中室温孵育2 h。加ECL发光试剂盒反应,以红外荧光扫描成像系统成像,将发光后的条带以Image J软件进行分析,β-actin设为内参,记录发光条带的相对吸光度比值。

2 结 果
2.1 癫痫一般行为学观察结果比较空白对照组大鼠未见异常反应;EP对照组大鼠逐渐表现出外周胆碱能症状,主要有缩瞳、血泪、流涎、竖毛、腹泻、刻板动作,癫痫发作率达到83.33%;而PTX组大鼠癫痫发作率、发作等级明显低于EP对照组,且发作潜伏期明显较EP对照组延长(P<0.05)。见表1。
2.2黑质、海马组织氧化应激指标含量比较与空白对照组相比,EP对照组大鼠黑质、海马组织MDA含量明显高,GSH、SOD活性显著低(P<0.05);而相比EP对照组,PTX组黑质、海马组织MDA含量明显降低,GSH、SOD活性明显增加(P<0.05),与空白对照组比较差异有统计学意义(P<0.05)。见表2、表3。
表 1 各组大鼠癫痫一般行为学观察结果比较
Table 1 Comparison of general behavioral observed results of EP rats in each group

组别n癫痫发作率[n(%)]癫痫发作潜伏期(x±s,min)癫痫发作等级(x±s,级)空白对照组120(0)--EP对照组1210(83.33)16.15±3.003.09±0.58PTX组124(33.33)∗25.81±5.16∗2.14±0.40∗
与EP对照组比较,*P<0.05
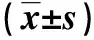
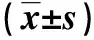
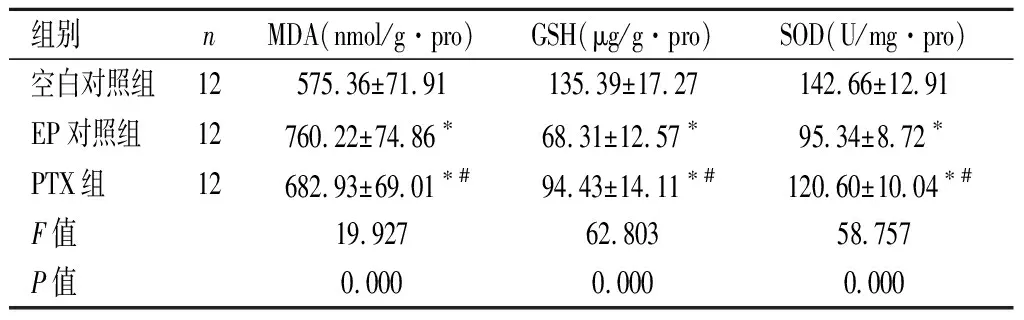
组别nMDA(nmol/g·pro)GSH(μg/g·pro)SOD(U/mg·pro)空白对照组12575.36±71.91135.39±17.27142.66±12.91EP对照组12760.22±74.86∗68.31±12.57∗95.34±8.72∗PTX组12682.93±69.01∗#94.43±14.11∗#120.60±10.04∗#F值19.92762.80358.757P值0.0000.0000.000
与空白对照组比较,*P<0.05;与EP对照组比较,#P<0.05
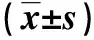
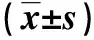
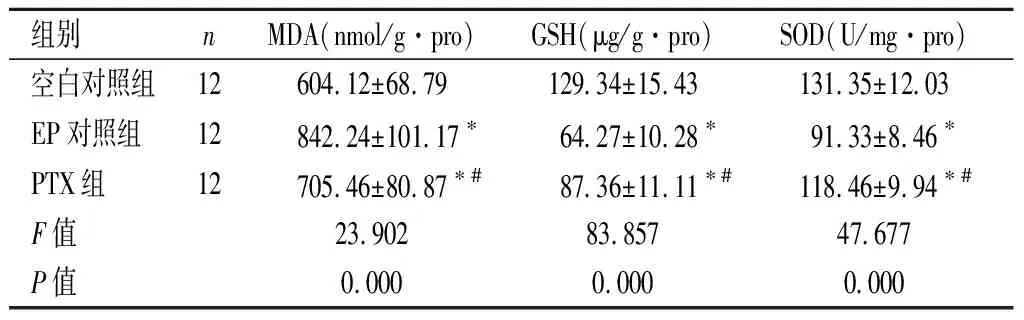
组别nMDA(nmol/g·pro)GSH(μg/g·pro)SOD(U/mg·pro)空白对照组12604.12±68.79129.34±15.43131.35±12.03EP对照组12842.24±101.17∗64.27±10.28∗91.33±8.46∗PTX组12705.46±80.87∗#87.36±11.11∗#118.46±9.94∗#F值23.90283.85747.677P值0.0000.0000.000
与空白对照组比较,*P<0.05;与EP对照组比较,#P<0.05
2.3黑质、海马组织Nrf2-ARE信号通路相关蛋白表达比较Western blot检测结果显示,与空白对照组相比,EP对照组大鼠黑质组织、海马Nrf2、HO-1蛋白表达明显降低(P<0.05),NQO-1未见显著改变(P>0.05);而相比EP对照组,PTX组黑质组织、海马Nrf2、HO-1及NQO-1蛋白表达明显增加(P<0.05),且海马Nrf2、HO-1及NQO-1蛋白表达恢复至空白对照组水平(P>0.05),黑质组织Nrf2、HO-1及NQO-1蛋白表达明显高于空白对照组水平(P<0.05)。见表4、表5。
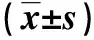
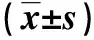
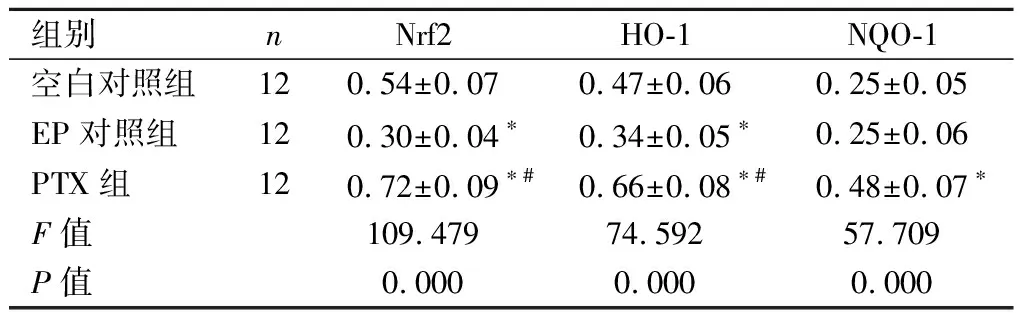
组别nNrf2HO-1NQO-1空白对照组120.54±0.070.47±0.060.25±0.05EP对照组120.30±0.04∗0.34±0.05∗0.25±0.06PTX组120.72±0.09∗#0.66±0.08∗#0.48±0.07∗F值109.47974.59257.709P值0.0000.0000.000
与空白对照组比较,*P<0.05;与EP对照组比较,#P<0.05
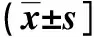
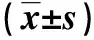

组别nNrf2HO-1NQO-1空白对照组120.33±0.040.45±0.060.70±0.06EP对照组120.21±0.03∗0.31±0.05∗0.68±0.07PTX组120.34±0.06#0.48±0.08#0.78±0.11#F值34.88923.7124.893P值0.0000.0000.014
与空白对照组比较,*P<0.05;与EP对照组比较,#P<0.05
3 讨 论
癫痫疾病发作通常可视为神经元的过度兴奋与大量自由基积累的环节。有文献指出,机体产生过量的活性氧或活性氧清除能力下降均可使自由基大量累积,加之细胞内外的自由基可通过多途径诱导神经系统产生退行性变,最终诱发氧化应激[8]。既往研究已证实包括癫痫在内神经系统病症会出现大脑氧化损伤,并削弱其抗氧化能力,且由于大脑对氧化损伤的易感性较高,更揭示了氧化应激在此类病症病理中的重要作用[10]。癫痫动物模型是分析抗癫痫药物和探析其发病机制的重要环节,本研究以氯化锂-匹罗卡品诱发癫痫大鼠模型,表现有癫痫发作、黑质与海马区神经元损伤等,具备同与人类叶颞叶癫痫类似的临床、病理表现,被视为癫痫建模的首选[11]。本研究显示给药后空白对照组大鼠未见异常表现,EP对照组大鼠逐渐表现出外周胆碱能症状,癫痫发作率达到83.33%;而PTX组大鼠癫痫发作率、发作等级明显低于EP对照组,且发作潜伏期明显延长,这进一步表明上述癫痫建模方法较为理想,且证实PTX可缓解癫痫发作,延长癫痫发作潜伏期,即有抗癫痫作用。
PTX既属于非特异性磷酸酶二酯酶抑制剂,也属于弱腺苷受体拮抗剂,具有强抗氧化作用,可迅速经过血-脑屏障,发挥抗氧化作用及调控脑内诸多神经递质释放的作用[12]。基于此药的血液流变学功效,起初用于呼吸与血管系统疾病的治疗,近几年临床不断证实其具有一定的神经保护作用,对于脑梗死、缺血、创伤等导致的神经行为学障碍及增强海马损伤大鼠学习记忆能力有突出作用[13]。也有实验发现PTX可显著缓解癫痫发作早期大鼠脑组织氧化损伤[14]。本研究中,EP对照组大鼠黑质、海马组织MDA含量明显较空白对照组高,GSH、SOD活性显著低,而PTX组黑质、海马组织MDA含量明显较相比EP对照组降低,GSH、SOD活性明显增加。其中MDA为脂质过氧化的最终物质,可引起弥漫性细胞损伤[15];GSH为最主要的内源性抗氧化剂,SOD是主要的抗氧化酶之一,两者皆具有清除过量自由基、避免细胞氧化损害的作用;机体氧化(以MDA等为代表)与抗氧化(以GSH、SOD等为代表)系统之间的平衡状态被打破是氧化应激的典型特征[16]。由此可见,PTX的抗癫痫作用与其改善癫痫发作大鼠脑内氧化应激状态密切相关。康云霄等[17]的实验发现,癫痫发作时的大鼠脑组织MDA含量增多,GSH、SOD活性减弱,可显著损伤神经元的结构和功能,而PTX有助于改善这一状态,与本文结果类似。Karatay等[18]的实验也证实PTX可通过有效调节炎症、减轻氧化应激来减轻结肠炎大鼠粘膜损伤。Ozturk等[19]实验亦证实了PTX的抗氧化作用。但本研究显示其改善氧化应激状态的作用有限,与空白对照组大鼠状态仍有显著差异,可能与PTX给药方式、给药剂量或其本身的抗氧化能力有关,具体机制尚需进一步明确。
Nrf2/ARE信号通路属于机体抵抗内界与外界氧化及化学刺激的防御性转导通路,其核心分子含有Nrf2、ARE与Keap1,其中Nrf2活化能明显抑制炎症介质产生,亦是细胞调节氧化应激反应环节中的关键分子,一旦细胞暴露于氧化应激状态,Nrf2从Keap1分离且移至细胞核同ARE结合,并生成Nrf2-ARE复合体,此复合体能够激活诸多兼强化HO-1、NQO-1等细胞抗氧化能力的酶[20-21]。本研究Western blot检测结果显示,与空白对照组相比,EP对照组大鼠黑质组织、海马Nrf2、HO-1蛋白表达明显降低,而相比EP对照组,PTX组黑质组织、海马Nrf2、HO-1及NQO-1蛋白表达明显增加,且海马Nrf2、HO-1及NQO-1蛋白表达恢复至空白对照组水平,黑质组织表达明显高于空白对照组水平,表明PTX可激活Nrf2-ARE信号通路,且作用强烈,这可能是PTX抑制癫痫发作、改善氧化应激状态的重要机制。冯永浩等[22]的实验发现,百里醌对糖尿病大鼠模型脑内强氧化应激状态的改善主要通过调节Nrf2/ARE信号通路相关蛋白表达实现;吴可等[23]的报道证实Nrf2-ARE信号通路异常在癫痫发作中有重要意义,而基于Nrf2-ARE通路增加HO-1、NQO1蛋白表达,可起到抗癫痫作用;Kang等[24]的报道表明鼻内PTX给药治疗癫痫持续状态大鼠,可通过激活海马Nrf2-ARE通路调节多巴胺能系统及减轻氧化损伤,从而改善神经元功能及控制癫痫发作。以上报道均从不同角度支持了本研究PTX可特异性激活Nrf2-ARE信号通路继而减轻氧化应激反应的结论。但本实验给药剂量参考以往文献实验,其是否为干预癫痫大鼠的最佳剂量或干预效果是否呈剂量依赖性尚有待证实。总之基予本研究结果,认为PTX有望成为治疗癫痫的新选择,而Nrf2-ARE信号通路或可成为研究癫痫发病机制及防治策略的新方向。
