MicroRNA-34a调控c-Met表达对肝癌细胞的增殖及迁移和侵袭的影响
2020-03-28王静静季国忠
蒋 伟,李 涛,王静静,施 晓,季国忠
0 引 言
原发性肝癌是全球第六大常见恶性肿瘤,也是引起癌症相关死亡的第三大原因[1]。目前针对原发性肝癌首选的治疗方法仍是外科手术切除,但由于肝癌早期症状不明显,许多患者在就诊已处于中晚期,导致外科手术治疗的效果不佳,术后2年复发率高达50%,5年生存率仅10%左右[2]。索拉非尼是首个批准上市的肝癌分子靶向药,仅能延长患者2个月生存期,且由于其多靶向性,常引起严重的全身性不良反应[3]。因此,寻求新的肝癌治疗策略并深入探究其分子机制意义重大。
MicroRNA(miRNA)是一种单链非蛋白编码RNA,包含大约22个核苷酸。miRNA可以通过与靶基因mRNA的3′UTR结合抑制基因表达,从而抑制RNA的翻译或促进其降解。既往研究表明,miRNA在细胞的生长、增殖和肿瘤发生等生理学或病理学过程中发挥作用[4-5]。miR-34a是miR34家族中的一员,最近研究证实miR-34a在肝癌中表达下降[6-7]。然而,miR-34a在原发性肝癌中的作用及其相关机制仍有待探究。因此本研究旨在探讨miR-34a对肝癌增殖、迁移和侵袭能力的影响。
1 材料与方法
1.1 材料人肝细胞癌细胞株HepG2、Huh-7购自上海生物化学与细胞生物学研究所,人肾上皮细胞系HEK393T细胞来自本课题组保存;细胞用DMEM培养基、胎牛血清、抗生素和胰蛋白酶均购自Gibco公司;miR-34a mimics和mimics control由上海吉玛制药技术有限公司设计合成;miR-34a和c-Met引物、野生型c-Met报告基因(pGL3-c-Met)和突变型c-Met报告基因(pGL3-c-Met-mut)均由南京金斯瑞生物科技有限公司合成;Lipofectamine 2000购自Invitrogen公司;miRNA逆转录试剂盒miRNA 1st Strand cDNA Synthesis Kit和miRNA qPCR试剂盒miRNA Universal SYBR qPCR Master Mix均购自南京诺维赞生物科技有限公司;CCK-8试剂盒购自同仁化学研究所。
1.2方法
1.2.1细胞培养和转染人肝细胞癌细胞株HepG2和Huh-7细胞均以含10%胎牛血清和1%青霉素/链霉素及含有1%双抗的DMEM完全培养基培养,培养条件设置为37 ℃、5%CO2。
按照1×105个的细胞/孔的密度分别将HepG2和Huh-7接种至12孔板中, 待细胞融合度达75%后进行细胞转染。分别将6 μL miR-34a过表达和过表达对照质粒加至300 μL Opti-MEM培养基中,将6 μL 脂质体转染试剂2000加至300 μL Opti-MEM 培养基中。将上述2种混合物混合后置于37 ℃ 孵育30 min,然后分别加入细胞孵育,6 h后更换培养基。分组:过表达组(转染过表达质粒miR-34a mimics)、过表达对照组(转染过表达对照质粒miR-34a mimics control)和空白组(未转染质粒)。采用实时荧光定量PCR法检测各组的miR-34a水平以评价转染效率。
1.2.2RNA提取和qPCR使用Trizol试剂提取各组细胞总RNA, 采用One Step PrimeScript cDNA Synthesis Kit合成cDNA;采用TaqMan MicroRNA Reverse Transcription Kit测定miR-34a的表达水平。采用Eppendorf Mastercycler ep realplex平台进行QPCR, miR-34a的表达以U6为内参,定量结果采用△Ct表示。miR34a上游引物:5'CGCGTGGCAGTGTCTTAGCT 3';miR34a下游引物:5'AGTGCAGGGTCCGAGGTATT 3'。
1.2.3双荧光素酶报告基因实验通过金斯瑞公司合成野生型c-Met报告基因(pGL3-c-Met)和突变型c-Met报告基因(pGL3-c-Met-mut)。将HEK 293T细胞按照每孔1×106的密度接种至24孔板中, 待孔内细胞密度达80%左右时,将荧光素酶报告载体与miR-34a 过表达或过表达对照miRNA共转染至HEK 293T细胞内,利用双荧光素酶报告基因检测系统(Promega, USA)进行荧光素酶检测,计算相对荧光强度。
1.2.4细胞增殖实验miR-34a过表达或过表达对照质粒转染细胞48 h后,培养基重悬细胞,并将细胞稀释至1×103个/100 μL,将各组细胞按照200 μL/孔接种于96孔板中,每组设置5个复孔。在细胞贴壁后的0、24、48、72和96 h,分别向每孔分加入20 μL CCK-8溶液,并置于37 ℃培养箱避光孵育3 h,然后采用酶标仪测定490 nm波长下各孔的吸光值(A)。
1.2.5克隆形成实验miR-34a过表达或过表达对照质粒转染细胞48 h后,将各组细胞以1×103个/孔接种于6孔板中并置于37 ℃ 培养箱培养,每组设置3个复孔。2周后待克隆形成吸去培养基,PBS轻柔清洗3次,吸取2 mL 4%多聚甲醛固定细胞20 min;然后吸净多聚甲醛,PBS清洗3次后用0.1%结晶紫染色20 min,PBS清洗3次后计数每孔形成的克隆斑。
1.2.6细胞迁移和侵袭实验miR-34a过表达或过表达对照质粒转染细胞48 h后,用无血清DMEM培养基重悬细胞。对于细胞迁移实验,将各组细胞按照2.5×104个/孔接种于transwell小室上层,将700 μL含有20 %胎牛血清的DMEM培养基加入小室下层,每组设置3个复孔;对于细胞侵袭实验,首先将matrigel胶冰上液化,按照matrigel胶:DMEM培养基为1∶3的比例混合,然后将混合液以25 μL/孔加入transwell小室上层并让其自然铺开,待matrigel胶凝固后再各组细胞按照2.5×104个/孔接种于transwell小室上层;将700 μL含有20 %胎牛血清的DMEM培养基加入小室下层,每组设置3个复孔。37 ℃培养箱培养48 h后,去除小室内的细胞并将小室置于甲醇中固定20 min,然后进行结晶紫染色,置于倒置显微镜下随机选取5个视野进行细胞计数。
1.2.7裸鼠肝癌移植瘤模型的构建DMEM培养基重悬HepG2细胞并稀释至1×107/mL,取4~6周龄雄性裸鼠18只,购自于南京医科大学动物实验中心,实验动物使用许可证号:SYXK(苏)2016-0015。标准普通级喂养。向每只裸鼠左侧腋下注射100 μL细胞悬液,并置于SPF级环境喂养。7 d后将成瘤裸鼠随机分为2组:miR-34a组(注射30 μL miR-34a mimics+脂质体转染试剂2000)和对照组(注射30 μL miR-34a mimics control+脂质体转染试剂2000),每组6只。每2天注射1次。治疗3次后处死裸鼠,取肿瘤组织进行称重和肿瘤体积测量。肿瘤组织的体积计算公式如下:
V=1/2(长×宽2)
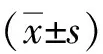
2 结 果
2.1miR-34a 过表达对HepG2和Huh-7细胞miR-34a水平的影响过表达组HepG2、Huh-7细胞miR-34a表达水平显著高于过表达对照组、空白组(P<0.01),见表1。
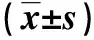
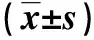

组别miR-34a表达量HepG2细胞Huh-7细胞过表达对照组1.007±0.105∗1.161±0.035∗空白组1.002±0.074∗1.158±0.050∗过表达组2.727±0.1734.042±0.104
与过表达组比较, *P<0.01
2.2miR-34a对HepG2和Huh-7细胞增殖的影响过表达组HepG2及Huh-7细胞中48、72、96 h细胞增殖活力较过表达对照组细胞显著降低 (P<0.01)。图1示过表达组肝癌细胞株miR-34a过表达后,过膜细胞明显减少。提示过表达miR-34a可以抑制HCC细胞HepG2和Huh-7的增殖。
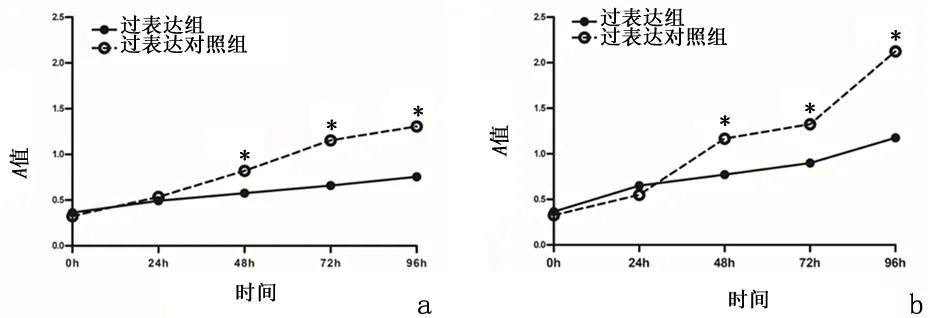
a: HepG2细胞;b: Huh-7细胞
与过表达组比较,*P<0.01
图 1 过表达miR-34a对肝癌细胞HepG2和Huh-7增殖的影响
Figure1miR-34aexpressionineachgroupofHepG2andHuh-7cells
2.3miR-34a对HepG2和Huh-7细胞克隆形成能力的影响克隆形成实验结果显示, 过表达组HepG2、Huh-7细胞的克隆形成数[(28.00±4.36)个/视野、(51.33±9.56)个/视野]较过表达对照组[(52±5.81)个/视野、(97.33±6.74)个/视野]显著降低(P<0.05)。提示过表达miR-34a明显减弱HepG2细胞和Huh-7细胞的克隆形成能力。
2.4miR-34a对HepG2和Huh-7细胞迁移和侵袭能力的影响迁移实验中,过表达组HepG2、Huh-7细胞迁移能力、侵袭能力较过表达对照组显著降低 (P<0.01)。见表2。图2、图3示过表达miR-34a后,HepG2和Huh-7细胞胶穿数量明显减少。

组 别迁能能力HepG2细胞Huh-7细胞侵袭能力HepG2细胞Huh-7细胞过表达对照组42.67±3.30248.00±7.7912.67±2.0518.67±2.05过表达组25.00±4.32∗151.67±10.21∗24.67±3.30∗55.00±9.63∗
与过表达对照组比较, *P<0.01
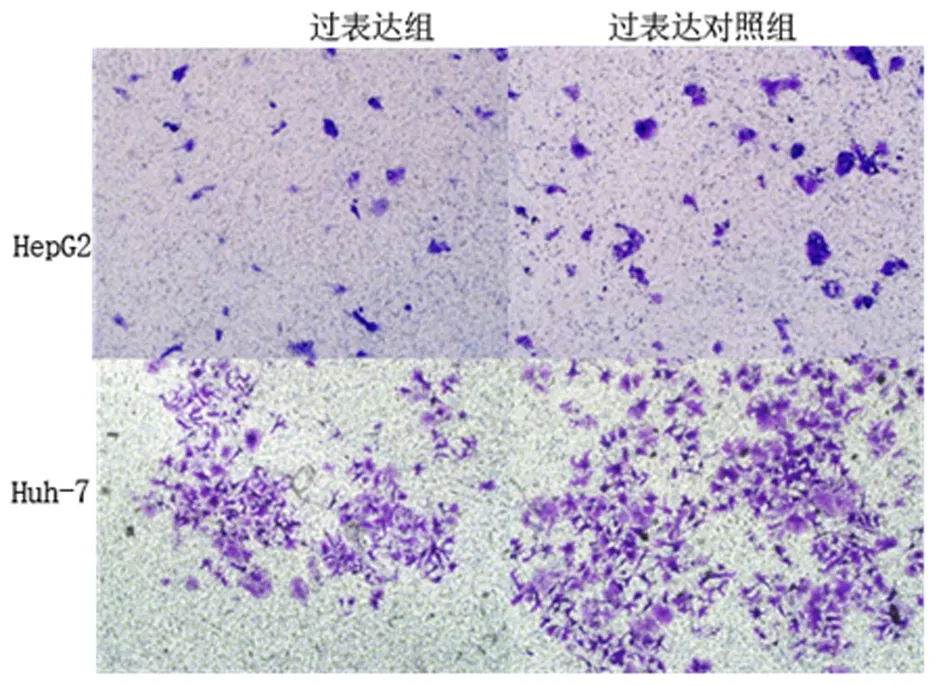
图示过表达miR-34a可以抑制HepG2和Huh-7细胞的迁移
图 2 miR-34a过表达对肝癌细胞HepG2和Huh-7的迁移能力(结晶紫染色 ×100)
Figure2OverexpressionofmiR-34amarkedlyinhibitthemigrationabilityofHCCHepG2andHuh-7cells
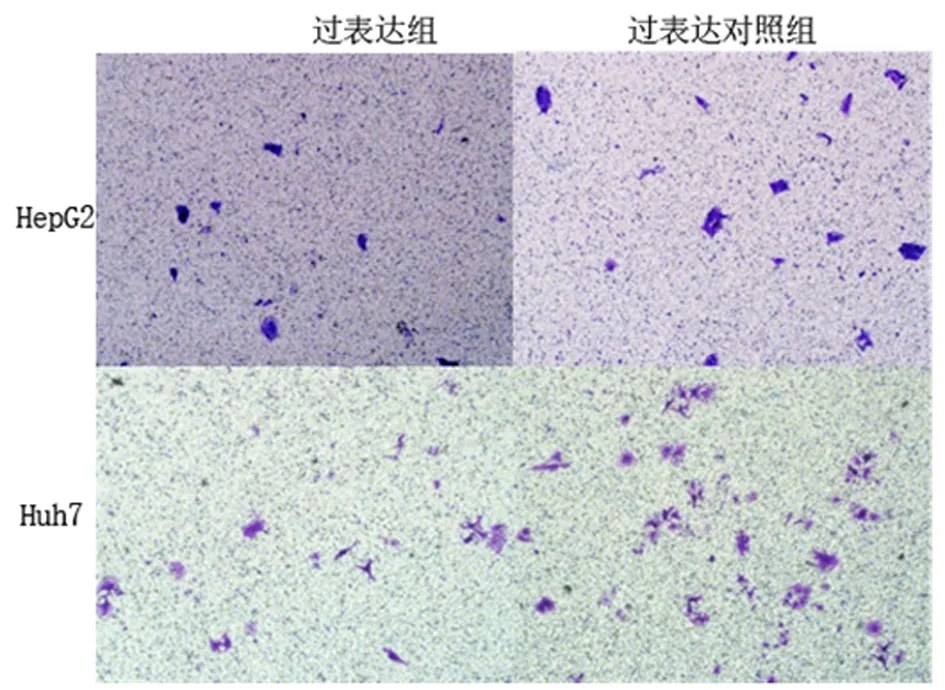
图示过表达miR-34a可以抑制HepG2和Huh-7细胞的侵袭
图 3 过表达miR-34a抑制肝癌细胞HepG2和Huh-7的侵袭能力(结晶紫染色 ×100)
Figure3OverexpressionofmiR-34amarkedlyinhibittheinvasionabilityofHCCHepG2andHuh-7cells
2.5miR-34a 对裸鼠移植瘤生长的影响成瘤14 d后,过表达组移植瘤重量显著低于过表达对照组的[(45.488±11.651)mgvs(125.408±27.107) mg,P<0.01]。过表达组肿瘤体积显著低于过表达对照组[(69.58±4.705) mm3vs(268±10.08) mm3,P<0.01]。表明过表达miR-34a可抑制HCC移植瘤的生长。
2.6肝癌中c-Met是miR-34a的靶基因TargetScan 和 miR-WALK被用来预测miR-34a的潜在靶点。预测结果表明,c-Met可能是目标基因(c-Met 3′ UTR:5′ …GUCCAAUGGUUUUUUCACUGCCU …;Has-miR-34a:3′ UGUUGGUCGAUUCUGUGACGGU;Mutated c-Met 3′ UTR:5′ …GUCCAAUGGUUUUUUACAAUUUU …)。miR-34a组pGL3-c-Met的荧光素酶活性较对照组显著升高[(0.717±0.052)vs(0.517±0.098),P<0.05]。但miR-34a组pGL3-c-Met-mut的荧光素酶活性与对照组比较差异无统计学意义(P>0.05)。结果提示miR-34a在肝癌中通过直接结合c-Met的3′UTR来调控c-Met表达。
3 讨 论
原发性肝癌是我国第4位高发的恶性肿瘤,2018年我国新发肝癌约39.28万人,死亡约36.89万人[8-9]。由于肝癌起病隐匿,许多肝癌患者在初次就诊时已处于中晚期,并且大部分合并肝功能异常甚至肝硬化等并发症,导致手术治疗或化疗效果不佳。因此处于中晚期的肝癌患者多采用姑息治疗,生存质量受到严重影响。越来越多的研究表明,miRNA在HCC的发生发展中起着重要的调控作用,对HCC的诊断和预后至关重要[10-11]。研究发现miR-196a、miR-17、miR-548b等miRNA可以通过调控其各自的靶基因参与HCC的发生和转移[12-14]。这些发现表明,miRNA可能作为HCC进展的新的生物标志物。MiR-34a是miR-34家族成员。miR-34a的编码基因位于1p36,单独转录表达。在以往的研究中发现,MiR-34a在黑色素患者中发现表达降低[15]。MiR-34a也被证明是脑胶质瘤的肿瘤抑制因子,其表达水平与患者的预后呈现负相关关系[16]。此外,MiR-34a被证明可以调节结肠癌细胞的多重耐药性[17]。但在目前,MiR-34a在肝癌中的研究较少。先前研究已报导在肝癌组织和细胞中MiR-34a的表达水平明显减弱[18-19],在本研究中,体外实验发现MiR-34a的过表达可以明显抑制肝癌细胞HepG2、Huh-7细胞的增殖、迁移和侵袭能力。
c-Met是肝细胞生长因子(hepatocyte growth factor, HGF)的高亲和性受体,作为一种酪氨酸蛋白激酶,c-Met对胚胎发育、器官发生和伤口愈合都至关重要[20-21]。而恶性肿瘤中异常的c-Met活化常与患者预后不良相关[22-23]。在肝癌组织中c-Met多表达于低、中分化肝癌,表达高者肝内外转移率明显升高,且表达水平与肝癌术后存活时间呈明显负相关目前已报道了许多阻断HGF/c-Met信号转导途径的抑制剂,如c-Met竞争抑制剂、小分子酪氨酸激酶抑制剂、抗c-Met单克隆抗体等[24]。在本研究中,TargetScan和miR-WALK分析预测提示c-Met可能是miR-34a的靶基因,进一步的双荧光素酶报告基因实验也证实了这一点。而在肝癌细胞HepG2中,miR-34a直接靶向抑制c-Met的表达。这提示miR-34a对肝癌细胞侵袭性生长的抑制作用可能是通过抑制c-Met的表达实现的。在体内实验也发现,miR-34a的过表达可以明显的抑制肿瘤的生长。因此,本研究证实,miR-34a可以靶向抑制肝癌细胞中c-Met的表达,同时提高miR-34a表达水平可以有效抑制肝癌细胞的增殖、迁移和侵袭,提示miR-34a可以应用于肝癌的靶向治疗。
综上所述,本研究表明在肝癌中,miR-34a可以通过抑制c-Met表达调控肝癌细胞的增殖、迁移和转移。这一结果进一步证明了miR-34a的抗肿瘤作用,为临床应用提供了实验依据。然而miR-34a通过c-Met参与调控肝癌细胞的生物学行为的相关机制尚不清楚,本课题组将在未来的研究中进行更深入地探索。
