胃饥饿素对肥胖小鼠胰岛素抵抗的影响
2020-03-28郭展宏邵加庆
郭展宏,臧 璞,邵加庆
0 引 言
胃饥饿素是胃底X/A样细胞分泌的一种脑肠肽,包含28个氨基酸。依据其N端丝氨酸残基是否酰基化分为2种形式:酰基化和去酰基化形式,其活性形式为酰基化,在体内主要以去酰基化形式存在,约占血液循环中总胃饥饿素的50%~90%。胃饥饿素广泛分布于体内诸多器官并发挥不同的生理作用[1]。目前唯一已知的胃饥饿素受体是生长激素促泌剂受体 (growth hormone secretagogue receptor-1α,GHSR-1α),短期应用酰基化可激活GHSR-1α,进而通过抑制腺苷酸活化蛋白激酶信号通路,增加肝糖输出并短暂升高血糖[2]。然而近年另有研究提示外源性胃饥饿素对血糖和胰岛素的影响可能是暂时的,经过长期胃饥饿素处理可以使血糖及胰岛素水平趋于平稳[3]。目前酰基化与去酰基化对机体糖代谢的影响尚存争议,胃饥饿素干预代谢的时间周期不同可能会产生不同的效应。本研究通过建立高脂饮食诱导的小鼠肥胖模型,旨在探究长期应用酰基化和去酰基化对肥胖小鼠体重、胰岛素抵抗及血清炎症因子水平的影响。
1 材料与方法
1.1 实验材料清洁级雄性4~5周龄C57BL/6小鼠32只,购自南京大学动物实验中心。动物许可证号:SYXK(军)2012-0047。饲养于清洁动物房,12h交替照明,自由进食进水,适应性喂养1周。将小鼠随机分为4组,每组8只。除对照组外,高脂组、高脂+酰基化组、高脂+去酰基化组小鼠进行高脂饮食诱导小鼠肥胖。对照组:标准饲料喂养,每日腹腔注射等渗盐水10 mL/kg;高脂组:高脂饲料喂养,每日腹腔注射等渗盐水10 mL/kg;高脂+酰基化组:高脂饲料喂养,酰基化胃饥饿素0.8 mg/kg;高脂+去酰基化组:高脂饲料喂养,去酰基化胃饥饿素0.8 mg/kg,每组8只。实验于喂养16周后结束。标准饲料喂养热量组成:蛋白质20%,脂肪10%,碳水化合物70%;美国Research Diet公司,D12450J。高脂饲料喂养热量组成:蛋白质20%,脂肪60%,碳水化合物20%;美国Research Diet公司,D12492。酰基化和去酰基化均购自加拿大AnaSpec公司。
1.2 实验指标每周称重小鼠体重。喂养16周后禁食12 h行葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT),腹腔注射5%葡萄糖注射液10 mL/kg。分别于注射后0 min、30 min、60 min、120 min行尾静脉取血测定血糖。绘制血糖波动曲线并计算曲线下血糖面积。随后处死小鼠,取出附睾脂肪并称重,计算附睾脂肪指数计算公式为:
附睾脂肪指数=100×附睾脂肪质量(g)/体重(g)
取血分离血清,采用ELISA方法检测小鼠血清胰岛素、IL-6、TNF-α水平,依据空腹血糖值和胰岛素水平计算胰岛素抵抗指数(HOMA-IR),HOMA-IR计算公式为:
HOMA-IR=血糖(mmol/L)×胰岛素(mU/L)/22.5

2 结 果
2.1 胃饥饿素对各组小鼠体重的影响高脂饮食6~16周,高脂组体重明显高于对照组(P<0.05)。给药12~16周,高脂+去酰基化组小鼠体重较高脂组明显减轻(P<0.05)。见表1。
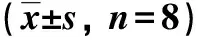
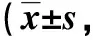

组别体重(g)第0周第2周第4周第6周第8周第10周第12周第14周第16周对照组19.31±0.8422.23±1.02 24.71±1.09 24.94±1.56 25.64±1.99 25.98±1.25 26.01±1.25 26.75±1.30 26.94±1.54 高脂组19.10±0.83 22.58±1.40 25.71±1.27 28.94±1.29∗31.45±1.66∗33.28±1.89∗35.76±2.07∗38.99±1.98∗41.94±2.04∗高脂+酰基化组19.21± 0.87 22.55±1.28 25.53±1.41 27.96±1.89 29.85±1.96 31.38±2.28 33.63±2.42 35.34±2.85#37.56±3.49#高脂+去酰基化组19.43±0.93 22.61±1.28 25.48±1.76 27.38±1.60 28.85±2.31 30.91±2.60 32.63±2.17#33.75±2.44#35.88±3.21#
与对照组比较,*P<0.05;与高脂组比较,#P<0.05
2.2 胃饥饿素对各组小鼠附睾脂肪质量及其指数的影响高脂饮食喂养16周后,对照组小鼠附睾脂肪质量及其指数均明显低于其余3组(P<0.05)。与高脂组相比,高脂+去酰基化组小鼠附睾脂肪质量显著下降(P<0.05)。见表2。



组别附睾脂肪质量(g)附睾脂肪指数对照组0.29±0.230.95±0.63高脂组1.08±0.11∗2.52±0.22∗高脂+酰基化组0.92±0.32∗2.66±0.66∗高脂+去酰基化组0.72±0.26∗#2.17±0.62∗
与对照组比较,*P<0.05;与高脂组比较,#P<0.05
2.3 胃饥饿素对各组小鼠血糖及空腹胰岛素水平和炎症因子的影响IPGTT结果显示,高脂组注射葡萄糖后0、30、60、120 min的血糖水平较对照组明显升高(P<0.05);血清IL-6及TNF-α水平较对照组亦显著升高(P<0.05);空腹胰岛素水平、胰岛素抵抗指数、AUC较对照组显著升高(P<0.05)。高脂+去酰基化组小鼠空腹胰岛素水平较高脂组显著降低(P<0.05)。高脂+酰基化组和高脂+去酰基化组胰岛素抵抗指数、IL-6、TNF-α水平较高脂组明显降低(P<0.05);0、30、60 min的血糖水平均较高脂组亦明显降低(P<0.05),且2组小鼠曲线下血糖面积均显著低于高脂组(P<0.05)。见表3、表4。
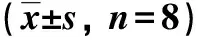
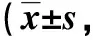
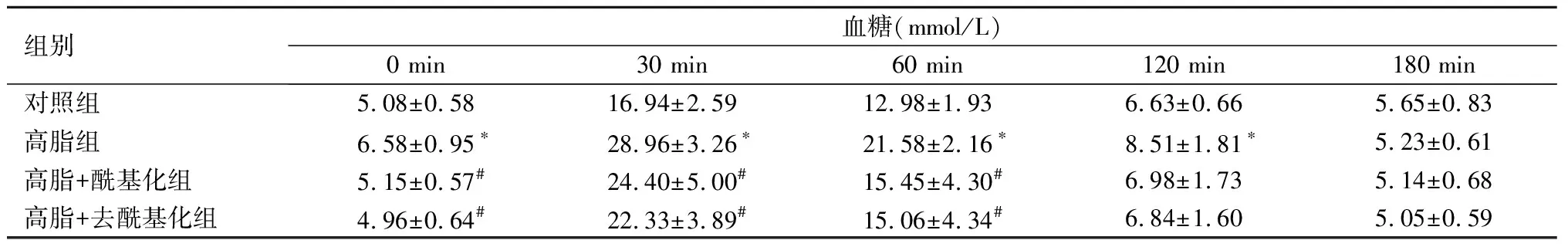
组别血糖(mmol/L)0 min30 min60 min120 min180 min对照组5.08±0.5816.94±2.5912.98±1.936.63±0.665.65±0.83高脂组6.58±0.95∗28.96±3.26∗21.58±2.16∗8.51±1.81∗5.23±0.61高脂+酰基化组5.15±0.57#24.40±5.00#15.45±4.30#6.98±1.735.14±0.68高脂+去酰基化组4.96±0.64#22.33±3.89#15.06±4.34#6.84±1.605.05±0.59
与对照组比较,*P<0.05;与高脂组比较,#P<0.05
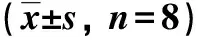
组别AUC空腹血糖(mmol/L)空腹胰岛素(mIU/L)胰岛素抵抗指数IL-6(pg/mL)TNF-α(pg/mL)对照组1735.38±200.705.07±0.6212.68±2.952.88±0.8419.73±3.7745.19±5.46高脂组2606.13±170.18∗6.58±0.95∗25.30±5.95∗7.49±2.58∗45.85±6.41∗81.70±7.53∗高脂+酰基化组1984.00±360.40#5.14±0.62#21.85±5.984.94±1.27#34.82±6.23#73.01±7.75#高脂+去酰基化组2077.50±404.70#4.96±0.69#18.24±4.00#4.08±1.35#36.90±5.27#69.39±8.43#
与对照组比较,*P<0.05;与高脂组比较,#P<0.05
3 讨 论
近年来,以肥胖和2型糖尿病为代表的代谢性疾病的发病率显著上升,正成为危害健康的严重公共卫生问题。肥胖可影响脂肪细胞因子的分泌[4],促进炎症介质释放并导致胰岛素抵抗发生[5]。本研究发现相比对照组,高脂组小鼠存在明显胰岛素抵抗,与以往研究结果一致[6]。
近年诸多临床研究发现胃饥饿素水平与2型糖尿病存在相关性。Qarni等[7]发现,2型糖尿病患者血清酰基化水平与胰岛素抵抗呈负相关。Barazzoni等[8]通过对代谢综合征受试者的5年随访之后发现,去酰基和胰岛素抵抗指数仍呈负相关。课题组前期研究亦显示,2型糖尿病患者去酰基、总Ghrelin(酰基化+去酰基)水平与BMI、HOMA-IR呈负相关[9]。然而胃饥饿素对糖代谢的调节作用目前尚存争议。既往认为酰基化能够激活唯一已知的胃饥饿素受体GHSR-1α而发挥生理作用[10],短期注射酰基化可激活胰岛GHSR-1α受体,抑制胰岛素分泌[11]。酰基化也可通过激活外周GHSR-1α受体,抑制AMPK信号通路,增加肝糖输出[12]。由于去酰基并不激活GHSR-1α,短期应用去酰基并不影响胰岛素分泌和血糖水平[13]。本研究发现长期应用去酰基可明显降低肥胖小鼠的空腹血糖、改善胰岛素抵抗。诸多研究亦表明去酰基能够控制饮食、调节血糖刺激的胰岛素分泌、脂质代谢等,可能均归因于GHSR-1α以外的调控机制[14-15]。
另外,不同于短期应用酰基化,Goshadrou等[3]发现注射酰基化21d后,大鼠空腹血糖及胰岛素水平相比第1天应用酰基化时均明显降低提示,长期应用酰基化能够抵消短期应用酰基化对糖代谢的不良效应。本研究亦发现应用酰基化16周后可明显降低肥胖小鼠空腹血糖、改善胰岛素抵抗,得到与去酰基类似效果[16]。综上,长期应用酰基化和去酰基均可能通过非依赖于GHSR-1α受体介导的某种机制调控机体代谢,改善机体胰岛素敏感性。
甘油三酯组织沉积增加引起的胰岛素抵抗是导致代谢综合征发展的重要因素[17],尤其内脏脂肪的增加与胰岛素抵抗的发生关系密切[18]。酰基化可增加脂肪含量[19]。在连续静脉输注酰基化2周后大鼠腹膜后及腹股沟脂肪明显增加,但皮下脂肪含量无明显变化[14]。而过表达去酰基的转基因小鼠的白色脂肪组织含量明显减少,尤其以附睾和肾周脂肪质量减少最为显著[15]。本研究中,高脂+去酰基化组附睾脂肪较高脂组明显减少,这对改善小鼠胰岛素抵抗有重要作用。
研究发现腹腔注射酰基化8周后可明显改善高脂饮食诱导的肝组织炎症反应和程序性细胞凋亡,并降低TNF-α和IL-6水平[20]。机体炎症水平下降亦有利于改善胰岛素抵抗状态[21]。Gortan等[22]研究发现,去酰基能降低肌肉组织活性氧的产生和炎症,同时激活丝氨酸激酶依赖性信号通路和胰岛素刺激的葡萄糖摄取。本研究结果显示,相比高脂组,高脂+酰基化组和高脂+去酰基化组小鼠IL-6及TNF-α水平均显著降低,血清炎症因子水平与胰岛素抵抗指数呈正相关[23],胃饥饿素亦可能通过降低血清炎症因子水平,一定程度改善机体胰岛素敏感性。
综上所述,本研究证实长期应用胃饥饿素(酰基化和去酰基)可降低肥胖小鼠体重、改善胰岛素抵抗并降低血清炎症因子水平,为改善肥胖糖尿病患者胰岛素抵抗提供新的思路。上述作用可能由ghrelin非依赖于GHSR-1α的某种未知受体所介导,尽管前人诸多研究结果表明可能存在独立于GHSR-1α之外的新受体[[3,13-14,20]],然而新的受体尚未发现,其具体代谢调控机制亦未阐明,仍有待进一步研究。
