3种糖尿病肾病动物模型的共同差异基因筛选
2020-03-27何海兰刘乐凯张浩军柳锐莲李宝嘉李治国
何海兰,刘乐凯,张浩军,柳锐莲,李宝嘉,李治国
0 引 言
近年来,糖尿病的患病率正在持续增加, 2017年全球糖尿病患者人数约有4.51亿,预计到2045年还将增加2.42亿[1-2]。糖尿病肾病(diabetic kidney disease,DKD)是糖尿病的微血管并发症,是导致肾衰竭的首要原因,同时也是导致糖尿病患者死亡的主要原因之一[3]。目前认为DKD与氧化应激、炎症、免疫、血流动力学的改变密切相关。虽然对DKD的研究取得了一定的进展,但DKD仍缺乏有效的治疗手段,具体发病机制尚未明确。DKD动物模型是研究DKD发病机制及药物治疗的一种重要手段。而各种动物模型出现的病理变化,激活的信号通路不尽相同,提示一些通路变化是由于各种动物模型的遗传背景不同造成的,而未必与DKD相关;在多种动物模型上均出现改变的基因和通路改变,可能是DKD发病过程中关键基因和通路,在DKD发病中起着更加重要的作用[4-6]。
GEO数据库中存贮着大量基因芯片数据,而基因芯片技术可以一次性的检测所有基因的变化。而生物信息学技术可以对数据库中储存的基因芯片等高通量数据进行进一步的加工和挖掘[7-8]。本研究对来自GEO数据库GSE33744数据集中BKS db/db、BKS eNOS-/-db/db和DBA-STZ 3种DKD小鼠的数据集进行深入生物信息学分析,发现3种小鼠共同变化的基因及通路,为发现DKD发病机制以及DKD的防治疗提供新的思路。
1 材料与方法
1.1 数据来源从GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)中下载GSE33744数据集,其检测平台为GPL1261 [Mouse430-2]Affymetrix Mouse Genome 430 2.0 Arry。其中涉及BKS db/db、BKS eNOS-/-db/db和DBA-STZ 3种DKD小鼠模型,3种DKD小鼠均出现明显的蛋白尿、肾小球系膜扩张和足细胞丢失等典型糖尿病肾病改变[4]。
1.2芯片数据预处理利用R语言Bioconductor 工具包 Affy包读取芯片CEL数据文件,将杂交信号转换成表达数据。对背景进行校正,利用鲁棒多芯片平均算法(Robust Multichip Average algorithm, RMA)对数据标准化,利用Bioconductor 中的annotate包对数据进行注释。
1.3筛选共同差异表达基因利用Bioconductor中的limma包进行差异表达基因的分析,筛选出每组DKD小鼠与对应正常小鼠的肾小球的差异基因。筛选标准为P<0.05,FC>1.5,即|logFC|>0.585。对3种鼠模型取交集,找到共同差异表达基因。
1.4富集分析为了确定共同差异基因富集的生物过程、细胞组分、分子功能以及生物途径,进行基因本体论(Gene Ontology, GO)富集和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes , KEGG)途径分析[9],使用生物学信息注释数据库(the database for annotation,visualization and integrated discovery,DAVID)对差异基因进行GO功能和KEGG通路分析。筛选标准为P<0.05。
1.5蛋白质相互作用(protein-protein interaction, PPI)网络的构建利用STING数据库构建这些差异基因的蛋白质相互作用网络,筛选标准为综合分数为≥0.4,并应用Cytoscape软件可视化并筛选高度(degree)的关键基因。
2 结 果
2.1 芯片质量控制及标准化基因芯片进行质量评估显示所纳入的芯片质量合格。 通过RNA降解曲线发现所有芯片的降解曲线斜率几乎一致,反应纳入的基因芯片合格。RMA标准化后基因均值处于同一水平,可以用于各组间比较。
2.2差异表达基因的筛选BKS db/db、BKS eNOS-/-db/db和DBA-STZ 3种糖尿病肾病小鼠分别有2632个、2466个和551个差异表达基因,三者取交集后有170个共同差异表达基因,其中72个共同上调基因,72个共同下调基因。
2.3差异表达基因的GO和KEGG分析应用DAVID对3种DKD小鼠中共同差异基因中表达一致的144个差异表达基因进行GO和KEGG分析,GO分析结果提示:差异基因主要富集在膜上(GO_CC:0016020,membrane),主要具有氧化还原活性(GO_MF:0016491,oxidoreductase activity),参与氧化还原过程(GO_BP:0055114,oxidation-reduction process)等。KEGG分析结果提示:差异基因主要参与PPAR信号通路(KEGG_PATHY:mmu03320, PPAR signaling pathway),花生四烯酸代谢(KEGG_PATHY:mmu00590, Arachidonic acid metabolism),丁酸代谢(KEGG_PATHY:mmu00650, Butanoate metabolism)和昼夜节律(KEGG_PATHY:mmu04710, Circadian rhythm)。
对上调差异基因和下调差异基因分别进行GO和KEGG分析,结果提示:上调差异基因主要富集在细胞外区域(GO_CC:0005576, extracellular region),主要具有水解酶活性(GO_MF:0016787, hydrolase activity),参与先天免疫反应(GO_BP:0045087, innate immune response)等,并且富集结核(KEGG_PATHY:mmu05152, Tuberculosis)通路途径,见图1。而下调差异基因主要富集在膜上(GO_CC:0016020, membrane),主要具有氧化还原酶活性(GO_MF:0016491, oxidoreductase activity),参与氧化还原过程(GO_BP:0055114, oxidation-reduction process)等,并且富集花生四烯酸代谢(KEGG_PATHY:mmu00590, Arachidonic acid metabolism),5-羟色胺能突触(KEGG_PATHY: mmu04726, Serotonergic synapse),亚油酸代谢(KEGG_PATHY: mmu00591, Linoleic acid metabolism),PPAR信号通路(KEGG_PATHY: mmu03320, PPAR signaling pathway)和类固醇激素的合成(KEGG_PATHY: mmu00140, Steroid hormone biosynthesis),见图2。
2.4差异表达基因的PPI网络分析利用STRING数据库对144个差异基因构建PPI网络,PPI网络由83个节点和198条边缘组成,见图3,每个节点代表一种蛋白质,边缘代表蛋白质之间的关系。根据中枢节点度选出最大的11个关键基因,分别为:Cd68(degree=17)、Ccl6(degree=17)、Fcer1g(degree=16)、Tyrobp(degree=16)、Clec4n(degree=15)、Lyz2(degree=14)、Ms4a6d(degree=13)、Ly86(degree=13)、Ctss(degree=13)、Cfp(degree=11)和Mpeg1(degree=11)。

图 1 上调差异基因富集过程
Figure1Enrichmentanalysisofup-regulationDEGs

图 2 下调差异基因富集过程
Figure2Enrichmentanalysisofdown-regulationDEGs
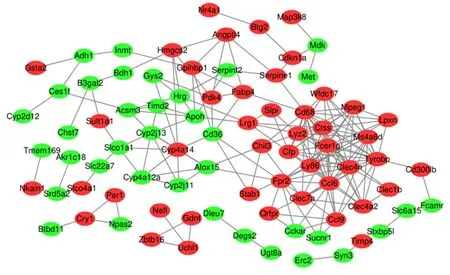
红色是上调差异基因,绿色是下调差异基因
图 3 PPI网络特性
Figure3PPInetworkcharacteristics
3 讨 论
DKD是终末期肾病的主要原因之一,在全球范围内造成沉重的医疗负担[10-11]。目前虽然对DND的发病机制有一定认识,但其发病详细机制上不明确。DKD小鼠模型在DKD发病机制及药物治疗中有重要作用。本研究中涉及3种DKD模型分别是STZ诱导的DBA2/J小鼠模型(1型DKD模型);纯合瘦素受体突变的C57BLKS遗传背景小鼠(BKS db/db小鼠,2型DKD模型)是一种肥胖2型糖尿病小鼠模型;靶向性删除内皮一氧化氮合酶的BKS db/db小鼠(BKS eNOS-/-db/db,2型DKD模型)。我们从GEO数据库下载了GSE33744数据集的3种DKD小鼠肾小球数据进行了重新分析,筛选出这3种鼠模型中共同差异基因及通路。
与各自正常对照相比,BKS db/db、BKS eNOS-/-db/db和DBA-STZ小鼠模型肾小球中差异基因数分别为2632、2466和551个。我们可以看到各种鼠模型中差异基因数目差别很大,提示在不同小鼠基因背景下,参与DKD发病的基因可能存在很大差异。当然这种改变也有可能是由于每组动物只数较少,基因芯片准确性较低,抽样误差等因素引起。本研究进一步将各组的差异基因取交集,共鉴定出144个共同差异基因,其中上调和下调差异基因各72个。GO分析发现,这些差异基因细胞定位显著富集在膜上,主要参与先天免疫反应、氧化还原过程、免疫系统过程和炎症反应等,其分子功能主要富集在氧化还原酶活性。KEGG结果提示差异基因富集在PPAR信号通路、花生四烯酸代谢、丁酸代谢和昼夜节律。并且本研究将上调和下调的差异基因做富集分析,提示上调的差异基因主要富集在细胞外区域参与先天免疫反应,主要具有水解酶活性,富集肺结核通路途径;而下调的差异基因主要富集在膜上,具有氧化还原酶活性,参与氧化还原过程,富集花生四烯酸代谢、PPAR信号途径和甾体激素的生物合成通路途径等。有趣的是,结果提示只有下调基因参与甾体激素的生物合成途径,甾体激素又称类固醇激素,其中肾上腺皮质激素具有调控糖代谢,使血糖升高,促进蛋白质转化成糖的作用。参与甾体激素的生物合成途径的基因有AKR1C18、CYP2D12和SRD5A2,据报道SRD5A2在糖尿病中显著下调[12],其具体影响糖尿病肾病的机制有待进一步研究。以前的研究表明,过氧化物酶体增殖物激活受体在DKD的发展中起着重要作用[13],它属于核受体家族成员,主要与炎症、糖脂代谢、胰岛素敏感性等密切相关,许多新型PPARγ激动剂有望成为下一代抗糖尿病药物的候选药物[14]。内源性花生四烯酸能够模拟血管紧张素II诱导纤连蛋白的表达[15],活性氧和TGF-β与糖尿病肾病的发病机制有关,糖尿病肾病的早期阶段也与肾钠处理和高血压的改变有关,两者都与花生四烯酸代谢过程相关[16]。最近研究发现,昼夜节律可促进糖尿病肾病的发展,许多昼夜节律靶基因是器官特异性的并且是与组织特异性功能有关。现有证据表明葡萄糖稳态、促纤维化机制和缺氧信号都受到昼夜节律的调节。很明显,生物钟是肾的关键调节器,但如何调控糖尿病肾病其机制有待进一步研究[17]。目前,丁酸代谢和DKD之间的研究几乎没有,可能为糖尿病肾病的机制研究提供一个新的线索。
对144个差异基因进行蛋白质相互作用网络分析,筛选出与DKD有关的关键基因,其中前11个为:Cd68、Ccl6、Fcer1g、Tyrobp、Clec4n、Lyz2、Ms4a6d、Ly86、Ctss、Cfp和Mpeg1。CD68是巨噬细胞标记物,其与DKD的直接研究较少,但其与炎症浸润,炎性因子表达水平上调关系密切[18],这些中枢基因可能为DKD的防治和治疗提供新的靶点。有趣的是,在PPI网络中花生四烯酸代谢途径过度出现,其中Cyp4a14明显上调,而CYP2J13、ALOX15、CYP4A12A和CYP2J11下调。据报道Cyp4a14、CYP2J13、CYP4A12A和CYP2J11属于细胞色素P450(CYP)家族的成员,细胞色素P450ω-羟化酶4A14(CYP4A14)是人类CYP4A羟化酶的同系物,其主要在小鼠的肝和肾中表达[19],可以催化小鼠中花生四烯酸的ω-羟化反应[20],CYP4A14基因的干扰会导致20-HETE上调;CYP4a12a过表达会导致20-HETE上调[21],而20-HETE是CYP代谢产物。另外,CYP2J13和CYP2J11在花生四烯酸代谢中也具有活性[22]。
综上所述,本研究通过信息学手段筛选出了在3种DKD动物模型共同差异基因及共同信号通路研究,提示这些差异基因和通路可能在DKD中扮演重要角色,对这些基因和通路的研究,可能使我们能够更加深入地理解DKD的发病机制,为DKD的预防与诊治提供新的靶点。
