草源型可溶性有机物降解过程中活性氧物种产生过程*
2020-03-27吴定桂江和龙
刘 新,吴定桂,,江和龙,宋 娜**
(1:南京林业大学生物与环境学院,江苏省环境工程重点实验室,南京 210037)(2:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)

天然水体中ROS的来源主要为水体中DOM的光化学反应[14-15],尤其是其中的有色可溶性有机物(CDOM)组分. CDOM是一类含有苯环、羧基和羰基等发色团的复杂混合有机物,能够吸收特定波长的太阳光. 在水生生态系统中,藻型湖区、草型湖区存在环境具有显著性差异[16],维持稳定生态系统状态的机理也完全不同,水体中DOM的来源及组分特征也存在较大差异,其中草型水生植物衰亡期植物残体的腐烂分解是湖泊水体中DOM的重要来源,然而目前关于草源型DOM释放ROS的过程并不清楚[17].
实际上,对于湖泊系统尤其是浅水湖泊来说,由于其具有更高的透光性,更强的水土界面物质交换,从而更易受外界环境影响[18]. 因此,随着全球气候变暖,湖泊富营养化,沼泽化过程使得河床被抬高,以及水生植被生态修复技术的推广运用,刺激了浅水湖泊中水生植物的过量生长[19]. 一方面水生植物在去除污染物、净化水质、改善水体治理以及恢复水体生态功能等方面发挥重要作用,其产生的ROS在去除污染物如有机污染物、重金属等方面同时发挥作用[20];另一方面,过量水生植物存在下,产生的大量ROS有可能对生态系统造成危害. 开展草型湖区水生植物产生ROS过程及机理的研究,既有利于了解水生植物产生ROS的环境行为,也有利于提高水生植物对水体污染物净化能力的认识.
本研究通过室内模拟实验,首先参考并选择了3种ROS(3CDOM*、1O2、·OH)的测定方法,接着选取了鄱阳湖具有代表性的草原植物——苔草(Carextristachya),获得典型草源型DOM提取液,分析了其DOM降解过程中ROS的产生过程及机理. 该研究对认识湖泊生态系统中DOM产生ROS的过程、迁移、转化、归宿及其作用机制具有重要的意义,在湖泊环境治理方面有重要的应用价值,同时为水生植物的生态修复功能提供重要的理论支持,以期对湿地生态系统修复提供一定的科学依据.
1 材料与方法
1.1 样品采集与处理
植物样品苔草(Carextristachya)采自于鄱阳湖南矶湿地国家级自然保护区(图1),装入聚乙烯密封袋,带回实验室,先用自来水冲洗附着泥土,再用去离子水冲洗3遍后,用吸湿纸去除表面水分. 将植株茎和叶剪约为5 mm长度,混匀后放入坩埚中于60℃烘干至恒重. 称取20 g烘干样品,置于5 L广口烧杯中,添加4 L蒸馏水,避光、室温放置2天,获得DOM浸出液[21].
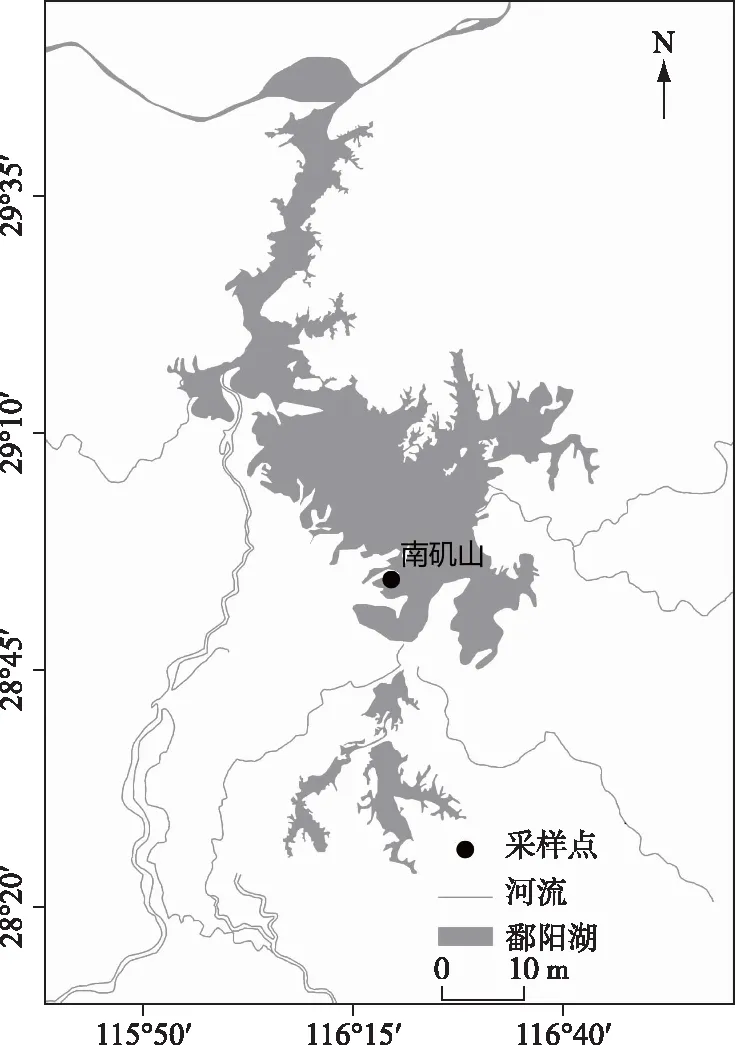
图1 鄱阳湖采样点位Fig.1 The sampling site in Lake Poyang
DOM浸出液用0.45 μm玻璃纤维滤膜过滤,再用0.22 μm滤膜过滤微生物后,分别取400 mL浸出液加入到500 mL广口石英瓶中,并加入捕获剂,每组做3个重复. 放置在温度为25℃的光照培养箱下,光源为紫外灯(UVA-340,40 W,LH仪器有限公司,北京,中国),并且避免其它光源干扰. 对照组用锡箔纸做避光处理. 无DOM的对照组为纯水中添加实验初始浓度捕获剂. 在实验一周内,每天按时采集DOM降解液. 水样在2 d内完成理化、光学指标的测定.
1.2 检测及计算方法
1.2.1 ROS测定方法 本实验中测定3种ROS:3CDOM*,1O2和·OH,分别用2,4,6-三甲基苯酚(TMP)、呋喃甲醇(FFA)和苯酚进行捕获[22-23],捕获剂同时添加,初始浓度分别为1、1、2 mmol/L,其中·OH检测产物为苯酚. 测定在高效液相色谱仪(Agilent 1200 series)上进行,紫外检测器进行检测,所有样品用甲醇和磷酸盐缓冲液(pH 2.8)洗脱,洗脱液为60∶40(甲醇∶磷酸盐缓冲液)混合物,流速为1.0 mL/min,TMP保留时间11 min,FFA保留时间3.4 min,·OH检测产物苯酚保留时间4.3 min,检测波长为220 nm. 测定TMP、FFA、苯酚的标准曲线,以及DOM降解过程中3CDOM*、1O2和·OH的浓度.
1.2.2 紫外光谱测定 CDOM吸收光谱采用SHIMADZU UV-2550紫外可见分光光度计进行全波段扫描,扫描波长范围为200~800 nm,比色皿为1 cm的石英槽,以Mili-Q水作空白,按公式(3)~(4)进行计算[24]:
a′(λ)=2.303×OD(λ)/r
(3)
a(λ)=a′(λ)-a′(700)·λ/700
(4)
式中,a′(λ)和a(λ)分别为未经散射校正和经过散射校正过后波长λ处的吸收系数,m-1;r为比色皿光程,m;OD(λ)为样品在波长λ处的吸光度值.
本文采用波长280 nm的CDOM吸收系数来表征CDOM浓度[25]. CDOM的光谱特征是由DOM的组分和浓度共同决定的,通过如下公式[26]将CDOM吸收系数标准化,可表征单位DOC浓度的CDOM对光的吸收能力:
a*(λ)=a(λ)/[DOC]
(5)
式中,a*(λ)为波长λ处的CDOM比吸收系数,L/(mg·m).
吸收光谱斜率S值的确定:CDOM吸收光谱从紫外到可见波长随波长的增加大致呈现指数衰减规律,公式为[27]:
a(λ)=a(λ0) exp[S(λ0-λ)]
(6)
本文采用光谱斜率比值(SR)表征CDOM分子量的变化,其计算方法为[28]:
SR=S(275-295)/S(350-400)
(7)
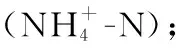
1.2.4 三维荧光光谱测定 水样稀释10倍后采用三维荧光分光光度计(Hitachi F-4500)测定水样的三维荧光光谱(EEMs). 激发波长(Ex)和发射波长(Em)的扫描区间分别为200~450和250~600 nm,步长分别为5和1 nm,扫描速率为2400 nm/min,带宽裂缝均为5 nm,光电倍增管电压为800 V. 扫描光谱进行仪器自动校正,以Milli-Q水作为空白.
在了解顶板结构特点及顶板运动规律、保证安全生产的基础上,对现有支架进行升级。目前支架存在的主要问题是其工作阻力无法充分发挥,对顶板控制效果差,来压时支架动载系数及活柱缩量大。提高现有支架对顶板控制效果,主要从提高支架额定工作阻力和支架工作阻力发挥效率2个方面着手。
1.3 统计分析
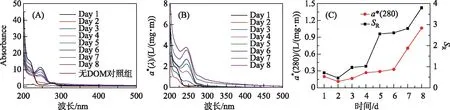
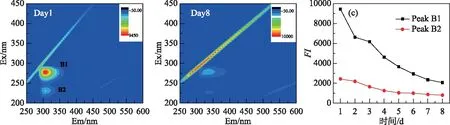
采用MATLAB进行数据拟合. 采用SPSS 19.0软件进行数据统计分析,P>0.05表示未达到显著检验水平;0.01 表1 3CDOM*、1O2和·OH标准曲线及其检测范围 图2 草源型DOM及对照组降解过程中DOC浓度Fig.2 Changes of DOC concentration during degradation of grass-source DOM and control group DOM光化学降解有两个途径,一是直接光降解,即溶解性有机质直接吸收光的能量发生的降解变化,另一个是间接光解,通过光照过程中生成的ROS的氧化作用;水中存在的中间介质吸收光子经过电子转移过程将能量传递给有机质,激发态的有机质进一步反应生成ROS[34],在光降解DOM产生ROS的过程中,DOC是一项直接反映DOM降解情况的指标. 如图2所示,DOC浓度从初始的1906.8 mg/L降为实验结束后的275.4 mg/L,紫外条件下草源型DOM浸出液光降解效果显著. 在降解中后期(2~8 d),DOC浓度在持续下降,在2~4 d期间降幅较大,之后平稳下降. 另外本实验设置了无光无微生物的对照组,实验结果显示无光无微生物处理下对DOC的降解没有影响. 另外在无DOM的对照组中,DOC浓度变化同样很低,推测主要由于3种捕获剂——TMP、FFA和苯在短时间内光降解反应速率很低的原因[35-36]. 在DOM降解过程中,从ROS产生来看3种自由基浓度均随着降解时间的延长而都有明显的增加(图3),其中·OH累积浓度在第7天和第8天有一定程度的下降. 实验结束时,3CDOM*累积浓度与1O2相近,分别为0.87和0.99 mmol/L,而最少累积浓度的ROS为·OH,为0.026 mmol/L. 本实验证实了草源型DOM能够在光分解过程中产生大量ROS,并且ROS随时间增加而逐渐上升. 并且这种关系与捕获剂的选择性加入密不可分,捕获剂持续捕获DOM降解过程产生的ROS,在随着时间的推移而逐渐累积的过程中,既保证了ROS不会长时间处于游离状态,也阻止了ROS参与其它化学反应,使得ROS能够稳定累积. 图3 DOM降解过程中3CDOM* (A)、1O2(B)、·OH (C)的浓度变化Fig.3 Changes of 3CDOM* (A), 1O2(B) and·OH (C) concentrations during the degradation of DOM 2.4.1 CDOM对ROS产生的影响 由图4A可知,捕获剂对光谱吸收系数影响较小. 在此基础上分析CDOM的光谱吸收系数. CDOM光谱吸收系数总体上呈现指数形式单调衰减,200~250 nm处紫外波段吸收系数最大,350 nm以后的波段吸收曲线较为平滑(图4B),这与国内外学者公认的CDOM光吸收特征相符合,因此CDOM在光降解过程中吸收度的减小具有不均衡性,对光的吸收也具有选择性,吸收损失都主要发生在320 nm以下的紫外区,其中UVB(275~320 nm)波段无论对陆源DOM,还是对生物自生源的DOM,都是最有效的辐照光谱区[21]. 在275 nm附近存在一显著的肩,该肩值与Warnock等[37]的报道结果一致,并且肩峰随着DOM光解时间的增加而增强,从实验初期无肩峰到后期肩峰突出十分明显. 然而,随着DOM降解时间的增加,CDOM相对浓度在第2天略微下降后开始上升,在第8天达到最大值. 另外,图4C给出了光谱斜率比值SR,SR表征CDOM的平均相对分子量,根据SR与相对分子量呈反比的关系可以看到随着DOM光解时间的增加,CDOM分子量逐渐降低,说明大分子逐渐被光降解为小分子. 图4 DOM和捕获剂的的紫外可见吸收光谱(A)和CDOM比吸收系数随波长的变化(B)及CDOM相对浓度和光谱斜率比值SR(C)Fig.4 Uv-vis spectra of DOM samples and probes (A) and CDOM absorption coefficient with different wavelengths (B) and relative concentrations of CDOM and spectral slope ratio SR(C) 进一步分析表明,随着DOC浓度的降低,CDOM组分中容易光降解部分先得到快速降解,a*(280)先有微弱降低(图4B),后剩余难光降解部分,光解速度较慢,但由于DOC在持续降低,标准化后的CDOM吸收系数(a(280)/[DOC])在第2~8天能够呈现明显上升趋势,整体与ROS累计含量呈现正相关关系(表2),尤其与3CDOM*、1O2浓度显著性水平较好(P=0.031、0.035),相关系数分别为0.753、0.742. 虽然CDOM与·OH 呈现正相关关系,但显著性水平一般(P=0.231). 结果证明ROS的产生与DOM中的光敏感物质——CDOM密切相关,CDOM中含有大量的发色基团,是重要的天然光敏剂,在紫外辐射或太阳光照射下吸收光子能量,引发一系列反应. 单线态(state DOM singlet,1DOM)分子吸收光能先转化为激发单线态(excited state DOM singlet,1DOM*),进而转化为激发三线态(excited state DOM triplets,3DOM*)(公式(8)),进一步与溶解氧分子等发生一系列反应(公式(9)~(12)),产生3CDOM*、1O2、·OH等活性中间体[36]. CDOM + hυ →1CDOM →3CDOM* (8) 3CDOM*+ H2O(OH-) → CDOM-H· +·OH(CDOM-·+·OH) (9) 3CDOM*+ O2→ CDOM +1O2 (10) 3CDOM*+ R → CDOM-· + R-· (11) (12) 表2 CDOM含量与3CDOM*、1O2、·OH浓度的相关系数 Tab.2 Correlation coefficient CDOM content and the concentration of 3CDOM*, 1O2 and ·OH 系数ROS3CDOM*1O2·OHr0.7530.7420.478P0.0310.0350.231 (13) HNO2+ hυ→·OH +·NO (14) 图5 DOM降解过程中水体中和DOP(F)浓度Fig.5 The concentrations of TN(A), DIP(E) and DOP (F) in the water during the degradation of DOM 2.4.3 DOM光解过程产物荧光分析 图6为DOM光解过程中3D-EEMs图. 从DOM降解液中发现了强烈的类蛋白荧光峰[39],其中B2激发波长最大值分别在225 nm处,发射波长最大值在306 nm处,为低激发光络氨酸荧光组分;B1(275 nm/306 nm)为类络氨酸荧光组分[40]. 随着光解时间的增加,这两个区域的荧光强度明显减弱,在处理第8天后,络氨酸荧光峰(Peak B2)几乎完全消失,仅在Ex/Em= (220~250) nm/(300~350) nm残留很弱荧光峰,而类络氨酸峰荧光指数FI衰减率也达到了80%(图6C),表明DOM发生了显著的光化学降解,主要为类蛋白分子的降解. 表3 ROS与水质参数的相关系数 同时有着较强的紫外激发波段的类蛋白分子证明CDOM吸收光谱在紫外波段迅速衰减变化的现象. 本研究在紫外光照条件下,对在低激发类蛋白荧光峰的强度变化与ROS进行相关性分析发现(表4),类蛋白荧光峰值强度与ROS累积浓度呈现明显负相关关系,其中类络氨酸荧光组分峰值强度与ROS浓度之间具有较高的显著性水平(P=0.001),r在-0.976~-0.938之间. 低激发光络氨酸荧光组分与ROS累计浓度呈现出同样极高的显著性水平(P=0.001)和相关性. 进一步说明了在DOM的光降解过程中蛋白质分子的降解是产生ROS很重要的一个部分. 目前,Zhang等[41]通过比较污水DOM中各组分产生ROS的情况,也发现含有大量的多肽类和蛋白质的亲水性成分相比疏水性成分和中性成分可产生更多的ROS. 图6 DOM降解第1天和第8天的EEMs谱图(A, B)及类蛋白荧光组分峰强变化(C)Fig.6 The EEMs spectra of the first and eighth day(A, B) and changes of fluorescence component peak intensity of protein-like proteins during the degradation of DOM(C) 表4 ROS与类蛋白荧光组分峰值强度的相关系数 Tab.4 The correlation coefficient between ROS and fluorescence component peak intensity of protein-like proteins ROSFI(Peak B1)FI(Peak B2)rPrP3CDOM*-0.9380.001-0.9610.0011O2-0.9760.001-0.9610.001·OH-0.9410.001-0.9590.001 本研究中,CDOM吸收光谱从紫外到可见区通常情况下都可近似呈指数形式降低,但DOM降解液在275 nm处出现肩峰,破坏了这种指数衰减规律,这种现象在污染比较严重的太湖[42]、厦门筼筜湖及一些近海海域[37]也有观测到,但还没有非常明确的解释.并且肩峰随着DOM光解时间的增加而增强,从实验初期无肩峰到后期肩峰突出十分明显.综合考虑在太湖、筼筜湖等的观测结果,推测该峰的出现和增强或可用来指示水环境中现场生物(如藻类、草类、微生物)活动对CDOM的贡献,同时也反映了水体中草类DOM光学性质的变化,导致了结构或性质有所不同的CDOM的产生[43]. 另外在本研究中,DOM降解液的荧光指数FI≥2.08,是典型水体植物释放液. 有研究发现B1(275 nm/305 nm)为陆源物质的光化学降解产物,Peak B2也与文献中提到的C5峰十分相近,解释为光化学降解产物[44]. 水体中也经常存在陆源DOM的汇入,使水环境中DOM组成和结构更丰富. 由于自然水体的复杂性,DOM产生ROS的过程会随着不同类型DOM和其他影响因素的改变而变化,不同形成环境DOM产生ROS的能力有所不同,比如一般陆源DOM产生1O2的能力整体上要强于水源DOM,并且不同来源的DOM其产生1O2的能力也存在差异[45]. 在水生生态系统中,草型DOM的ROS光化学行为研究有助于了解水体中污染物的转化机制及其环境归趋. 由DOM介导或直接产生的ROS对于本身光化学活性差或者没有光化学活性的污染物可以进行直接光解,但对于本身具有光化学活性、可以直接光解的污染物,DOM会抑制其光化学转化和降解. 不同来源的DOM都会具有一些光吸收的基团,都存在不同程度的光吸收,如本研究草型DOM中的类蛋白分子在UVB波段的显著吸收,因此DOM对污染物的光屏蔽是一个相对普遍的抑制机制. 同时对于本研究中的草型DOM释放不同ROS来看,每种ROS的产生速率也有较大差异,对于不同性质、不同来源的水体释放ROS能力有差异,产生的ROS种类、浓度及行为都有不同,并且不同的光解反应、光解条件或光解时段下可能是不同的ROS占主导[4]. 1)利用TMP、FFA和苯的混合捕获剂优化了3CDOM*,1O2和·OH的测定方法,对DOM光降解过程中产生3CDOM*,1O2和·OH的累积浓度进行检测. 2)3CDOM*的释放量相较于1O2和·OH最多,·OH释放量低于3CDOM*和1O2两个数量级. 3)DOM降解过程中,CDOM与ROS累计浓度呈现正相关关系,与3CDOM*和1O2浓度显著性水平较好,进一步证明CDOM是产生ROS的重要来源和介导. 5) 类蛋白荧光峰值强度的衰减与ROS累积浓度呈现明显负相关关系,说明在DOM的光降解过程中蛋白质分子的降解是产生ROS很重要的一个部分.2 结果与讨论
2.1 ROS测定方法的构建


2.2 草源型DOM降解过程中DOC变化情况
2.3 草源型DOM降解过程中ROS变化

2.4 草源型DOM分解过程中ROS产生机理分析

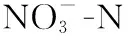



3 讨论
4 结论
